2021 年 61 巻 1 号 p. 18-23
2021 年 61 巻 1 号 p. 18-23
症例は49歳男性.2005年に気管支喘息重積発作による心肺停止状態となった.覚醒後に動作時のミオクローヌスが出現し,Lance-Adams症候群(LAS)と診断された.発症11年後にペランパネルを開始しミオクローヌスは著明に減少し,3年以上持続してactivities of daily lifeが改善した.近年進行性ミオクローヌスてんかん症候群にペランパネルが有効な報告があり,本例のようにLASのミオクローヌスに対してもペランパネルによる治療の余地がある.
Perampanel is an α-amino-3-hydroxy-5-methyl-4-isoxazolepropionic acid receptor antagonist that has been marked as an antiepileptic drug for partial-onset and primary generalized tonic-clonic seizures. There have been some recent reports of perampanel being effective against cortical myoclonus by Lafora disease and Unverricht-Lundborg disease. We herein report a 49-year-old man who presented with myoclonus due to Lance-Adams syndrome (LAS) after cardiopulmonary arrest caused by a severe bronchial asthma attack. Perampanel was very effective against myoclonus induced by LAS even in the chronic state, over 10 years after the remote onset. Perampanel should be considered for the treatment of extremely refractory myoclonus due to LAS.
Lance-Adams症候群(LAS)は麻酔後の心停止や術後の気道閉塞に起因する急性低酸素性脳症4例が昏睡からの回復過程で全身のミオクローヌスを呈した1963年の報告に由来する1).小脳遠心路の中継核である視床外側腹側(ventrolateral nucleus,以下VLと略記)核から発せられた視床皮質路線維の同期性反復性反射が,大脳皮質運動野のニューロンを興奮させ錐体路を介してミオクローヌスを出現させると推測している.現在はセロトニンの前駆物質L-5ヒドロキシトリプトファン(L-5-HTP)が治療に有効な事,脳脊髄液検査でセロトニンの代謝産物である5-ヒドロキシインドール酢酸(5-HIAA)が低下し2),治療後に上昇する3)事から背側縫線核の障害が示唆されている.[18F]-Fluorodeoxyglucose positron emission tomography(FDG-PET)で低酸素脳症後のミオクローヌス発症例で橋被蓋及び両側VL核に有意な糖代謝亢進が示されたり4),LAS症例のsingle photon emission computed tomographyで右基底核及び左側頭葉の血流が低下していた事5)も報告されている.剖検脳で大脳皮質,小脳,基底核,視床及び縫線核に神経細胞脱落を認める事6)から脳内セロトニン伝達系機能異常がLASのミオクローヌスに関与していると考えられている7).いずれにしてもLASの病態の詳細は明らかではない.
ペランパネル(PER)は,中枢神経に広く分布するシナプス後膜の興奮性グルタミン酸受容体(glutamate receptor,以下GluRと略記)の一つでてんかん性活動の発生・伝播に関与するα-アミノ-3-ヒドロキシ-5-メソオキサゾール-4-プロピオン酸(AMPA)型GluRに対し選択的・非競合的に拮抗する事により,神経細胞の過剰な興奮を抑制する.本剤は部分・強直発作に対する併用療法として適応があるが,近年進行性ミオクローヌスてんかん症候群の皮質ミオクローヌスに有効な報告がある8)~10).本例は気管支喘息重積発作による心肺停止後のLASによる重症ミオクローヌス発作に対して10年以上経過してもPERが有効であった.OiらのPt 16に相当し10),本稿で報告する.
症例:49歳,男性
主訴:動作時ミオクローヌス
既往歴:幼少時より気管支喘息.
家族歴:特記事項なし.
現病歴:2005年6月に気管支喘息発作により救急車内で心肺停止状態となり,約16分間の心肺蘇生後,遷延性意識障害を呈した.1ヶ月半後に改善したものの動作時ミオクローヌスが出現しLASと診断された.ピラセタムに抗てんかん薬が併用された.2006年11月当院を受診し,抗痙縮薬などを追加し日常生活動作(activities of daily life,以下ADLと略記)は改善したが,ミオクローヌスは改善しなかった.2012年レベチラセタムを追加し,2015年京都大学医学部附属病院神経内科へ入院した.
内服薬:ピラセタム15 g/日,クロナゼパム3.75 mg/日,カルバマゼピン600 mg/日,バクロフェン20 mg/日,エチゾラム0.5 mg/日,アルプラゾラム0.8 mg/日,プリミドン500 mg/日,ジアゼパム6 mg/日,当帰芍薬散7.5 g/日及びレベチラセタム2,500 mg/日.
入院時現症:一般身体所見に特記事項はなし.神経所見では,意識清明で脳神経では発語はゆっくりだが音自体の歪みは大きくなく,流暢であった.嚥下は軽度の障害で普通食は摂取できていた.運動系では四肢体幹部でミオクローヌスが安静時のみならず姿勢時や動作時に出現し,特に歩行,食事を口に運ぶ動作や書字が困難であった.皮膚への軽い刺激でも増強された.また筋緊張に左右差はなく,上肢に筋力低下はなく,下肢はミオクローヌスのため評価が困難で,立位保持は困難であり常時車椅子に乗車していた.感覚系に明らかな異常はなく,協調運動では指鼻試験で開始時及び目標到達時にミオクローヌスが増強,diadochokinesisはゆっくりではあるもののリズムは整で左右差はなかった.踵膝試験はミオクローヌスが強く施行できなかった.四肢の深部腱反射に左右差はなく正常範囲で,病的反射もなかった.ミオクローヌススコア(0~4)8)9):marked, causing incapacity = 4.ADLスコア(0~36)8)9):21(全身痙攣0,歩行失調4,構音障害1,食事4,嚥下1,着衣3,用便3,書字2,精神症状3)と高度の障害を認めた(Table 1).
| Score | A year before add on PER | 6 months after add on PER | 3 years after add on PER |
|---|---|---|---|
| Myoclonus score | 4 | 3 | 1 |
| ADL score | |||
| Generalized Convulsion | 0 | 0 | 0 |
| Ataxic gait | 4 | 3 | 3 |
| Dysarthria | 1 | 1 | 1 |
| Eating | 4 | 2 | 2 |
| Swallowing | 1 | 0 | 0 |
| Dressing | 3 | 3 | 3 |
| Hygiene | 3 | 3 | 3 |
| Hand Writing | 2 | 1 | 1 |
| Sleep Disturbance | 3 | 2 | 1 |
| Total | 21 | 15 | 14 |
ADL = activities of daily life; PER = perampanel. Evaluation criteria for myoclonus score. Absence of myoclonus = 0, mild myoclonus without disturbance of daily activity = 1, some disturbance of daily activity = 2, clear disturbance of daily activity = 3 and causing incapacity = 4. Evaluation criteria for ADL score. Severe = 4, Moderate = 3, Mild = 2, Slight = 1, None = 0. ADL score and Myoclonus score were both adopted from Ikeda A. et al. Mov Dis 1996;11:691-70012).
入院時検査所見:血液検査に異常はなく,脳脊髄液検査では蛋白32.9 mg/dl,細胞数11/μlであった.Wechsler Adult Intelligence Scale-IIIは言語性のみで施行し,言語性IQ:84,言語理解VC:93,作動記憶WM:81と軽度の低下が見られ,レーブン色彩マトリックス検査は33/36点であった.脳波は基礎律動が8~9 Hzの後頭部優位で明らかなてんかん性放電はなかった.脳MRIでは脳幹,両側前頭側頭葉の萎縮が見られ(Fig. 1A~C),FDG-PETでは,脳幹,中小脳脚及び両側前頭葉に低集積を示し(Fig. 1D, F, G),両側線条体及び両側頭頂葉に相対的高集積を示した(Fig. 1E~G).正中神経刺激の体性感覚誘発電位検査(somatosensory evoked potentials,以下SEPと略記)はミオクローヌスにより同定困難であったが,正中神経刺激でC-reflexが出現した(Fig. 2A, B).

T2-weighted images showed atrophy in the brainstem (A), bilateral frontal lobes and bilateral temporal lobes (B, C). PET scans showed a bilateral decrease in glucose metabolism at the brainstem and the middle cerebellar peduncle (D, G) and the frontal lobes (E–G), whereas increased activation relatively in the bilateral basal ganglia (E, G) and the bilateral parietal lobes (F, G) were also observed.
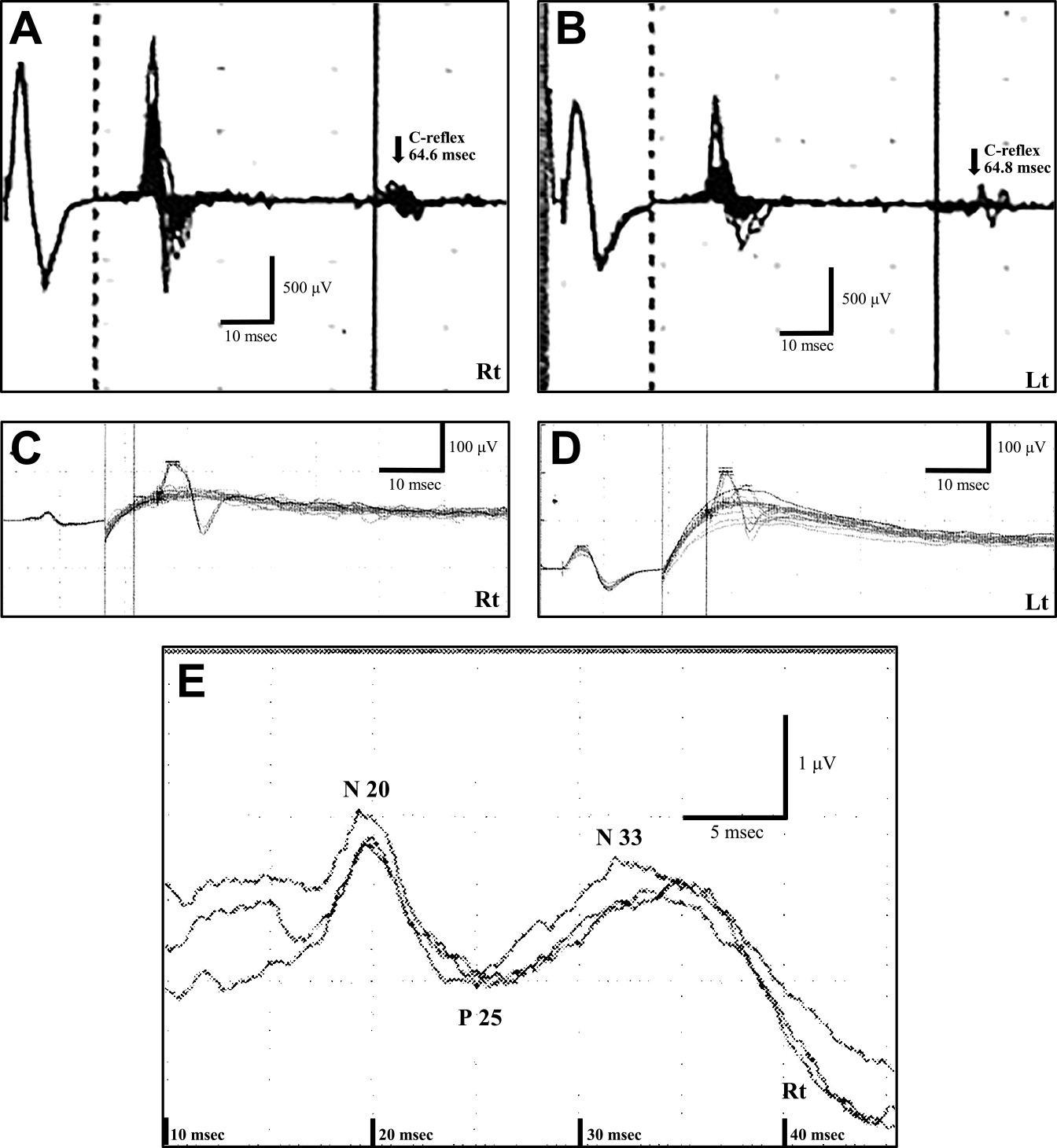
C-reflex examinations were done at the age of 45 years (A, B) (Kyoto University Hospital) before PER was on, and 3 years later (48 years) with PER of 10 mg/day (C, D) (Nissan Tamagawa Hospital). SEPs to the right median nerve stimulation at the wrist and C-reflex were examined together at 48 years (C–E). C-reflex waves were appeared at the mean 64.6 msec on the right side and the mean 64.8 msec on the left side before add-on PER (A, B). However, C-reflex waves were not detected after 3 years with PER 10 mg/day (C, D). SEP waveforms to the right median nerve stimulation were normal range (N20–P25: 1.81 μV, P25–N33: 1.35 μV; P25 latency: 25 msec, N33 latency: 32–33 msec; Fig. 2E).
入院中及び退院後の経過:ミオクローヌスに対してクロナゼパムを4 mg/日へ増量し退院した.その後ミオクローヌス後の意識消失発作が複数回出現し,二次性全般化発作の可能性も示唆された.2016年PERが保険診療に承認され,同年12月よりPERを2 mg/日から開始し,速やかに安静時ミオクローヌスが軽減した.投薬開始半年後にミオクローヌススコア:clear disturbance of daily activity = 3,ADLスコア:15と軽減した(Table 1).その後PER 10 mg/日,ピラセタム20 g/日,クロナゼパム1.5 mg/日,レベチラセタム2,000 mg/日による治療で安定した.投与開始後3年,10 mg/日で記録された正中神経刺激のSEP検査でC-reflexは出現せず(Fig. 2C, D),SEPはむしろ低振幅であった(Fig. 2E).PER血中濃度は1810 ng/mlと高値であった.PER治療開始約4年後の現在,立位練習をしており動作時に軽度・短時間のミオクローヌスが出現するだけである.ミオクローヌススコア:mild myoclonus without disturbance of daily activity = 1,ADLスコア:14へと著明に改善した(Table 1).
LASのミオクローヌスのほとんどは皮質ミオクローヌスに分類され,電気生理学的にSEPでは早期成分が高振幅になり巨大SEPを示し,長潜時反射が亢進している事から電気刺激後の長い潜時での筋活動を記録したC-reflexが検出される事がある.本例ではPER開始1年前にC-reflexは認められたが,約4年後のSEPはむしろ低振幅で,C-reflexも検出されなかった.治療後のC-reflexの消失は病態の改善を反映した可能性はあるが,治療前後1回ずつの検査で再現性は担保されていない.
皮質ミオクローヌスの治療薬は,進行性ミオクローヌスてんかんに対して二重盲検試験11)及びわが国で非盲検試験12)が行なわれたピラセタム,ピラセタムと類似構造のレベチラセタム13),GABA系作用を増強するクロナゼパム14)などが推奨されている.Steinhoffらは36歳の心停止1年後のLAS症例にピラセタム及び多剤抗てんかん薬にPER 4 mg/日を加えてミオクローヌスに奏効し4週間は消失した15),Limらは63歳の心臓バイパス術中心停止3ヶ月後のミオクローヌスに対して多剤抗てんかん薬が投与され,6年後にPER 4 mg/日でミオクローヌスに奏効し2ヶ月間は歩行可能であったと報告した16).Oiらは18例の患者(進行性ミオクローヌスてんかん16例)でPER投与量は平均3.2 ± 2.1 mg/日で,ミオクローヌススコア,ADLスコアの有意な改善,giant SEPの潜時延長と振幅低下を示した10).本例は発症11年後にPER治療を開始し,3年以上経過してなお維持できている事は特筆に値する.
ランダム化二重盲検プラセボ第III相試験(1,109患者)において,PERで治療した典型的な部分発作患者の有効血中濃度は180~980 ng/mlであり安全に使用できたとしている17)18).本邦ではPER投与によりてんかん発作頻度が50%未満に抑制できた21症例(76症例中)ではPER平均血中濃度は450 ng/ml(85~1,500 ng/ml)で,PER低濃度症例でも発作は消失している19).本例の維持期でのPER血中濃度は高値で,ミオクローヌスに対して年余にわたり有効であるため減量する余地がある.またPERの血中濃度と他の抗てんかん薬の影響の検討では,カルバマゼピンはPERのmaximum plasma concentration(Cmax)を26%低下,area under the plasma concentration(AUC)を67%低下,フェニトイン・トピラマートはPERのAUCをそれぞれ50%・20%低下する一方,PERは検索された抗てんかん薬いずれの血中濃度にも影響を及ぼさなかった18).いずれの薬剤も本例へのPER使用開始時には使用していない.
Oiらは,PER血中濃度とgiant SEPのP25などの潜時の延長に正の相関を示している8).PER開始3年後でのP25潜時は25 msecと正常範囲であったが,本例のPER開始前のSEP波形は同定困難であった.また比較的低濃度のPERの状態ではシナプス後膜レベルで巨大SEPとして誘発されるものの,個々のニューロンレベルでのてんかん性活動の本体である発作性脱分極変位paroxysmal depolarization shifts(PDS)=giant excitatory postsynaptic potentials(EPSP)の発現がtemporal dispersionを起こす事でP25, N33の潜時延長が起こると推察している10).
カルバマゼピンやフェニトインなどのNaチャネルブロッカーは全て抗発作薬であり一般的にシナプスに到達する前のaxon,シナプス後膜,及びシナプス後膜以遠のaxonの3領域でNa+チャネルをブロックし活動電位の発生と伝播(軸索伝導)を抑制するが,PDS即ちgiant EPSPの発生部位であるシナプス後膜部分では直接の作用はないかあっても程度は低い10).PDSの発生にはグリア細胞に由来するGluの遊離と,これにより活性化されるイオンチャネル型GluRの関与が示唆されている.レベチラセタムはラットの実験でシナプス前終末P/Q型CaチャネルからCa++の細胞内流入を阻害し,PDSの振幅及び潜時を用量依存的に抑えた事20),PERは直接シナプス後膜でてんかん性活動の本態であるPDSを抑制する事から,上記の新規薬剤は抗てんかん原性薬としての作用も期待されている8)21).この作用機序の違いが,皮質ミオクローヌスへの効果の大きな違いとなっている事が想定される.
気管支喘息重積発作による心肺停止後のLASによる重症ミオクローヌス発作に対して長期経過後にも関わらずPERが奏効した1例を報告した.
謝辞:本原稿の考察部分で貴重な御意見を賜りました,独立行政法人国立病院機構福島病院病院長 杉浦嘉泰先生と大阪薬科大学薬品作用解析学研究室 大野行弘教授に深謝致します.
※本論文に関連し,開示すべきCOI状態にある企業・組織・団体
○開示すべきCOI状態がある者
池田昭夫:講演料:エーザイ株式会社,大塚製薬株式会社,ユーシービージャパン株式会社,企業などが提供する寄附講座:大塚製薬株式会社,グラクソ・スミスクライン株式会社,日本光電工業株式会社,ユーシービージャパン株式会社(寄附講座=2018年5月31日まで.京都大学大学院医学研究科てんかん・運動異常生理学).エーザイ株式会社,大塚製薬株式会社,日本光電工業株式会社,ユーシービージャパン株式会社(産学共同講座=2018年6月1日から.京都大学大学院医学研究科てんかん・運動異常生理学).
○開示すべきCOI状態がない者
齋藤和幸,大井和起,稲葉 彰,小林正樹,和田義明
本論文に関連し,開示すべきCOI状態にある企業,組織,団体はいずれも有りません.