2017 年 34 巻 3 号 p. 171-175
2017 年 34 巻 3 号 p. 171-175
腎性副甲状腺機能亢進症(Renal Hyperparathyroidism;RHPT)は,透析患者を含む慢性腎臓病(Chronic kidney Disease;CKD)の重要な合併症である。RHPTの発症には,リンの体内への貯留によるFibroblast Growth Factor 23(FGF23)の上昇がトリガーとなっていることがわかってきた。FGF23は,リン利尿を促す以外にビタミンDの活性化を抑制し副甲状腺ホルモン(Parathyroid hormone;PTH)を上昇させることや心肥大をもたらす可能性が示唆されている。RHPTは,腎機能障害環境下では徐々に進行するが,それは副甲状腺のサイズに反映される。初期の段階ではびまん性過形成であるが,進行すると結節性過形成から単一腺腫に至り,内科的治療に抵抗することがわかっている。RHPTの症状あるいは所見には骨関節症状に加え,心機能抑制,精神神経筋症状があり,さらに血管石灰化が重要であり,血清リン,カルシウムあるいはPTH濃度の上昇が進展に関与している。血管石灰化は心血管病発症のリスク因子であり生命予後にも関連しており,今後の対策が待たれる。
腎性副甲状腺機能亢進症(Renal Hyperparathyroidism;RHPT)は,慢性腎臓病に伴う骨ミネラル代謝異常(Chronic Kidney Disease-Mineral and Bone Disorder;CKD-MBD)の主たる病態である。CKD-MBDは腎と骨との連関のみでなく,全身性の代謝疾患であり,かつ血管石灰化などを介して生命予後と関連していることで注目されている[1]。RHPTを含むCKD-MBDの病態に関して,日々新たな知見が報告されてきているが,まだ完全にわかっているとは言えない。本稿では,RHPTの病態ならびに臨床症状を中心に概説する。
RHPTの発症機序を図1に示す。ネフロンの減少した状態で,食物からリンが消化管で吸収されると,シグナルが骨組織に伝わり,主に骨細胞から線維芽細胞増殖因子23(Fibroblast Growth Factor 23;FGF23)が分泌される。FGF23は腎の近位尿細管に存在するナトリウム依存性リン酸トランスポーターIIb(Na-Pi IIb)を抑制し,尿中リン排泄を増加させることで,血清リン濃度の上昇を抑制している。血清FGF23濃度の上昇は,腎における1α水酸化酵素活性を低下させることで,活性型ビタミンDの産生を減少させ,腸管からのカルシウム吸収低下から血清カルシウム濃度の低下をもたらす[2,3]。副甲状腺細胞にはビタミンD受容体ならびにカルシウム感知性受容体が存在し,血清活性型ビタミンD濃度あるいは血清カルシウム濃度の低下は,副甲状腺ホルモン(Parathyroid Hormone;PTH)の産生ならびに分泌を促し,RHPTが発症する[4]。RHPTの発症をどのように定義づけるかに関する明確な基準はないが,GFR60ml/min/1.73m2前後と考えられる(図2)[5]。
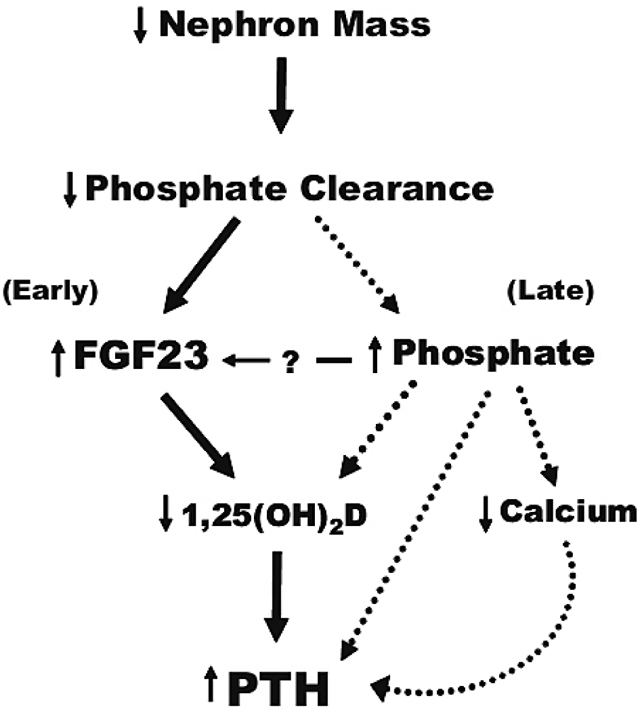
RHPTの発症メカニズム(Gutiérrez OM CJASN 2010;5:1710-1716 改変)

腎機能低下とMBD各種パラメータの変化(John GB et al.:Am J Kidney Dis.2011;58(1):127)
RHPTの発症進展に従い,副甲状腺は4腺が不均一に腫大するが,その理由ははっきりしない。腫大腺は初期の段階では多クローン性に増大するびまん性過形成であるが,さらに進行すると結節性過形成,さらには単クローン性の腺腫となる(図3)[6]。副甲状腺の腫大に伴い,ビタミンD受容体ならびにカルシウム感知性受容体の密度が減少することが報告されており,活性型ビタミンD製剤などの薬剤に対する抵抗性が増強する[7,8]。機能的には血清カルシウム値とPTH値との関連を示すS字曲線ならびにセットポイント(PTH最大分泌の50%抑制する血清カルシウム濃度)が右上方に移動することが示されている(図4)[9]。

副甲状腺組織の変化(Tominaga Y, et al.: World J Surg. 1996 Sep ; 20(7): 744-750 改変)

カルシウム・PTH曲線(Brown EM. Physiol Rev 1991)
典型的には過剰なPTHによる骨代謝回転の亢進により,骨吸収が骨形成を上回り骨量の減少が認められ,それによる骨痛をきたすことがある。最近ではいわゆる線維性骨炎をきたすほどのRHPTは稀であるため,かつてのように骨関節症状を認めることは少なくなった。しかしながら,加齢やフレイルなどの影響による骨量低下がRHPTに加わる症例が多くなった。本邦において高い血清PTH濃度と大腿骨頸部骨折のリスク上昇との関連が報告されている[10]。一方,血清PTH値が低い症例における無形成骨も骨折のリスクが高い。
2)骨関節外症状①心症状
PTHが心臓に直接作用し,心室性不整脈の発生,左室の収縮能あるいは拡張能を低下させる可能性がある。副甲状腺摘除術(Parathyroidectomy;PTx)により,心機能の改善を認めることがある。
②貧血症状
進行したRHPTは骨髄の線維化をもたらすことで,造血能に影響をおよぼす可能性が指摘されている。最近,赤血球造血因子刺激製剤(Erythropoiesis Stimulating Agent;ESA)低反応がトピックスとなっており,慢性炎症,感染症あるいは悪性腫瘍が併存していることなどが原因とされているが,進行したRHPTも一因である[11]。
③神経・筋・精神症状
進行したRHPTは,抑うつ,いらいら感,認知機能の低下,不眠あるいは筋力低下などの神経・筋・精神症状をきたすことがあり,しばしばPTx後に明らかとなる[12]。
④血管石灰化
RHPTでは骨代謝回転の亢進により,骨からのカルシウムおよびリンが過剰に血中へ供給される。尿中排泄の低下あるいは全くない透析を含むCKD患者において,それら過剰なカルシウムおよびリンは血管壁に沈着し血管石灰化をきたす。血管石灰化の程度は生命予後に影響をきたす重要な病態であり,CKD-MBDの中心的な病態である。
⑤その他
PTHはかゆみ物質の一つとされ,RHPTの進展により難治性の掻痒症をきたすことがある。
以前から血清PTH値と生命予後との関連は報告されており,著しく低いあるいは著しく高い血清PTH値はリスクが高いとされている。本邦からの報告において,血清PTH値の上昇とともに死亡リスクは上昇し,180~240pg/mLを対照とした場合,300pg/mL以上で有意にリスクが上昇することが示されている[13]。PTHそのものが直接死亡リスクに関連するよりは,非常に進行したRHPTでは血管石灰化や心機能の抑制などの複合的な要因によることが考えられている。
RHPTの臨床症状の中でも触れたが,CKD-MBDの重要な病態である。動脈壁は内膜,中膜ならびに外膜の3層構造でできている。高血圧や脂質異常によって引き起こされる動脈硬化は内膜に発生するが,CKD-MBDの病態による変化は中膜に発生するのが典型的である。加齢,糖尿病あるいはCKDの環境にさらされると,血管平滑筋が形質転換を起こし骨芽細胞様平滑筋細胞となり,さらに細胞外リンないしカルシウム濃度が上昇,Matrix GLA proteinやフェチュインなどが低下することと相まって,中膜に石灰化を誘導するとされている[14]。以上のようにRHPTは血管石灰化のリスク因子の一つであるが,血管石灰化にはそれを誘導する因子と抑制する因子が存在する(表1)。RHPTの他に血清リン濃度の上昇,血清カルシウム濃度の上昇がリスク因子である一方,Klotho,マグネシウム,フェチュインあるいはアディポネクチンなどが抑制因子とされている。ビタミンDは血管石灰化の抑制因子であるが,過剰になれば逆に誘導因子となる[15]。
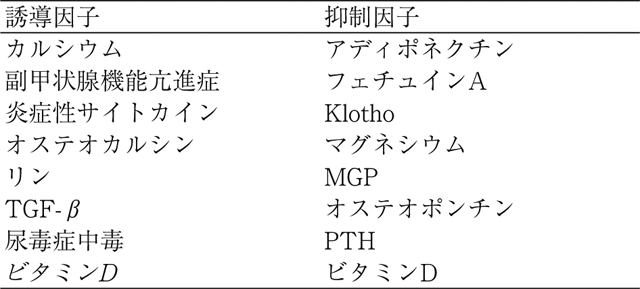
血管石灰化誘導因子と抑制因子(M. Shawkat Razzaque, et al.: Kidney Int 2011 改変)
RHPTの発症に血清活性型ビタミンD濃度の低下は大きく関わっている。25ヒドロキシビタミンDは,ビタミンD代謝物の中で最も血中濃度が高く安定し,“ビタミンD栄養状態”を反映している。CKDの環境下では,血清活性型ビタミンD濃度の低下だけでなく,その前駆体である25ヒドロキシビタミンDレベルも低下していることが示されている[16]。これには,ビタミンDの経口摂取不足,加齢による紫外線からの皮下産生能低下あるいは尿毒症環境下における25水酸化酵素活性の低下などが原因とされている[17]。25ヒドロキシビタミンDは,糸球体で濾過された後,近位尿細管で再吸収され尿細管細胞内で1α水酸化酵素によって活性型となる[18]。活性型ビタミンDは古典的には腎・骨・副甲状腺ならびに小腸に作用し,カルシウム代謝の中心的な役割を果たしている。しかしながら,核内受容体の一つであるビタミンD受容体は,免疫細胞や心筋細胞など全身の細胞にユビキタスに存在することが知られており,心肥大,感染症あるいはインスリン抵抗性との関連などカルシウム代謝以外の多面的作用が注目されている[19~21]。活性型ビタミンDは腎での活性化の他に,局所で産生されautocrine/paracrineで作用することが知られ,多面的作用に関連している[22]。
診療ガイドラインは,現在多種多様な領域疾患に対して作成されており,実臨床に浸透してきており,それをどのように駆使していくかは,ガイドラインそのものの使いやすさならびに実臨床とのギャップなどにより決まっている。しかしながら,ガイドラインは使われて評価されることで,真価が問われる。その意味からは,わが国の「慢性腎臓病に伴う骨・ミネラル代謝異常の診療ガイドライン」は,ユーザー・フレンドリーなガイドラインであり,中でも9分割図は腎臓・透析領域の現場に浸透している。
これまでに世界で作成されたCKD-MBDに関する代表的なガイドラインはいくつか存在する。古くは2000年ERA-EDTAであり,その後世界的に強いインパクトを示した2003年のNKF/DOQIに続き,現在各ガイドラインの基本ともなっている2009年のKDIGOである。周知のようにわが国では,2006年「透析患者における二次性副甲状腺機能亢進症ガイドライン」に続き,2012年「慢性腎臓病に伴う骨・ミネラル代謝異常の診療ガイドライン」(以下,ガイドライン2012)が発表され,透析症例のみならず,保存期,腹膜透析,腎移植ならびに小児におよぶまでカバーされている。また病態に関しても,二次性副甲状腺機能亢進症だけでなく,透析アミロイドーシスならびに血管石灰化についての項も設けられている。ガイドラインに影響を与える因子として,新規薬剤あるいは新たに提唱された病態がありえるが,日本のガイドラインだけでなく,世界のガイドラインも血管石灰化の知見,カルシウム非含有リン吸着剤やシナカルセトの登場が,大きな影響を与え,新たに作成されたり,追加あるいは削除されたりする形で進化しているものと考える。
ここまでRHPT発症のメカニズム,臨床所見,症状ならびに重要な病態に関して概説した。腎性骨異栄養症の概念が1940年代に提唱されて以来70年の歴史の中で,病態に対する新たな知見ならびに新たな治療が登場し,また医療現場を含む社会が変化した中で,現在のCKD-MBDへとパラダイムシフトした。しかしながら,まだまだ解明されなければならない病態あるいは治療法が残っており,また何を目的に治療していくかを含めた広い視点が必要である。