2019 年 36 巻 1 号 p. 44-48
2019 年 36 巻 1 号 p. 44-48
原発性副甲状腺機能亢進症(pHPT)と腎原性続発性副甲状腺機能亢進症(sHPT)が合併することは比較的稀で報告も少ない。症例は67歳男性。65歳より血液透析(HD)導入。HD導入時より内科的治療抵抗性で,多発関節痛等の臨床症状も出現し,手術適応となった。骨代謝マーカー著明高値。超音波検査では2腺の副甲状腺腫大を指摘。副甲状腺全摘術(PTx)+自家移植術を施行。病理学的診断では腺腫,過形成腺,正常副甲状腺を認めた。本症例はシナカルセト内服にも関わらず,HD導入後短期間でPTxの適応に至っており,HD導入時にpHPTを合併していたと考えられる。腺腫と診断された副甲状腺は2年の経過で増大傾向であり,過形成腺と共にシナカルセト抵抗性であった。pHPTの治療の第一選択は手術加療であることを再確認した。摘出腺に正常副甲状腺を認めたのは早期からシナカルセトが投与された影響で,過形成化が抑制された可能性が示唆された。
副甲状腺機能亢進症は副甲状腺ホルモン(parathyroid hormone:PTH)の慢性的分泌亢進によって引き起こされる病態であり,原発性と続発性(または二次性)に大別される。
原発性副甲状腺機能亢進症(primary hyperparathyroidism:pHPT)は副甲状腺の腫瘍化または過形成によりPTHが自律的に分泌される結果引き起こされるPTHの過剰状態である。
一方,腎原性続発性副甲状腺機能亢進症(secondary hyperparathyroidism:sHPT)は慢性腎臓病(chronic kidney disease:CKD)の進行に伴い,①リン排泄能低下によるFibroblast Growth Factor 23(FGF23)の上昇,②FGF23上昇による活性型ビタミンDの低下,③血清Ca濃度の低下をトリガーに発症し,慢性腎不全状態で増悪傾向を示す。
pHPTとsHPTが合併することは比較的稀で報告も少ない。今回,われわれはpHPTとsHPTを合併しシナカルセト抵抗性であった1例を経験したので報告する。
患 者:67歳,男性。
主 訴:全身掻痒感,両側膝痛,両側踵部痛。
既往歴:慢性糸球体腎炎(40歳頃~),高血圧症(60歳),高血圧性眼底,加齢黄斑変性症(61歳),虚血性心疾患(薬剤溶出性ステント留置)(64歳),血液透析(hemodialysis:HD)導入(65歳)。
家族歴:特記すべき事項なし。
現病歴:40歳頃より慢性糸球体腎炎を指摘。62歳時に末期腎不全,65歳でHD導入となった。HD導入時よりi-PTH高値で,シナカルセト内服やビタミンD製剤使用もi-PTH高値が遷延し,多発関節痛といった臨床症状も出現してきたため手術適応となった。
血液生化学検査:ALP 590IU/l,Ca 10.4mg/dl,IP 5.0mg/dl,i-PTH 1,420pg/ml,TRACP-5b 1,750mU/dl。
副甲状腺超音波検査:
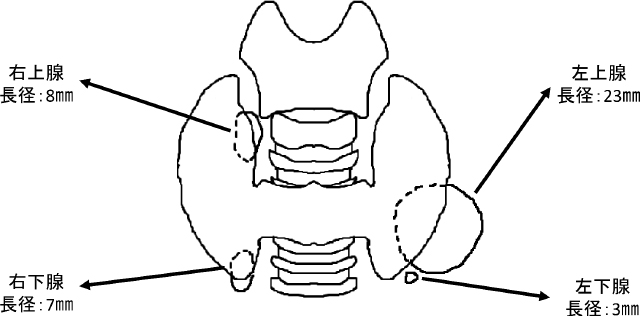
HD導入時;左上腺(19×10×14mm),左下腺(6×5×5mm)の2腺を指摘され,右には副甲状腺腫大は指摘されなかった。
術前;左上腺(24×18×19mm)はHD導入時より増大傾向を認め,HD導入時に指摘された左下腺は指摘されなかった。右下腺(9×6×9mm)を新規に指摘され,右上腺は指摘されなかった。
99mTc-MIBI scintigraphy:左上腺にのみ集積あり。
骨密度検査(DXA法):YAM:52%,T-score:-4.83SD。
手 術:副甲状腺全摘+自家移植術を施行。4腺が摘出され,左上腺;5,030mg,右下腺;220mg,左下腺,右上腺は測定なし。
右上腺は甲状腺右葉上極裏の気管に接するような部位に存在。右下腺は甲状腺右葉下極端に接するような部位に存在。左上腺は甲状腺左葉中央外側から下極外側の裏面から甲状腺を腹側に圧排するように存在。左下腺は左上腺の尾側に接するような部位に存在した。(図1)
手術時の副甲状腺の部位
右下腺220mg中75mgを右前腕筋層内に自家移植した。
経 過: 第1病日にはi-PTH 19pg/mlまで低下を認めた。術直後からCa補正を開始し,Hungry Bone Syndrome の状態のため,高用量のCa補正を必要とした。第15病日に軽快・退院となった。
病理組織像:
HE染色;
右上腺・右下腺;被膜の不明瞭化を認め,脂肪細胞の混入と主細胞密度の上昇を伴う過形成腺と診断。(図2-A, C)

摘出副甲状腺HE染色
A 右上腺,B 左上腺,C 右下腺,D 左下腺
A, C;被膜の不明瞭化,脂肪細胞混入と主細胞密度上昇を伴う過形成腺。
B;Normal rimを認め(矢印),脂肪細胞の混在を認めない,monotonesな主細胞増生を伴う腺腫。
D;主細胞の増生の少ない正常腺。
左上腺;Normal rimを認め(図2-B 矢印),脂肪細胞の混在を認めず,monotonesな主細胞の増生を伴う腺腫と診断。(図2-B)
左下腺;主細胞の増生の少ない正常腺と診断。(図2-D)
Calcium-Sensing Receptor(CaSR)染色;左下腺ではCaSRの濃染を認めるが(図3-D),その他3腺ではCaSRの密度の低下を認める(図3-A, B, C)。

摘出副甲状腺CaSR染色
A 右上腺,B 左上腺,C 右下腺,D 左下腺
左下腺ではCaSRの濃染を認めるが,その他3腺ではCaSRの密度の低下を認める。
pHPTは副甲状腺の腫瘍化または過形成によってPTHが自律的に分泌されるPTHの過剰状態と定義され,本邦では2,000~3,000人に1人の頻度と推計されており,3:1の割合で女性に多いとされ,特に中高年女性に多いとされる。病理学的には腺腫・過形成・癌腫に分類され,頻度は腺腫が80~85%と最も多く,そのほとんどは単発性である。過形成は10~15%であり,その多くは多発内分泌腫瘍(multiple endocrine neoplasia:MEN)に伴うものである。癌腫は稀で最も少なく2~3%程度とされている[1,2]。
一方,sHPTはCKDの進行に伴うリンの排泄低下がFGF23の上昇を引き起こし,血清活性型ビタミンD濃度の低下,血清Ca濃度の低下からPTHの産生・分泌を促されることで副甲状腺の過形成化が進展し発症する。病理学的には過形成である[3]。
CKDの進行によって緩徐に発症するsHPTは慢性透析療法を要する患者では程度の差はあるもののほぼ全例に発症する。一方pHPTは一定の罹患率を有する疾患であることを考えると,sHPTの症例には一定数でpHPTを合併しているものが含まれると考えられる。
しかし,sHPTとpHPTの合併した症例の報告は少なく,シナカルセト抵抗性についてや,免疫組織化学的にCaSRに関して検討されている報告はない。
一般的に慢性透析療法を要する患者に副甲状腺機能亢進症を発症した際に,原発性か続発性かの鑑別は難渋することがある[4]。それは前述の如くCKD状態で徐々に進行するsHPTは透析歴が長期化するとほぼ全ての患者で発症するために,保存期CKDの段階や慢性透析療法導入の際にpHPTを指摘されていない限り,sHPTとして認識され,複数の腫大腺を超音波検査で指摘される頃にはpHPTとの鑑別が困難となるからである。また,病理学的観点からはsHPTは病態の進行とともにDiffuse hyperplasia→Nodular hyperplasia→Single noduleと病理像が変化することが知られている[5]。前述の通り一般的にpHPTの病理像は多発内分泌腫瘍症(MEN)に伴う過形成変化と癌腫を除くと,その多くが単一腺腫であるが,典型的なNormal rimを認めない限り,sHPTの進行によるSingle noduleとの鑑別が困難となる。
本症例はHD導入時に既に2cm大の左上線を指摘されており,HD導入時にpHPTを合併したと考えられる。
一般的に保存期CKD患者では血清Caは低値となる傾向にあるが,血清Ca値が正常~高値の場合はpHPTの合併を考慮する必要があると考えられる。高Ca血症,高Ca尿症は短期的には糸球体濾過率(GFR)の低下と尿濃縮障害を生じ,結果としての多尿となる。高Ca血症による食思不振・嘔気から高度の脱水を生じるとhypercalcemic crisisと呼ばれる致死性の腎前性急性腎不全をきたすことがある。長期的には尿細管の変性・壊死から尿細管萎縮,間質線維化,炎症細胞浸潤といった慢性間質性腎炎の像を呈しCKDの増悪因子となる[6,7]。本症例の保存期CKD時のCa推移は不明であるが,早期にpHPTが発見・治療されていればHD導入を免れる,もしくは遅らせることが可能だったかもしれない。
治療に関しては,透析患者がpHPTを発症した際には副甲状腺全摘+自家移植術が標準的な治療との過去の報告がある[8]。筆者らは本症例のように両側に副甲状腺腫大が認められている際には,副甲状腺全摘+自家移植術が適切であると考えるが,腺腫と考えられる腫大腺以外の副甲状腺の描出が認められない場合,片側検索のみで留めることも妥当であると考えている。
その理由は,①近年の進歩した複数の画像検査で認められなかった副甲状腺を手術で同定・摘出することが困難である可能性がある点。②透析歴の長期化に伴い,検索の上未摘出の側に新たに副甲状腺腫大が生じた際,癒着のため摘出術が困難になる可能性がある点,③sHPTの再発に際しては,今後さらなるカルシミメティクス製剤の開発進歩により,長期的な内科的管理が容易になる可能性がある点などが考えられる。
術前の超音波検査では左上腺(腺腫)はHD導入時から腫瘤径が増大していたが,その他の腺は縮小傾向のものと増大傾向のものが混在していた。腺腫であった左上腺は2年の経過で増大傾向にありシナカルセト抵抗性であったと考えられ,pHPT治療の第一選択は手術による摘出であることを再確認した。
摘出腺に正常副甲状腺組織を認めたのは早期からのシナカルセト内服により過形成化が抑制されたためと考えられる。
シナカルセトには副甲状腺細胞の増殖抑制に加えてCaSR発現を増加させ,シナカルセトの反応性を改善させる効果が報告されている[9,10]。左下腺は2年の経過で縮小し,CaSRの発現も豊富であった。その理由としては,私見ではあるが,この腺が血流豊富な左上腺(腺腫)の近傍に位置し,シナカルセトの薬剤デリバリー効率が優れていたことで,CaSRの発現量が回復したためと推察される。
シナカルセトの過形成腺に及ぼす病理像の変化については報告が散見されるものの[11],不明な点が多く,今後の研究が待たれる。
本症例はHD導入時にpHPTを合併していたと考えられるが,pHPTの治療の遅延が,末期腎不全の時期を早めた可能性がある。
1個体内に多彩な副甲状腺病理像を呈したのはそれぞれの副甲状腺に対するシナカルセト抵抗性の相違が影響した可能性が示唆された。
本論文の内容は第50回日本甲状腺外科学会学術集会で発表した。
本論文作成にあたり,免疫組織化学染色にご協力頂いた東海大学医学部内科学系腎内分泌代謝内科学 澤田佳一郎先生に深謝申し上げます。