2016 Volume 15 Issue 2 Pages 41-47
2016 Volume 15 Issue 2 Pages 41-47
ダイノルフィンA (1–17)およびその変異体,R6W-DNYAは,細胞膜に貫入し,溶解および融合を引き起こすことが知られている.ペプチドと膜の相互作用によって,これらのペプチドの α ヘリックスの形成が促進される.膜による α ヘリックス形成を調べるために,Wang-Landau法を用いてエネルギー安定な α ヘリックス配座を系統的に求め,膜の疎水性環境に対応したシクロヘキサン溶媒中でそれらの配座の溶媒和自由エネルギーを評価する.その結果は,膜内にあるダイノルフィンA (1–17)とR6W-DNYAはGly3-Ile8とLeu12-Gln17の2つの領域で α ヘリックスの形成を示唆している.
ダイノルフィンA (1–17) (DYNA)はオピオイドペプチドであり,κレセプターと結合して鎮痛作用を生じることがChavkin と Goldsteinによって示された [1].DYNAの17残基から成るアミノ酸配列は,Tyr-Gly-Gly-Phe-Leu-Arg-Arg-Ile-Arg-Pro-Lys-Leu-Lys-Trp-Asp-Asn-Glnである.NMRの実験からDYNAのペプチドホルモンとしての活性には細胞膜との相互作用による α へリックスの形成が重要であると考えられた [2].一方,DYNAや6番目のアルギニン残基をトリプトファン残基に置換したR6W-DYNAが細胞膜内に入って α へリックスの形成が促進され,膜の溶解と融合を引き起こすことがCDとNMRの実験によって示された [3].さらに, 31P NMR実験よりDYNA のC末端側が短くなったダイノルフィンA (1–13)では,細胞膜内貫入の起こりにくいことが示された [4].このように,DYNAやR6W-DYNAの細胞内での α へリックス形成を調べることは,膜内貫入と細胞死による病気との関連を理解するためにも重要である.
DYNAは,10番目の残基がプロリンであるため,プロリンよりもN末端側の8残基とC末端側8残基の2つの領域で α へリックスの形成が可能となる.したがって, α へリックス形成可能な配座(以後, α へリックス配座と呼ぶ)のみの探索に限定するならば,そのエネルギー極小配座(以後EMCと書く)を体系的に求めることができるであろう.ここでは, α へリックス配座の探索をWang-Landau法 [5]を用いて行う.さらに,細胞膜内の疎水的な環境での α へリックス形成を予測するために,その環境に似たシクロヘキサン溶媒でEMCのエネルギー安定性を評価する.Efremovらは,気相からシクロヘキサン溶媒への移行自由エネルギーをペプチド分子の水分子との接触表面積(ASA)を用いて間接的に計算するためのatomic solvation parameters (ASP)を提案した [6].したがって,このASPを使用することによってDYNAとR6W-DYNAの α へリックス配座のシクロヘキサン溶媒での溶媒和自由エネルギーを計算することができる.
タンパク質・ペプチド分子のエネルギー空間にはたくさんのエネルギーミニマムが存在し,それらのミニマムは高いエネルギー障壁で遮られている.Nakamuraは,このような複雑なエネルギー空間を効率的にサンプリングするためのエネルギー空間サンプリングアルゴリズムを提案した [7].その際,Leeのエントロピーサンプリング法 [8]を用いて熱力学量を計算したが,ここでは,Wang-Landau (WL)の方法 [5]を用いて,エネルギーの低いミニマムをできるだけもれなくかつ効率的に探索するためのアルゴリズムを提案する.しかし,このアルゴリズムは,通常のWL法のように長いシミュレーションを行って状態密度を更新していき,最終的に熱力学量を求めるためのものでないことに注意すべきである.
いま,N個の2面角
| (1) |
WL法では,エネルギー空間E′を等確率,すなわち,
| (2) |
| (3) |
初期配座数Ω0(E′)は任意に与えることができるので,エネルギー空間を広く粗くサンプリングする場合には,Ω0(E′)=N exp (E′)を使用する.ここで,Nは2面角の総数である.一方,局所ミニマムでエネルギー極小化を行なう場合には,Ω0(E′)=bN1n (E′+1)を使用する.ここで,bには100∼500の値を与える.このように,式(1)の平坦化したエネルギー空間でWL法を適用した場合,エネルギーE′の初期配座数Ω0(E′)および更新パラメターfの与え方によって配座空間の探索を効率よく制御できる.
2.2 α ヘリックス配座DYNAとR6W-DYNAのように,比較的残基数の大きくフレキシブルなペプチドでは,配座空間全体をまんべんなく探索することは現段階ではまだ困難である.したがって,これらのペプチドが生体膜内で α ヘリックスを形成することを計算で示すことは実際上難しい.この研究では,DYNAとR6W-DYNAが膜内で α ヘリックスを形成した場合,どのような α ヘリックス配座が最もエネルギー的に安定となるのかを予測したい.すなわち,DYNAの α ヘリックス配座が関わる領域だけの探索に限定する.
そのために,DYNA の初期配座には少なくとも1本の α ヘリックスが含まれるように与える.すなわち,連続した4残基以上の主鎖の2面角(φ,ψ)に(−70°,−40°)
(以後 α Rと表記)の角度を与える.さらに,DYNAの10番目のPro残基が α ヘリックスブレーカーであることを考慮して,その前の残基Arg9の2面角には α R
を与えないという条件を課す.この条件によって,N末端側とC末端側のそれぞれの領域で α R
を連続してとれる残基数は4∼8残基までとなり,これは α ヘリックスの1巻き分から2巻き分に相当し, α ヘリックスの形成可能な本数も全体で1本か最大でも2本である.したがって,DYNAの主鎖の初期配座は,少なくとも1本の α ヘリックスを含み,かつ主鎖の α Rの含有率が88%,75%,63%,50%,38%,25%および13%となるように与えられた. α R以外の主鎖2面角
(φ,ψ)には,ラマチャンドランプロットの原子分子同士の衝突が生じない領域から7個の2面角,(−80°, 70°) ,(−80°, 140°),(−160°, −40°) ,
(−160°, 70°),(−160°, 160°),(70°, 40°),(−90°,
0°)が選ばれた.各 α R含有率に対して1000個ずつの初期配座をランダムに生成し,それぞれの初期配座の周辺領域を探索した.DYNAでは,Figure
1に示すように,主鎖2面角の α R含有率が50%の場合には残基数が4個(1巻き分)の短い α ヘリックスが50%以上の確率で, α R含有率88%の場合には残基数が8個(2巻分)の長い α ヘリックスがほぼ50%の確率で生成される.図で示されていないが, α R含有率が50%以下の場合には,短い α ヘリックスの形成される確率がさらに高くなる.また,主鎖2面角の α R含有率が大きくなるほど,N末端側とC末端側の両方でそれぞれ α ヘリックスが1本ずつ形成されやすくなる.したがって,いろいろな主鎖の α Rの含有率で α ヘリックス配座を体系的に探索することによって,そのEMCをもれなく求めることが可能となる.各アミノ酸残基の主鎖の2面角ωと側鎖の2面角
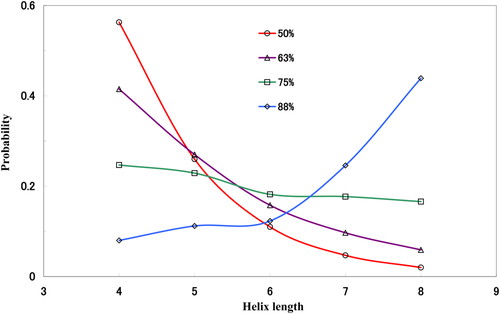
Probability of α -helix formation versus α R content (%) in Dynorphin-A (1-17). The length of α -helix is presented by the number of residues.
与えられた α R含有率で生成された初期配座から出発して,長いシミュレーションを行うほどより多くのミニマムを求めることができる.しかし,限りあるシミュレーション回数では,探索領域の偏りのためエネルギー安定なミニマムを見逃す可能性がある.特に,残基数が大きくフレキシブルなペプチド分子ほどその可能性が高い.また,採用された初期配座によってはWL法でも局所ミニマムから容易に脱出できない場合もある.それらの危険性を防ぐには,たくさんの初期配座から出発してシミュレーションを行なう必要があるが,同時に1つの初期配座に対するシミュレーション回数を減らさなければならないであろう.どの程度の初期配座数を用意するか,そしてどの程度のシミュレーション回数で行うかという問題に直面する.もう1つの問題は,エネルギー空間にはエネルギー的に安定でないミニマムが非常にたくさん存在しており,それらを探索した分だけ計算効率が悪くなることである.したがって,どのような方法で探索されているミニマムのエネルギーの有利不利を判定するかである.ここでは,以下のような戦略で段階的にミニマムの探索と選別を行うことにする.
第1段階では,与えられた α R含有率において初期配座をたくさん生成し,それぞれの初期配座から出発して短い探索を行なう.このとき,1個の初期配座については,その近くにあるミニマムのエネルギーの高い領域を少し探索して終了することになる.このようにして探索されたミニマムの中から,相対的にエネルギーの低いミニマムだけを選別する.さらに,探索中に基準のエネルギー値を下回った配座だけを集めて,それらの構造情報(2面角の確率分布)を作成しておく.この第1段階の計算によって,エネルギー安定なミニマムの見逃しを十分防ぎ,同時に,エネルギーの高いミニマムの探索を早期に避けることができる.さらに,第2段階では,選別されたミニマムに対して,その周辺領域を少し広い範囲にわたって探索する.このとき,第1段階で得られた2面角の確率分布を用いることにより,低エネルギー領域を効率的に探索する.その探索の結果,再び相対的にエネルギーの低いミニマムだけを選別する.このような探索と選別を数回繰り返した後,十分にエネルギーの低いミニマムだけを残す.第3段階では,第2段階で最終的に絞られた局所ミニマムでのエネルギー極小化を行う.以下に,各段階での計算方法の詳細を記述する.
第1段階では,主鎖の α R含有率に基づいて生成された,1000個の α ヘリックス含有初期構造から出発して1000モンテカルロステップの短いシミュレーションを行い,2面角の確率分布を求める.シミュレーション中,エネルギー
第2段階では,主鎖の α R含有率ごとに,第1段階でセーブされたM1個の仮のEMCから探索が開始される.いま,探索中に,エネルギーE(x)を持つ配座
第3段階では,第2段階で絞られた局所ミニマム内にある仮のEMCから出発して,(3)式の更新パラメターfの値をe,初期配座数をΩ0(E′)=bN1n
(E′+1)としてエネルギー極小化を行う.このエネルギー極小化では,初期配座の近傍で細かく探索されるように,配座
この研究では,真空中で得られた最終的なEMCをシクロヘキサン溶媒へ移行したときの溶媒からの間接的なエネルギー寄与gcをEisenbergとMcLachlanに従って,
| (4) |
| (5) |
真空中でDYNAのエネルギー最小となる α ヘリックス配座のEMCをD1と表す.D1とのエネルギー差がΔE < 15 kcal/molの基準を満たす74個のEMCが得られ,それらの配座をエネルギーの低い順番にD2~D75と表す.Figure 2 にcのエネルギー差ΔEが示されている.D1~D75のASAから,(4)式を用いてシクロヘキサン溶媒(細胞膜内の疎水的環境モデル)への移行自由エネルギーgcを計算し,(5)式より溶媒和自由エネルギーGcを求めた.シクロヘキサン溶媒では,D1が溶媒和自由エネルギーGcの最小の配座で,D65が移行自由エネルギーgcの最小の配座であった.D1とそれ以外の配座との溶媒和自由エネルギー差ΔGc,およびD65とそれ以外の配座との移行自由エネルギー差ΔgcをFigure 2 に示す.しかし,D1~D75はあくまでも真空中のエネルギー空間で得られたEMCであるので,溶媒を含めた自由エネルギー空間で得られるEMCとは多少異なるであろう.この溶媒の有無によるEMCの違いは,ASAの違い,すなわち移行自由エネルギーの違いとして反映される.D1~D75の移行自由エネルギーgcの最大変動幅はFigure 1 の点線で示すように7.2 kcal/molであった.したがって,溶媒和自由エネルギー差ΔGc < 7.2 kcal/molを満たすEMCがシクロヘキサン溶媒中でエネルギー安定となり得ると考えた.この条件を満たすのは13個のEMC D1~D7,D9,D10,D15~D17,D24であり,すべてN末端領域とC末端領域で合計2本の α ヘリックスが形成されていた.この13個のEMCは,N末端領域で形成される α ヘリックスと,1番目の残基Tyrの側鎖のOH基の水素結合の相手によって,大きく2つのファミリー(I)とファミリー(II)に分類される.ファミリー(I) に属するEMCは,D1,D5,D6,D7,D9,D10,D15,D16,D17およびD24で,N末端領域のGly3からIle8の残基間で α ヘリックスを形成し,Tyr-OH基はC末端側の残基Asn16またはGln17のCO基と水素結合する.一方,ファミリー(II) に属するEMCは,D2,D3およびD4で,N末端領域のGly2からArg6の残基間で α ヘリックスを形成し,Tyr-OH基は分子の外側に向いて水素結合に関与しない.特にファミリー(II)のD2は,自由エネルギー差ΔGcが0.6 kcal/molと小さく,ファミリーの(I) のD1とほぼ同程度のエネルギー安定性を有している点を評価すべきである.Figure 3にファミリー(I)のD1とファミリー(II)のD2の立体構造を示す.両EMCとも,N末端領域とC末端領域に形成される2本の α ヘリックスが互いに向かい合うようにして,ペプチド分子が折れたたまれている.C末端領域の α ヘリックスはD1とD2の両EMCともLeu12とGln17の残基間で形成されている.興味深いことに,Naitoらによれば,C末端側の短いDYNA (1–13)では膜内貫入が起こりにくいことが示されているので [4],C末端領域の α ヘリックス形成が膜内貫入に必要なのかもしれない.
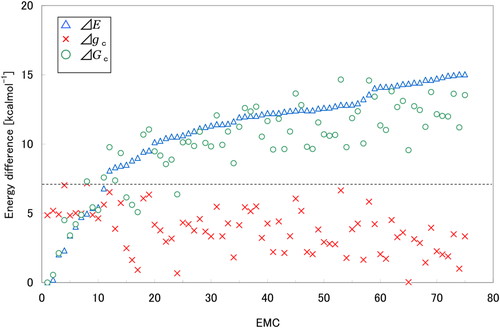
Energy differences of EMC in the cyclohexane solvent (ΔE: conformational energy, Δgc: transfer free-energy, ΔGc: solvation free-energy). EMC means energy-minimum conformations of Dynorphin-A (1-17).
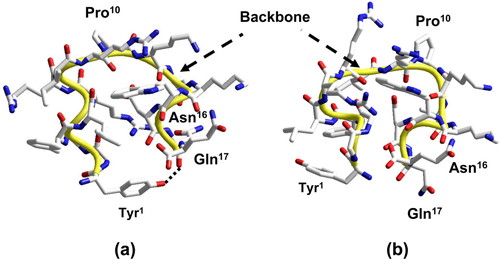
Graphic representation of (a) the lowest solvation free-energy conformation and (b) the second lowest solvation free-energy conformation calculated in cyclohexane solvent.
Björneråsと Gräslundによれば,DYNAの6番目の残基ArgをTrpにアミノ酸置換したペプチド分子,R6W-DYNAはDYNAよりも細胞膜内へ貫入がより強力になることが示されている [3].したがって,このアミノ酸置換によって,DYNAで予想される膜による α ヘリックス形成の2つの有力候補,ファミリー(I)とファミリー(II),のエネルギー安定性に影響を与えることが期待できる.ここでは,D1とのエネルギー差がΔE < 10 kcal/molの基準を満たしている24個のEMC,D1~D24,に対してアミノ酸置換を行なうことにした.置換される残基Argの側鎖は7個の2面角x1~ x7を持っているのに対して,置換残基Trpの側鎖の2面角はx1とx2だけである.したがって,R6W-DYNAのエネルギー極小化において,置換残基Trp側鎖以外の2面角の初期値にはD1~D24と同じ2面角を与え,Trpの側鎖のx1とx2の初期値にはそれぞれt, g+, g-配位のいずれかを与えた.したがって,1つのEMCに対して9通りのエネルギー極小化を行い,その中で最もエネルギーの低くなったものをR6W-DYNAのEMCとして採用した.このような方法で得られたR6W-DYNAのEMCをDYNAのD1~D24の配座に対応させてR1~R24とする.Figure 4に示すように,配座エネルギーEとシクロヘキサン溶媒中での溶媒和自由エネルギーGcが最小となるEMCはR1で,移行自由エネルギーgcが最小となるEMCはR20であった.gcの最大変動幅はFigure 4の点線で示すように6.6 kcal/molであった.その結果,溶媒和自由エネルギー差ΔGc < 6.6 kcal/molを満たす9個のEMC,R1~R6,R8,R9,R17がシクロヘキサン溶媒中でエネルギー安定配座となり得ると考えた.R1,R5,R6,R8,R9およびR17はDYNAで定義したファミリー(I)に分類され,R2,R3およびR4はファミリー(II)に分類される.いずれのファミリーのEMCもすべてN末端領域とC末端領域で合計2本の α ヘリックスが形成されている.ファミリー(II)のR2は,このファミリー内では最も溶媒和自由エネルギーが低いが,ファミリー(I)のR1との自由エネルギー差ΔGcは3.2 kcal/molもある.したがって,R6W-DYNA のR2はDYNAのD2と比較するとシクロヘキサン溶媒では相対的に安定性が下がっていることがわかる.R1は同じファミリー(I)の他のEMCと比べても自由エネルギー差ΔGcは1.9 kcal/mol以上も安定である.

Energy differences of EMC in the cyclohexane solvent (ΔE: conformational energy, Δgc: transfer free-energy, ΔGc: solvation free-energy). EMC means energy-minimum conformations of R6W-DYNA.
一方,R1とD1の分子全体の移行自由エネルギー差が−2.4 kcal/molであった.それに対して,R1のTrp6とD1のArg6の残基の移行自由エネルギー差はほぼ同程度の−2.5 kcal/molであった.同様に,R2とD2と分子全体の移行自由エネルギー差が−1.9 kcal/molであるのに対して,R2のTrp6とD2のArg6の残基の移行自由エネルギー差も−1.9 kcal/molであった.これらの結果は,疎水性残基Trp6に置換したR1とR2の方が極性残基のArg6を持つD1とD2よりも膜内への貫入が増大することを示している.また,R1の方がR2よりも膜内への貫入が強まることも示している.この膜内貫入の増大は置換残基の疎水性の増大によってもたらされたもので,置換残基による立体構造への影響がほとんどなかったことがわかる.その主な原因は,D1とD2ではArg6の側鎖が分子の表面に十分に露出していて,Trp6に置換しても立体的な障害がほとんど生じなかったためと考えられる.
以上の結果は,ファミリー(I)のD1とR1が細胞膜内の疎水的環境で最も安定となり得るEMCであることを示唆している.すなわちDYNAおよびR6W-DYNAは,細胞膜内ではN末端領域のGly3からIle8の残基間とC末端領域のLeu12からGln17の残基間で2本の α ヘリックスを形成し,Tyr-OH基とC末端側の残基Asn16のCO基の間で水素結合する立体構造を有していると考えられる.
膜貫入ペプチド,DYNAとR6W-DYNA,の α ヘリックス配座空間を効率的に探索するために,Wang-Landau法を用いたモンテカルロアルゴリズムを提案した.両ペプチドに対してエネルギー安定な α ヘリックス配座を求め,水分子との接触表面積からシクロヘキサン溶媒中での溶媒和自由エネルギーを計算した.シクロヘキサン溶媒を細胞膜内の疎水的環境のモデルと考えることにより,細胞膜内ではDYNAとR6W-DYNAはN末端領域のGly3からIle8の残基間とC末端領域のLeu12からGln17の残基間の2本の α ヘリックスを形成することが予測された.