2021 Volume 85 Issue 7 Pages 264-272
2021 Volume 85 Issue 7 Pages 264-272
To investigate the effect of polymer additives and chloride ions on the electrodeposition behavior and morphology of copper powder, the polarization curves were measured and constant current electrolysis of 300 A·m−2 and 500 A·m−2 was conducted in an electrolytic solution containing 0.079 mol·dm−3 of Cu2+ and 0.5 mol·dm−3 of free H2SO4 at 293K and 393 K without stirring. Polyethylene glycol (PEG) and polyethyleneimine (PEI) were used as polymer additives. PEG and PEI had a suppressing effect on the electrodeposition of copper powder. The current efficiency for Cu deposition decreased with the addition of PEG and PEI. The addition of PEG decreased the average particle size of the copper powder, while PEI didn’t change the average particle size. When Cl− coexisted with PEG, the suppressing effect on the electrodeposition of copper powder became even greater and the particle size of the copper powder became finer than when Cl− or PEG was added alone.
銅粉は,その優れた電気伝導性と熱伝導性により,粉末冶金およびエレクトロニクス用途で広く使用されている.銅粉の商業的な製造法として化学還元法,噴霧法,液中滴下法,電解法がよく知られている.他の合成プロセスと比較した電解法の長所は,製造コストが低い,低エネルギー消費,および高純度であることである.電解法で製造される銅粉は一般的に“デンドライト”と呼ばれる木の枝のような形状をしている.この形状のため,電解銅粉は‟枝“の箇所における電析がお互いに干渉し,詰まりにくく,密度が小さい1).エレクトロニクス用途ではこの密度が小さい点が重視されてきた.現在,銅粉が使用される電子材料の小型化や高機能化に伴い,電解銅粉には密度の小さい点に加えて,微粒化が求められている.電解銅粉の形状を制御する方法については,多くの研究が報告されてきた2-5).これまでに,著者らはハロゲン化物イオンが電解銅粉の析出挙動および銅粉の形態に及ぼす影響を調査した6).その結果,塩化物イオンには銅粉を微粒化する効果,デンドライトの枝の発達を促進し,銅粉の密度を小さくする効果,および電流効率を改善する効果があることがわかった.塩化物イオンが品質と製造の両面において非常に優れた添加剤であることを明らかにした6).
今回,著者らは電解銅粉のより一層の微粒化を目指し,電解液へポリエチレングリコール(PEG),ポリエチレンイミン(PEI)を添加した.銅の電解精製においては,電解液に高分子化合物を添加すると銅の還元反応が抑制され,陰極電位が分極することが知られている.高分子化合物と塩化物イオンが共存すると,銅の電析電位は更に分極し,電析銅の結晶粒が微粒化することが報告されている7-11).電解銅粉においては,陰極電位が分極すると,銅粉の結晶子のサイズが微細化し,銅粉の粒径が小さくなる傾向がある.そこで,電解液中に高分子化合物と塩化物イオンを共存させ,銅の電析電位を大きく分極させれば,銅粉の更なる微粒化が期待できる.しかし,Cu2+を板状に還元析出させる電解精製とCu2+を粉状に還元析出させる電解銅粉では,電析のメカニズムが大きく異なる.一般的に,銅の電解精製は電極表面での電子授受過程が律速となる電荷移動律速条件下で電解が行われるが,電解銅粉はCu2+イオンの拡散過程および電極表面での電子授受過程が共に律速となる混合律速条件下で電解が行われていると考えられる6).
本報告では,銅粉が電析する混合律速条件下においても,電解液中に高分子化合物とCl−を共存させると,銅粉の電析挙動に影響を及ぼすのかを電気化学測定法により調査した.また,実際に銅粉を電析し,銅粉の形態に及ぼす高分子化合物とCl−の共存の影響,および粒径の小さな銅粉が電析可能かを調査した.
電気化学測定では電解セルとして四つ口フラスコ(0.3 dm3)を使用した.電解液は,三井金属鉱業㈱製硫酸銅,および市販の特級試薬を用い,Cu2+ 0.079 mol·dm−3,遊離H2SO4 0.5 mol·dm−3となるようにこれらの所定量を純水に溶解して作製した.Cl−は塩化水素の形で100 mg·dm−3となるように添加した.高分子添加剤としてPEG[平均分子量 600, 2000, 20000],PEI[平均分子量 300, 1200, 10000, 70000]をそれぞれ1 g-50 g·dm−3となるように添加した.
動電位分極曲線の測定,および定電流電解は三電極法で行い,作用極に片面を絶縁テープでマスキングした銅板(0.2 cm2),対極に白金線,参照電極としてAg/AgCl(飽和KCl, 0.199 V vs. NHE, 298 K)電極を用いた.浴温は293 K,無攪拌の条件で測定を行った.動電位分極曲線の測定は,浸漬電位から−1.0 Vまでの電位範囲において,電位の走査速度60 mV·min−1にて行った.定電流電解では動電位分極曲線の測定結果を参考に,銅の電析反応がCu2+の拡散律速となる300 A·m−2で5 minの通電を行った.
銅粉電解試験では,容量3 dm3ビーカーを使用した.電解液は,三井金属鉱業㈱製硫酸銅,工業用硫酸を用い,Cu2+ 0.079 mol·dm−3,遊離H2SO4 0.5 mol·dm−3となるようにこれらの所定量を純水に溶解して作製した.Cl−は塩化水素の形で100 mg·dm−3となるように添加した.高分子添加剤としてPEG[平均分子量 600, 2000, 20000],PEI[平均分子量 300, 1200, 10000, 70000]をそれぞれ20 g·dm−3となるように添加した.陽極にチタン基体に酸化イリジウムを被覆した酸素発生電極,陰極にチタン板(5 × 7 cm2)を用いた.電流密度500 A·m−2,通電時間120 min,浴温303 Kにて電解を行った.電析した銅粉は十分な量の純水で洗浄した後,乾燥機を使用し,大気雰囲気下にて,80℃で8 h乾燥させた.乾燥後,銅粉の温度が常温まで下がった後,次の粉体特性を測定した.平均粒子径はレーザー回折散乱式粒度分布測定装置を用いて体積累積算出法にて測定した.結晶子径のサイズはX線回折図形の200のピークの半値幅から,シェラーの式を用いて算出した12).タップ密度については,タッピング装置を使用し,JIS Z 2512:2006にて測定した.粒子形状は走査型電子顕微鏡(SEM)にて観察した.粉体中のCの含有量は,銅粉を酸素ガスにて完全燃焼した際に発生するCO2濃度を非分散型赤外線吸収法にて測定することにより求めた.
Fig. 1にPEG[平均分子量2000]を添加した電解液からの銅電析のカソード分極曲線を示す.0~−0.2 Vにおける銅電析の電荷移動律速領域に着目すると,PEGの添加量が20 g·dm−3以上において−0.1~−0.2 V付近での還元電流が減少していることから,PEGには銅電析における電荷移動を抑制する効果があることがわかる.−0.3~−0.75 Vの領域では,電流密度が一定となり,Cu2+の拡散限界電流密度を示した.拡散限界電流値はPEGの添加量が増えるに従って小さくなった.−0.8 Vより卑な領域における電流密度の増加は,水素発生によるものである.
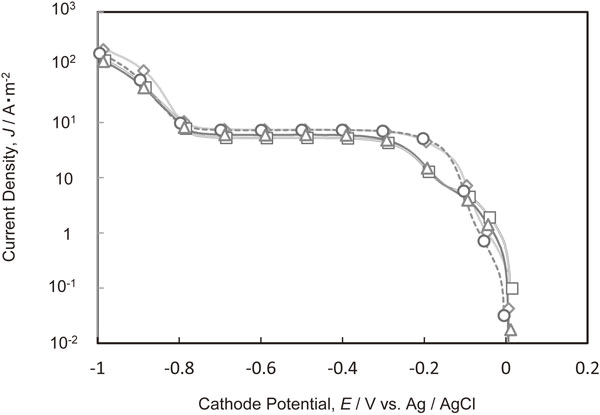
Polarization curves for Cu deposition in the electrolytes containing various amounts of PEG with molecular weight of 2000. (PEG concentration, ◇ 0 g·dm−3, ○ 1 g·dm−3, △ 20 g·dm−3, □ 50 g·dm−3)
Fig. 2にPEG[平均分子量2000]とCl−がそれぞれ単独で存在する電解液,および共存する電解液からの銅電析のカソード分極曲線を示す.Cl−を単独で添加すると,0~−0.2 Vにおける銅電析の電荷移動律速領域で,電流値が上昇した.Cu2+の拡散限界電流値にはCl−添加の影響は特に見られなかった.−0.8 Vより卑な水素発生領域において,Cl−を添加すると電流密度は大きくなった.前報6)と同様に,Cl−を単独で添加すると,銅の電析反応を促進させる効果があることがわかる.Cl−とPEGが共存する場合,電荷移動律速領域,Cu2+の拡散律速領域,および水素発生領域の全領域において,カソード分極曲線はPEGを単独で添加した場合とほぼ同様であった.PEGにはCl−による復極効果を抑制する作用が見られた.
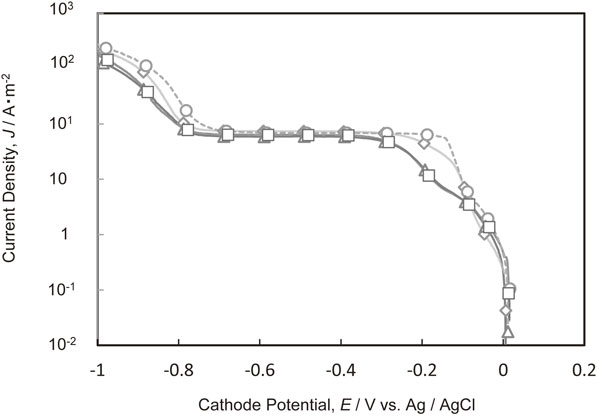
Polarization curves for Cu deposition in the electrolytes with and without additives. (◇ Additive-free, ○ Cl−, △ PEG, □ Cl− and PEG)
Fig. 3にCl−と種々の分子量のPEGが共存した場合の銅電析のカソード分極曲線を示す.0~−0.2 Vにおける銅電析の電荷移動律速領域ではPEGの分子量が大きくなるに従って電流値が減少した.−0.3 Vより卑なCu2+の拡散律速領域,および水素発生領域においても,PEGの分子量が大きくなるほど僅かではあるが電流密度が小さくなった.
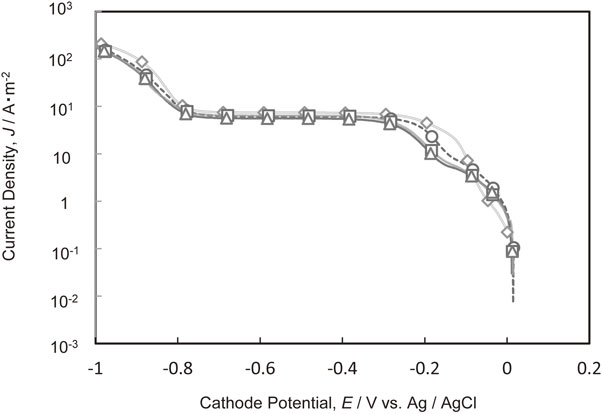
Polarization curves for Cu deposition in the electrolytes containing Cl− and various molecular weights of PEG. (M.W. of PEG, ◇ PEG-free, ○ 600, □ 2000, △ 20000)
Fig. 4にPEI[平均分子量1200]を添加した電解液からの銅電析のカソード分極曲線を示す.0~−0.3 Vにおける銅電析の電荷移動律速領域では,PEIを1 g·dm−3添加すると電流値が最も小さくなり,PEIの添加量が増えるに従って電流値が大きくなり銅電析が開始する電位が貴側にシフトした.−0.3 Vより卑なCu2+の拡散律速領域,および水素発生領域においてはPEIの添加量が多くなるほど電流密度が小さくなった.
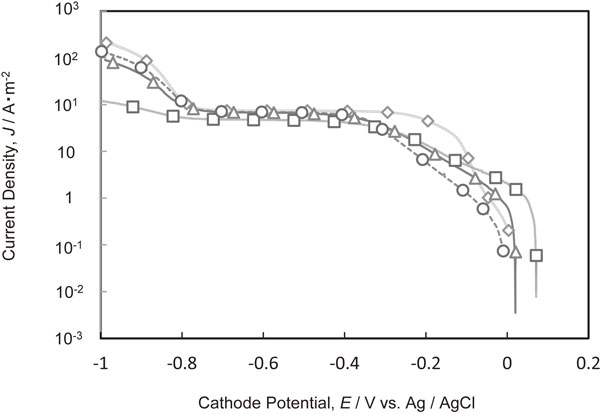
Polarization curves for Cu deposition in the electrolytes containing various amounts of PEI with molecular weight of 1200. (PEI concentration, ◇ 0 g·dm−3, ○ 1 g·dm−3, △ 20 g·dm−3, □ 50 g·dm−3)
Fig. 5にPEI[平均分子量1200]とCl−がそれぞれ単独で存在する電解液,および共存する電解液からの銅電析のカソード分極曲線を示す.銅電析のカソード分極曲線は,Cl−とPEIが共存しても,電荷移動律速領域,Cu2+の拡散律速領域,および水素発生領域の全領域において,PEIを単独で添加した場合とほぼ同じであった.PEIにはCl−の復極効果を抑制する作用が見られた.
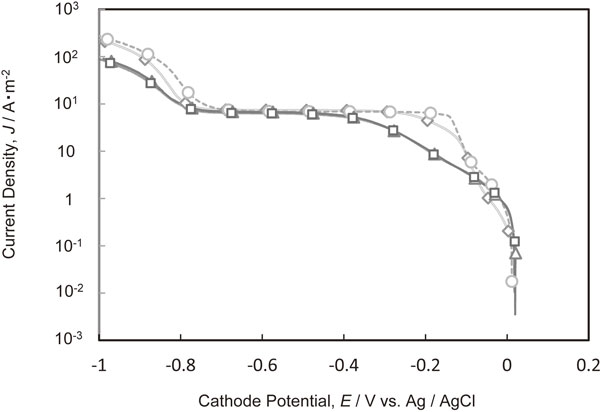
Polarization curves for Cu deposition in the electrolytes with and without additives. (◇ Additive-free, ○ Cl−, △ PEI, □ Cl− and PEI)
Fig. 6にCl−と種々の分子量のPEIが共存した場合の銅電析のカソード分極曲線を示す.0~−0.2 Vにおける銅電析の電荷移動律速領域ではPEIの平均分子量が大きくなるに従って電流値が減少した.−0.3 Vより卑なCu2+の拡散律速領域,および水素発生領域においては分子量の違いによる電流値の大きな変化は確認されなかった.
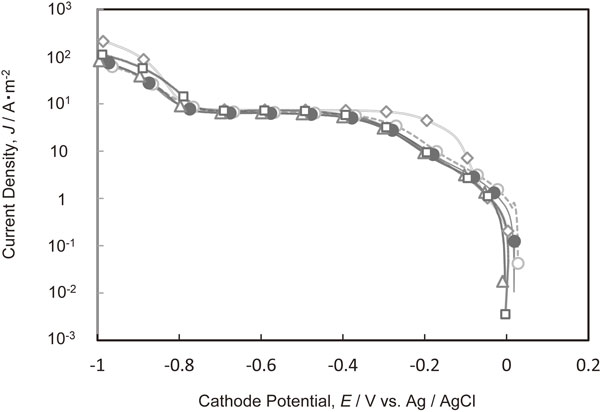
Polarization curves for Cu deposition in the electrolytes containing Cl− and various molecular weights of PEI. (M.W. of PEI, ◇ PEI-free, ○ 300, ● 1200, □ 10000, △ 70000)
Fig. 7にPEG[平均分子量2000]を添加した電解液において300 A·m−2で定電流電解を行った際の陰極電位の経時変化を示す.Fig. 1-Fig. 6に示す分極曲線より,300 A·m−2の電解ではCu2+の拡散律速となっていることがわかる.Fig. 7に示すように電解開始直後に一時電荷移動律速となるため,貴な電位となるが,その後大きく分極し,電解時間の経過に伴い,徐々に復極した.電解時間の経過に従って,緩やかに電位が貴側にシフトするのは銅粉の電析に伴い有効反応面積が増え真の電流密度が低下するためである.電位は,PEG添加量が多くなるほど卑側にシフトしており,銅電析に対するPEGの分極作用が認められた.
Changes in the cathode potential with time during Cu deposition at 300 A·m−2 in the electrolytes containing various amounts of PEG with molecular weight of 2000. (PEG concentration, ◇ 0 g·dm−3, ○ 1 g·dm−3, △ 20 g·dm−3, □ 50 g·dm−3)
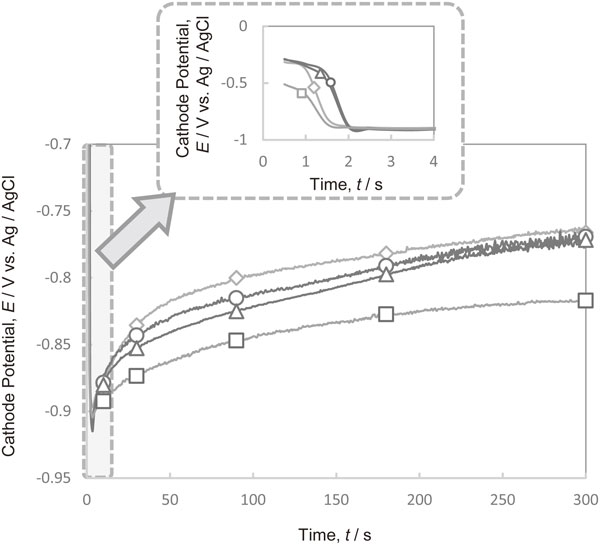
Fig. 8にPEG[平均分子量2000]とCl−がそれぞれ単独で存在する電解液,および共存する電解液において300 A·m−2で定電流電解を行った際の陰極電位の経時変化を示す.Cl−とPEGが共存すると,PEGが単独で存在する場合と比較して,分極効果が大きくなることが判明した.Cl−とPEGが共存する場合と,PEGが単独で存在する場合の分極効果の差は,電解開始直後が大きく,時間が経過するにつれて小さくなっている.これは,Cl−の添加による復極効果の影響によるものと考えられる.Cl−による復極効果はCu2+がCuCl2−を経由して銅に還元されることで起こり,この還元反応は反応性の高いデンドライトの先端で優先的に起こると考えられている6).通電時間が長くなると,銅粉の電析に伴いデンドライト形状が成長し,有効反応面積が増え,銅電析の活性点が増加するため分極効果の差が小さくなると推察される.
Changes in the cathode potential with time during Cu deposition at 300 A·m−2 in the electrolytes with and without additives. (◇ Additive-free, ○ Cl−, △ PEG, □ Cl− and PEG)
Fig. 9にCl−と種々の分子量のPEGが共存した電解液において300 A·m−2で定電流電解を行った際の陰極電位の経時変化を示す.電位は,PEGの分子量が大きくなるほど卑側にシフトした.
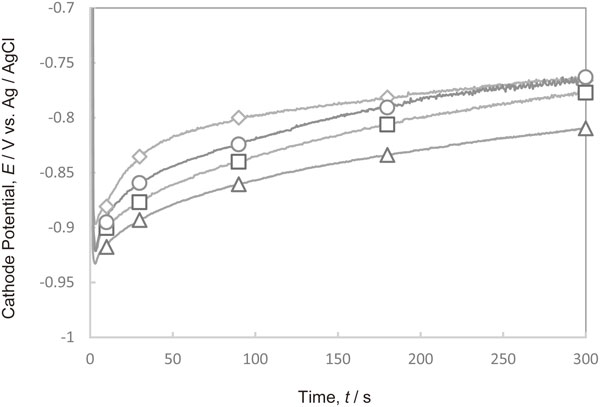
Changes in the cathode potential with time during Cu deposition at 300 A·m−2 in the electrolytes containing Cl− and various molecular weights of PEG. (M.W. of PEG, ◇ PEG-free, ○ 600, □ 2000, △ 20000)
Fig. 10 にPEI[平均分子量1200]を添加した電解液において300 A·m−2で定電流電解を行った際の陰極電位の経時変化を示す.電位は,PEIの添加量が多くなるほど卑側にシフトしており,銅電析に対するPEIの分極作用が認められた.
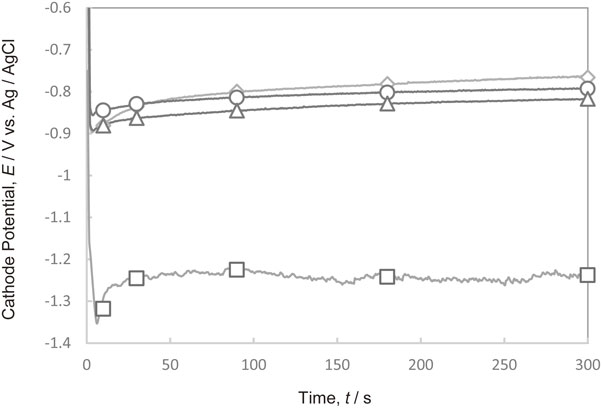
Changes in the cathode potential with time during Cu deposition at 300 A·m−2 in the electrolytes containing various amounts of PEI with molecular weight of 1200. (PEI concentration, ◇ 0 g·dm−3, ○ 1 g·dm−3, △ 20 g·dm−3, □ 50 g·dm−3)
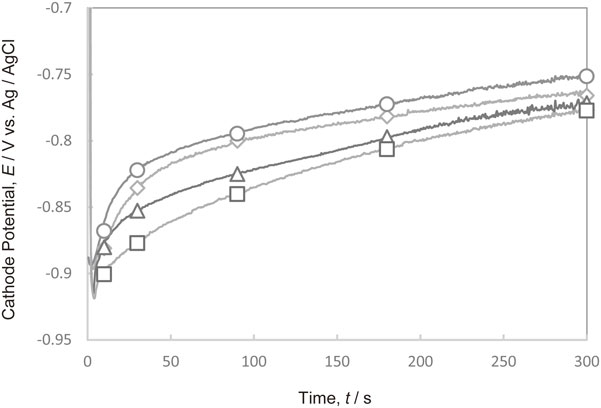
Fig. 11にPEI[平均分子量1200]とCl−がそれぞれ単独で存在する電解液,および共存する電解液において300 A·m−2で定電流電解を行った際の陰極電位の経時変化を示す.Cl−とPEIが共存すると,PEIが単独で存在する場合と比較して,分極効果が大きくなることが判明した.
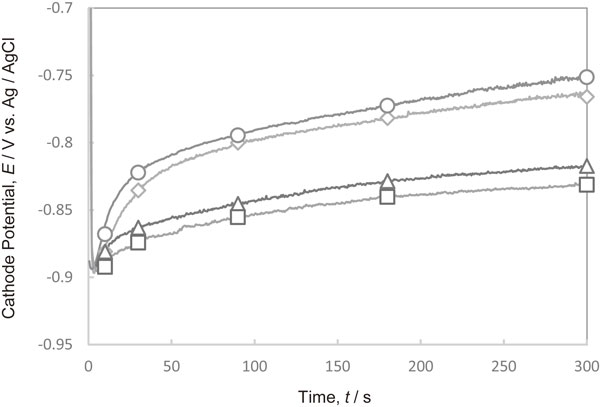
Changes in the cathode potential with time during Cu deposition at 300 A·m−2 in the electrolytes with and without additives. (◇ Additive-free, ○ Cl−, △ PEI, □ Cl− and PEI)
Fig. 12にCl−と種々の分子量のPEIが共存した電解液において300 A·m−2で定電流電解を行った際の陰極電位の経時変化を示す.電位は,PEIの分子量に関わらず卑に分極した.PEIの分子量が1200において分極は最も大きくなった.
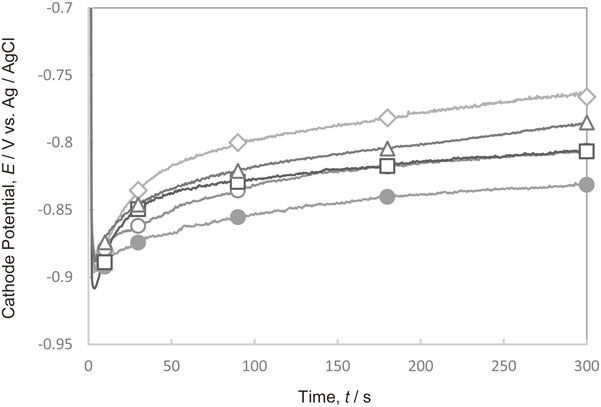
Changes in the cathode potential with time during Cu deposition at 300 A·m−2 in the electrolytes containing Cl− and various molecular weights of PEI. (M.W. of PEI, ◇ PEI-free, ○ 300, ● 1200, □ 10000, △ 70000)
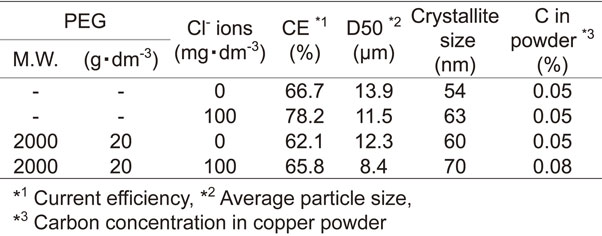
Table 1にCl−とPEG[平均分子量2000]がそれぞれ単独で存在する電解液,および共存する電解液から電析させた銅粉の電流効率および粉体特性を示す.銅電析の電流効率は,PEGを添加すると小さくなった.また,PEGを添加すると銅粉の平均粒子径は小さくなった.しかし,Cuの結晶子径に及ぼすPEG添加の影響は特に認めらなかった.また,銅粉中のCの含有量もPEGを添加しても特に変化しなかった.一方,Cl−とPEG[平均分子量2000]が共存する場合,電流効率は,PEGを単独で添加したものよりも大きく,Cl−のみを添加した場合より小さくなった.Cl−とPEGを添加すると平均粒子径は更に微粒化した.しかし,結晶子サイズ,およびCの含有量に大きな変化は見られなかった.Fig. 13にCl−とPEG[平均分子量2000]がそれぞれ単独で存在する電解液,および共存する電解液から電析させた銅粉の表面SEM像を示す.SEM像より,PEGを添加することにより銅粉の粒径が小さくなることがわかった.PEGを単独添加した銅粉[Fig. 13(c)]のデンドライトの形状は,Cl−とPEGが無添加の場合[Fig. 13(a)]と似た形状であった.Cl−とPEGが共存すると[Fig. 13(d)],それぞれが単独で存在する場合[Fig. 13(b), Fig. 13(c)]と比較して,より粒径が小さくなった.また,Cl−とPEGを添加した銅粉のデンドライトの形状[Fig. 13(d)]はCl−を単独添加した場合[Fig. 13(b)]と同様に,枝や幹が細く長く成長した.

SEM images of copper powders deposited in the electrolytes with and without additives. [(a) Additive-free, (b) Cl− 100 mg·dm−3, (c) PEG 20 g·dm−3, (d) Cl− 100 mg·dm−3 + PEG 20 g·dm−3]
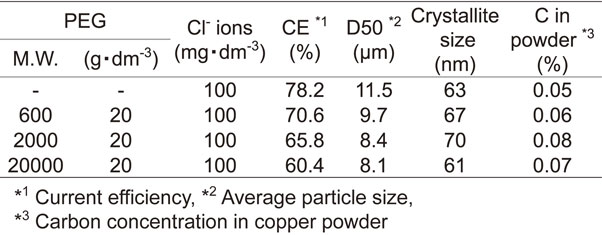
Table 2にCl−と種々の分子量のPEGが共存する電解液から電析させた銅粉の電流効率,および粉体特性を示す.添加したPEGの分子量が大きくなるに従い,銅電析の電流効率は小さくなり,また銅粉の平均粒子径は小さくなった.しかし,PEGの分子量が大きくなっても,銅粉の結晶子サイズ,および粉体中のCの含有量には大きな変化は見られなかった.Fig. 14にCl−と種々の分子量のPEGが共存する電解液から電析させた銅粉の表面SEM像を示す.SEM画像より,添加するPEGの分子量が大きくなるに従い,粒径が小さくなることがわかった.銅粉のデンドライトの形状については,分子量が大きくなるほど,枝が短く太くなり,枝の成長が抑制されているように見えた.

SEM images of copper powders deposited in the electrolytes containing PEG with molecular weights of 600, 2000 and 20000 and Cl− ions. [(a) Cl−, (b) Cl− + PEG (M.W.600), (c) Cl− + PEG (2000), (d) Cl− + PEG (2000)]
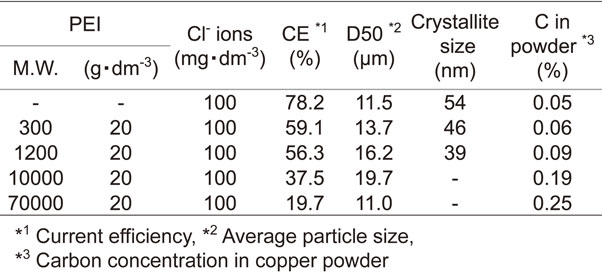
Table 3にCl−と種々の分子量のPEIが共存する電解液から電析させた銅粉の電流効率,および粉体特性を示す.添加したPEIの分子量が大きくなるに従い,銅電析の電流効率は小さくなった.添加したPEIの分子量と銅粉の平均粒子径との間に相関は見られなかったが,PEIの分子量が大きくなるに従い,銅粉の結晶子サイズは小さくなり,粉体中のCの含有量が高くなる傾向が確認された.Fig. 15にCl−と種々の分子量のPEIが共存する電解液から電析させた銅粉の表面SEM像を示す.SEM画像より,PEIにはデンドライトの成長を強く抑制する効果があり,その効果は分子量が大きくなるほど強くなると考えられる.PEI[平均分子量300]の添加[Fig. 15(b)]ではデンドライトの枝の長さが短くなる程度であったが,PEI[平均分子量1200, 10000, 70000][Fig. 15(c), Fig. 15(d), Fig. 15(e)]ではデンドライト形状への成長が著しく抑制され,枝は丸く太く成長した.

SEM images of copper powders deposited in the electrolytes containing PEI with molecular weights of 300, 1200, 10000 and 70000 and Cl− ions. [(a) Cl−, (b) Cl− + PEI (M.W.300), (c) Cl− + PEI (1200), (d) Cl− + PEI (10000), (e) Cl− + PEI (70000)]
PEGとPEIの添加では,銅粉の電析挙動に及ぼす影響が異なり,その結果,銅粉の粉体特性も異なる傾向を示した.
先ず,PEGが銅粉の電析挙動に及ぼす影響について考察する.PEGを添加すると,銅粉電析の電流効率が低下し,電解銅粉の平均粒子径が小さくなった.PEG添加による結晶子サイズの微細化,および銅粉中のCの含有量の上昇については確認されなかった(Table 1, Fig. 13).動電位分極曲線の測定結果(Fig. 1)より,PEGを添加すると電荷移動律速となる−0.1 V付近の電流値の上昇が抑えられているため,PEGは陰極の表面に吸着し,銅電析における電荷移動を抑制していると考えられる.Cu2+濃度0.079 mol·dm−3の電解液にCl−が100 ppm存在すると銅粉の電析は,下記の式(1),式(2),式(3)により進行すると報告されている6).
| \begin{equation} \text{Cu}^{2+} + \text{e}^{-} \to \text{Cu}^{+} \end{equation} | (1) |
| \begin{equation} \text{Cu}^{+} + 2\text{Cl}^{-} \to \text{CuCl}_{2}{}^{-} \end{equation} | (2) |
| \begin{equation} \text{CuCl}_{2}{}^{-} + \text{e}^{-} \to \text{Cu} + 2\text{Cl}^{-} \end{equation} | (3) |
銅粉の電析において,Cl−を添加すると,電流効率が増加しており(Table 1),Cu2+の拡散律速領域においても銅電析が促進されている(Fig. 2, Fig. 8)ことから,銅粉の電析は電荷移動過程の影響を受けていることが示唆された.即ち,銅粉の電析は,Cu2+の拡散律速過程と電荷移動過程の混合律速下で進行していると考えられる.
PEGを添加することにより,銅粉の平均粒子径が小さくなったのは,PEGの陰極表面への吸着,およびCu2+の拡散抑制により電析過電圧が増加したためと考えられる(Fig. 7).
電解液中にPEGとCl−が共存すると,Cl−もしくはPEGを単独で添加した場合と比較して,銅粉の粒径が大きく減少した(Table 1).これは,PEGとCl−が共存すると電析過電圧が更に増加する(Fig. 8)ためと考えられる.前報にて,Cl−を単独添加した電解液から電析した銅粉は,微粒化することを報告した6).上記式(3)の電析反応が反応性の高いデンドライトの先端で優先的に起こるためデンドライトが細く長く成長し,その結果,銅粉の粒径が小さくなったと考えられる.Cl−を含む電解液では,CuCl2−を経由した式(1)-式(3)の還元反応が進むが,PEGが共存すると式(3)の電析反応を抑制するため,Cl−のみを添加した場合よりも更に銅粉の粒径が減少したと推察される.実際に,SEM画像(Fig. 13)からも,PEGとCl−が共存すると,銅粉のデンドライトの形状はCl−を単独添加した場合のように,枝や幹が細く長く成長していることがわかる.また,Cl−とPEGが共存すると,電流効率がPEGを単独で添加した場合よりも大きくなっており,Cl−の電析促進効果が確認できることから,PEGとCl−が共存する場合でも,CuCl2−を経由した式(1)-式(3)の反応が進んでいると考えられる.
動電位分極曲線の結果(Fig. 3)より,PEGの分子量が大きくなるに従って,0~−0.2 Vにおける銅電析の電荷移動律速領域で電流値が減少し,また,拡散限界電流値も小さくなっている.添加するPEGの分子量が大きくなるに従い,デンドライトの枝は太く短くなり,銅粉の平均粒子径が減少したのは(Table 2, Fig. 14),分子量が大きいほど,陰極表面への吸着力が強く,またCu2+の拡散阻害効果が大きいためと考えられる.
次に,PEIが銅粉の電析挙動に及ぼす影響について考察する.電解液にPEIを添加すると,電解液の色が深い青色に変化することから,PEIのアミノ部位がCu2+と錯体を形成していると考えられる.PEIを添加した電解液中から電析した銅粉は,共析するCが多く,結晶子サイズが微細化しており,また電流効率が低下することから(Table 3),PEIは陰極電極表面への吸着およびCu2+との錯体形成により銅の還元反応を抑制していると考えられる.酸性溶液中ではPEIの窒素はプロトン化されており,陰極界面のpHが上昇すると,このH+が脱離することによりN原子の孤立電子対が増加し陰極面への吸着能が大きくなることが報告されている13).銅粉の電析では水素発生が起こるため,陰極の表面は,バルクと比較してpHが高くなり,PEIの吸着能が高くなっていると考えられる.
動電位分極曲線の測定結果(Fig. 5)より,PEIを添加すると−0.1 V付近の電流値の上昇が抑えられているため,PEGと同様に,PEIは陰極の表面に吸着し,銅電析における電荷移動を抑制していると考えられる.−0.1 V付近の電流値の減少がPEGを添加した場合よりも大きいことから,PEIの方がより強く陰極表面に吸着し,Cu2+の還元反応を抑制していると推察される.
Fig. 11より,電解液中にPEIとCl−が共存するとPEIのみが存在する場合に比べて,銅電析は抑制されることがわかる.この結果より,PEIはPEG同様に陰極表面に吸着して式(3)の反応を抑制していると推察される.しかしながら,PEIを添加しても,銅粉の平均粒子径は減少していない(Table 3).これは,PEIが式(3)の反応を抑制する効果がPEGと比べて大きいためと推察される.Cl−の添加によりCu粉が微粒化するのは,上記式(3)の電析反応が反応性の高いデンドライトの先端で優先的に起こり,デンドライトが細く長く成長するためと考えられる.しかし,PEIが共存するとPEIが陰極表面に吸着して式(3)の反応を強く抑制した結果,デンドライトの枝は細長く成長できず太く丸くなり,銅粉の平均粒子径が減少しなかったと推察される.
添加するPEIの分子量が大きくなるに従って,銅粉中のCの含有量が上昇し,結晶子サイズが微細化した(Table 3).これは,PEIの分子量が大きくなるほど,陰極電極面への吸着力が強くなり,粉体中へ巻き込まれるPEIの量が増え,また,Cu2+の還元反応を抑制する効果が大きくなるためと考えられる.しかし,300 A·m−2にて定電流電解を行った際の陰極電位の測定結果(Fig. 12)では,PEIの分子量が1200において最も分極効果が大きくなっている.先に述べたように,PEIは陰極界面での水素発生反応によりpHが上昇すると,H+が脱離する.PEIの分子量が大きくなるほど,銅電析の電流効率が低下していることから(Table 3),PEIの分子量が10000, 70000と大きくなると,H+が脱離しやすくなり,水素発生反応が優先して生じるため,見掛け上,分極効果が低下していると考えられる.
また,SEM画像(Fig. 15)より,PEIの分子量が大きくなると,デンドライトの成長が抑制されることが確認された.PEIの平均分子量が300においてデンドライトの枝の成長を抑制する効果が見られ,PEIの平均分子量が1200以上ではデンドライトの枝が丸く成長した.これは,陰極表面に吸着したPEIが,Cu2+の還元反応を強力に抑制することにより,デンドライトの枝の成長が抑制されたためと考えられる.PEIの分子量が大きくなるほど陰極表面への吸着力が強くなるため,PEIの平均分子量が1200以上でデンドライトの枝が丸く成長したと推察される.
前報6)にて,銅粉の電析は,Cu2+の拡散過程と電荷移動過程の混合律速下で進行している可能性が高いことを報告した.今回の試験結果においても,動電位分極曲線(Fig. 4-6)の結果より,PEIは,その添加量20 g·dm−3以下では,銅電析の電荷移動過程には影響を及ぼすが,拡散限界電流密度を変化させていないことからCu2+の拡散過程には影響を及ぼさないことがわかる.しかし,PEIを添加すると,銅粉の形状が変化していることから,銅粉の電析はCu2+の拡散過程と電荷移動過程の混合律速で生じている可能性が高いことが改めて示された.
銅粉の電析挙動,形態に及ぼすPEG,PEIの影響について調査した結果,以下のことがわかった.銅粉の電析において,PEG,PEIには分極効果があり,それぞれの添加により電流効率が低下した.PEGには,銅粉の平均粒子径を小さくする効果が見られ,微粒化効果は,PEGの分子量が大きくなるに従って強くなることがわかった.一方,PEIを添加すると,銅粉中のCの含有量が上昇し,結晶子サイズが小さくなったが平均粒子径の低下は見られなかった.PEIの分子量が大きくなるに従って,デンドライトの成長が抑制され,分子量 1200以上ではデンドライトの枝が丸く成長した.PEIにはデンドライトの成長を強く抑制する効果があり,その効果は分子量が大きくなるほど強くなると考えられる.
PEG,PEIにCl−を共存させると,Cu電析における分極効果が更に大きくなった.特にPEGとCl−を共存させると,Cl−,PEGをそれぞれ単独で添加した場合と比較して,銅粉の粒径が大きく低下することが判明した.また,銅粉中のCの含有量にも大きな変化がないことから,銅粉の純度に対しても影響が小さいことがわかった.以上の結果より,銅粉の製造にPEGおよびCl−を使用できる可能性は高いと考えられる.PEGの分子量および添加量,Cl−の添加量を調整することにより,電流効率を維持したまま銅粉を微粒化できると考えられる.