2021 Volume 54 Issue 11 Pages 745-759
2021 Volume 54 Issue 11 Pages 745-759
目的:胃癌手術において術前内臓脂肪量高値は術後合併症を増加させる.また,術後合併症発生は予後不良因子と報告されている.今回,胃癌患者における術前の内臓脂肪量高値が術後の短期的および長期的アウトカムに及ぼす影響を検討した.方法:2008年4月から2018年4月までに胃切除および胃全摘を行ったp-T2(MP)以深の進行胃癌485例を対象とした.術直前のCTで臍レベルの内臓脂肪量面積を測定し,身長の2乗で除してvisceral adipose tissue index(以下,VAIと略記)を算出した.VAIのcut-off値はClavien-Dindo(CD)分類3a以上の重症合併症からROC曲線を求めて男女別に算出しhigh-VAI群とlow-VAI群に分類した.結果:270例(55.7%)がhigh-VAI群に分類された.多変量解析の結果でhigh-VAIは重症合併症(OR 2.130,95%信頼区間1.110~4.080,P=0.024)の独立したリスク因子であり,全生存期間に関わる独立した予後規定因子(HR 0.508,95%信頼区間0.363~0.711,P<0.001)だった.結語:術前のhigh-VAIは胃癌の術後合併症を増加させる一方で長期予後を良好にさせる因子だった.
Purpose: High preoperative visceral fat is reported to increase postoperative complications in patients with gastric cancer, and the occurrence of these complications is associated with a poor prognosis. In this study, we investigated the effects of high preoperative visceral fat on short and long-term postoperative outcomes for patients with gastric cancer. Materials and Methods: A total of 485 patients with advanced gastric cancer with p-T2 (MP) or deeper who underwent gastrectomy between April 2008 and April 2018 were included in the study. Before surgery, the visceral adipose tissue index (VAI) was calculated by dividing the area of visceral fat mass at the umbilical level on computed tomography by the square of height. A ROC curve for severe complications with Clavien-Dindo classification 3 or higher was used to calculate a cut-off value for VAI. Cases were then classified into high VAI and low VAI groups. Result: The high VAI group included 270 patients (55.7%). In multivariate analysis, high VAI emerged as an independent risk factor for severe complications in gastric cancer (OR 2.130, 95% CI 1.110–4.080, P=0.024). High VAI was also found to be an independent prognostic factor for overall survival (HR 0.508, 95% CI 0.363–0.711, P<0.001). Conclusion: Preoperative high VAI is a significant factor that contributes to increased postoperative complications, but improves long-term prognosis, in patients with gastric cancer.
近年,胃癌手術において術前体組成分析を用いた術後合併症予測の報告が増加している.体組成のうち内臓脂肪量と術後合併症の関連については,内臓脂肪量が多いと膵液漏,縫合不全を含めた腹腔内感染症,創部感染など感染性合併症が増加すると報告されている(Table 1)1)~10).内臓脂肪量が多いと手術時間の延長や術中出血量の増加につながり7)11)12),手術難度を上昇させることが原因と考えられる.また,メタボリック症候群の胃癌患者を対象とした術前運動プログラムの効果として,内臓脂肪量が減少すると術後合併症が減少することが報告されている13).以上からは短期的合併症を予防するためには術前内臓脂肪量が少ないほうがよいと考えられる.
| No. | Author/Year | Country | Design | Sample size (male/female) | Median age | Median BMI | Type of operation | Obesity criteria (Cut off value) | Outcome |
|---|---|---|---|---|---|---|---|---|---|
| 1 | Zhang1)/2018 | China | retrospective | 156 (115/41) | 59.1 | 23.3 | Open | VSR: men ≥1.33 women ≥0.93 |
Increased postoperative inflammatory complications |
| 2 | Yang2)/2020 | China | prospective | 276 (194/82) | No data | 22.5 | Open/Laparoscopic | VFA ≥100 cm2 | Increased total postoperative complications |
| 3 | Sugisawa3)/2012 | Japan | retrospective | 206 (146/60) | 65.9 | 23.0 | Open | VFA ≥113.6 cm3 | Increased anastomotic leakage/pancreas-related infection |
| 4 | Sato4)/2017 | Japan | retrospective | 79 (52/27) | 65.0 | 22.6 | Open/Laparoscopic | Fatty pancreas | Increased pancreatic fistula |
| 5 | Tokunaga5)/2009 | Japan | retrospective | 135 (85/50) | 63.8 | 22.1 | Open | VFA (no cut off) | Increased hospital death/intra-abdominal infection |
| 6 | Kunisaki6)/2009 | Japan | retrospective | 152 (101/51) | 64.8 | 22.5 | LADG | VFA ≥100 cm2 | Increased conversion to open surgery/postoperative complications |
| 7 | Miyaki7)/2013 | Japan | retrospective | 84 (51/33) | 67.3 | 22.9 | LADG | VFA ≥100 cm2 | Increased perioperative complications |
| 8 | Yoshikawa8)/2011 | Japan | retrospective | 66 (38/28) | 64.0 | No data | Laparoscopic | VFA ≥100 cm2 | Increased total postoperative complications |
| 9 | Takeuchi9)/2016 | Japan | retrospective | 75 (57/18) | 70.7 | 22.3 | Open total | VFA ≥100 cm2 | Increased anastomotic leakage/incisional SSI |
| 10 | Wang10)/2018 | China | retrospective | 859 (672/187) | 64.0 | 21.8 | No data (total/subtotal) | VFA ≥100 cm2 | Increased surgical complications |
BMI: body mass index, LADG: laparoscopy-assisted distal gastrectomy, VSR: visceral-to-subcutaneous adipose tissue area ratio, VFA: visceral fat area, SSI: surgical site infection
一方で内臓脂肪量が胃がん術後の長期予後に与える影響についてはいまだ一定の見解がない.術後合併症の発生は胃癌術後の長期予後を不良とし14),合併症が重症になるほど予後不良になると報告されている15).上記の報告からは内臓脂肪量が多いことは術後合併症増加に関与するため,内臓脂肪量が多いと胃癌術後の長期予後が不良になる可能性がある.がん患者において肥満は癌の発育に関わることが報告されているが16),予後を延長するパラドックスの存在も報告されている17).一方でがんの中でも肺がんや大腸がんは肥満が予後良好因子となるが18)19),乳がん,膵癌と肝細胞癌では肥満は予後不良因子と報告されており20)~22),肥満が長期予後に与える影響は癌腫によって異なる.世界では肥満は増加の一途を辿っており,内臓脂肪量が胃がん術後の予後に与える影響を明らかにすることに意義がある.
本研究の目的は術前の内臓脂肪量が進行胃癌における術後合併症と全生存期間に与える影響を明らかにすることである.今回,進行胃癌患者において術前に測定した内臓脂肪量が多いと術後合併症が増加し,全生存期間が不良になると仮説を立てて検証を行った.
この研究は石川県立中央病院の単施設で行われた後ろ向きのコホート研究である.適格基準は2008年9月から2018年4月までの間でp-T2(MP)以深の初発の進行胃癌とし,胃切除術もしくは胃全摘術を行い,術前にCTによる内臓脂肪量と筋肉量の測定が可能だった症例を対象とした.除外基準は早期癌,残胃癌,他の癌の合併,その他の術式,データ不十分例とした.最終的に485症例がエントリーされた.
内臓脂肪量および筋肉量の測定は手術直前のCTを用いて行い,画像解析ソフトとしてZiostation(ZIOSOFT, Tokyo, Japan)を使用した.内臓脂肪量は単純CTの臍レベル,筋断面積は第3腰椎レベルで単スライスの全断面積を測定した.これらは組織固有の閾値として内臓脂肪組織は–150HUから–50HU,骨格筋は–29HUから150HUで測定し,ともに身長の二乗で除して標準化し,visceral adipose tissue index(以下,VAIと略記,cm2/m2)とskeletal muscle mass index(以下,SMIと略記,cm2/m2)として算出した1).
VAIとSMI,body mass index(以下,BMIと略記)のcut off値は,Clavien-Dindo(以下,CDと略記)分類3a以上の重症合併症との関係でROC曲線を描いて男女別に算出した.VAIのcut off値は男性で30.57 cm2/m2(area under the curve(以下,AUCと略記):0.513,95%信頼区間(confidence interval;以下,CIと略記):0.412~0.613),女性で24.32 cm2/m2(AUC:0.585,95% CI:0.466~0.704)と算出され,それぞれの値以下をlow-VAI,それぞれの値以上をhigh-VAIと定義した.SMIのcut off値は男性で45.54 cm2/m2(AUC:0.542,95% CI:0.444~0.639),女性で29.66 cm2/m2(AUC:0.734,95% CI:0.589~0.878)と算出され,それぞれの値以下をlow-SMI,それぞれの値以上をhigh-SMIと定義した.BMIのcut off値は男性で22.19 cm2/m2(AUC:0.487,95% CI:0.384~0.590),女性で23.49 cm2/m2(AUC:0.619,95% CI:0.448~0.790)と算出され,それぞれの値以下をlow-BMI,それぞれの値以上をhigh-BMIと定義した.
Primary outcomeは全生存期間(overall survival;以下,OSと略記),secondary outcomeは術後30日以内のCD分類grade 3a以上の重症合併症とした.OSについてはVAI別の2群間比較と重症合併症の有無による2群間比較を行った.また,VAI別の2群間で原病死と他病死,無増悪生存期間についても検討した.重症合併症,OSに関わる予測因子については全症例,腹腔鏡手術症例,開腹手術症例に分けて検討した.
患者背景の2群間比較にはWilcoxon順位和検定もしくはカイ二乗検定を用いた.長期予後の比較にはログランク検定を用いてカプランマイヤー曲線を描いた.重症合併症についてはロジスティック回帰分析を用いて単変量解析を行い,P値が0.10以下だった因子を含めて多変量解析を行い,オッズ比(odds ratio;以下,ORと略記)を算出した.OSに関わる予後不良因子の解析にはCox比例ハザード回帰分析を用いて単変量解析を行い,続いてP値が0.10以下だった因子を含めて多変量解析を行い,ハザード比(hazard ratio;以下,HRと略記)を算出した.解析にはEZR(Saitama Medical Center, Jichi Medical University, Saitama, Japan)を使用し23),P値0.05未満を統計学的有意差ありと定義した.
解析に用いる検討項目として以下の変数を集積した.性別,年齢,BMI,術式,到達法,病理病期,リンパ節郭清,術前化学療法,術後化学療法,併存疾患,術前血清アルブミン値(albumin;以下,Albと略記),術前C-reactive protein値(以下,CRPと略記),SMI,VAI,術後合併症とした.術後合併症は術後30日以内の合併症と定義し,CD分類に従ってgrade 2以上の総数とgrade 3a以上の重症合併症について算出した.病理病期は胃癌取扱い規約第15版に従って定義した.併存疾患として慢性腎臓病はestimated glomerular filtration rate <60 ml/min/1.73 m2と定義した.糖尿病は加療歴がある方もしくは術前採血でHbA1cが国際基準6.5%以上の症例と定義した.慢性閉塞性肺疾患(chronic obstructive pulmonary disease;以下,COPDと略記)は呼吸機能検査で1秒率が70%未満であったものと定義した.慢性心不全は心不全加療歴がある方もしくは心臓超音波検査で駆出率が50%未満と定義した.
術前化学療法についてはガイドラインで明確な適応基準がないため,CTでリンパ節転移が明確である局所進行がんを対象として実施した.レジメンは体表面積に基づいて用量調整を行い,SP療法(S-1を1~21日目に80~120 mg/bodyで投与し,シスプラチンを8日目に60 mg/m2追加)を4週間1サイクルとして2~3サイクルを行う方法か,SOX療法(S-1を1~14日目に80~120 mg/bodyで投与し,オキサリプラチンを1日目に100 mg/m2追加)を3週間1サイクルとして3サイクル行う方法で実施した.術後補助化学療法は胃癌治療ガイドラインに従って適応を決定し,S-1を1日あたり80~120 mg/bodyで投与し,副作用が出現した場合にはガイドラインに従って減量を行い,最大1年間継続した.Stage IV症例および再発症例についてはガイドラインに従って化学療法を行った.
倫理的配慮についてはヘルシンキ宣言に沿って本研究の評価の趣旨,方法,およびリスクを説明し,文書によって全ての対象者から同意を得て,石川県立中央病院の倫理委員会で承認を得た(承認番号:1592).厚生労働省の人を対象とする医学系研究に関する倫理指針に準拠した.参加の拒否についてはオプトアウト形式を適応した.
全485例をcut off値に従って215例(44.3%)をlow-VAI群,270例(55.7%)をhigh-VAI群に割り当てた.VAI別の患者背景の比較では,high-VAI群でBMIが有意に高く(P<0.001),糖尿病の併存割合が有意に高く(P<0.001),low-SMIの割合が有意に低かった(P=0.002)(Table 2).術後合併症の比較では,high-VAI群でCD分類2以上の合併症率,3a以上の重症合併症率が有意に高かった(それぞれP=0.020,P=0.022).
| Low-VAI (n=215) | High-VAI (n=270) | P value | ||
|---|---|---|---|---|
| Gender | Male | 139 (64.7%) | 184 (68.1%) | 0.439 |
| Female | 76 (35.3%) | 86 (31.9%) | ||
| Age, mean±SD | 67.50±12.43 | 68.19±9.98 | 0.498 | |
| Body mass index, mean±SD | 20.62±2.64 | 24.55±3.15 | <0.001 | |
| Approach | Laparoscopic surgery | 109 (50.7%) | 139 (51.5%) | 0.927 |
| Open surgery | 106 (49.3%) | 131 (48.5%) | ||
| Procedure | Distal gastrectomy | 112 (52.1%) | 153 (56.7%) | 0.582 |
| Proximal gastrectomy | 12 (5.6%) | 12 (4.4%) | ||
| Total gastrectomy | 91 (42.3%) | 105 (38.9%) | ||
| Pathological stage | 0.075 | |||
| I (p/yp) | 30 (14.0%)/0 (0%) | 52 (19.3%)/1 (0.4%) | ||
| II (p/yp) | 74 (34.4%)/8 (3.7%) | 77 (28.5%)/9 (3.3%) | ||
| III (p/yp) | 63 (29.3%)/10 (4.7%) | 97 (35.9%)/10 (3.7%) | ||
| IV (p/yp) | 27 (12.6%)/3 (1.4%) | 21 (7.8%)/3 (1.1%) | ||
| Extended lymphadenectomy | ||||
| D1+ | 97 (45.1%) | 127 (47.0%) | 0.714 | |
| D2 | 118 (54.9%) | 143 (53.0%) | ||
| Neoadjuvant chemotherapy | 21 (9.8%) | 28 (10.4%) | 0.880 | |
| Postoperative chemotherapy | 137 (63.7%) | 170 (63.0%) | 0.924 | |
| Comorbidity | CKD | 37 (17.2%) | 51 (18.9%) | 0.722 |
| COPD | 38 (17.7%) | 62 (23.0%) | 0.175 | |
| Diabetes | 23 (10.7%) | 68 (25.2%) | <0.001 | |
| CHF | 9 (4.2%) | 17 (6.3%) | 0.417 | |
| Preoperative Albumin (g/dl) | ||||
| >3.5 | 167 (80.7%) | 221 (84.7%) | 0.268 | |
| ≤3.5 | 40 (19.3%) | 40 (15.3%) | ||
| Preoperative CRP (mg/dl) | ||||
| <0.5 | 179 (83.3%) | 220 (81.5%) | 0.634 | |
| ≥0.5 | 36 (16.7%) | 50 (18.5%) | ||
| SMI (cm2/m2), median (range) | 36.76 (20.38–58.74) | 40.77 (21.05–75.18) | <0.001 | |
| Low-SMI | 133 (61.9%) | 128 (47.4%) | 0.002 | |
| VAI (cm2/m2), median (range) | 14.00 (0.38–30.34) | 48.74 (24.32–123.75) | <0.001 | |
| Postoperative complication | ||||
| CD classification ≥2 | 36 (16.7%) | 69 (25.6%) | 0.020 | |
| CD classification ≥3a | 14 (6.5%) | 35 (13.0%) | 0.022 | |
VAI: visceral adipose tissue index, SD: standard deviation, CKD: chronic kidney disease, COPD: chronic obstructive pulmonary disease, CHF: chronic heart failure, CRP: C-reactive protein, CD: Clavien-Dindo, SMI: skeletal muscle mass index
全485症例のうち重症合併症を49例(10.1%)に認め,主な内訳は膵液漏9例(1.9%),縫合不全18例(3.7%),肺炎9例(1.9%),術後出血7例(1.4%)だった.到達法別では腹腔鏡手術248症例のうち重症合併症を19症例(7.7%),開腹手術237症例のうち30例(12.7%)に認めた.重症合併症に関わる因子の解析結果をTable 3に示す.単変量解析では男性(P=0.006),high-VAI(P=0.022)で統計学的有意差を認めた.P値が0.10以下だった因子を含めて多変量解析を行うと,男性(OR:2.690,95%CI:1.230~5.920,P=0.014)とhigh-VAI(OR:2.130,95%CI:1.110~4.080,P=0.024)が重症合併症の独立したリスク因子として算出された.腹腔鏡手術症例に絞った解析結果をTable 4,開腹手術症例に絞った解析結果をTable 5に示す.到達法別に解析した結果ではhigh-VAIは多変量解析で独立したリスク因子とならなかった.
| Variables | Univariate analysis | Multivariate analysis | |||||
|---|---|---|---|---|---|---|---|
| OR | 95%CI | P value | OR | 95%CI | P value | ||
| Gender | Female | 1 | 1 | ||||
| Male | 3.000 | 1.380–6.540 | 0.006 | 2.690 | 1.230–5.920 | 0.014 | |
| Age (years) | <70 | 1 | |||||
| ≥70 | 1.400 | 0.778–2.510 | 0.264 | ||||
| Procedure | Distal gastrectomy | 1 | |||||
| Total gastrectomy | 1.390 | 0.777–2.500 | 0.265 | ||||
| Approach | Laparoscopic surgery | 1 | 1 | ||||
| Open surgery | 1.710 | 0.943–3.100 | 0.078 | 1.550 | 0.846–2.850 | 0.156 | |
| Pathological stage | <III | 1 | |||||
| ≥III | 0.981 | 0.547–1.760 | 0.948 | ||||
| Neoadjuvant chemotherapy | Absent | 1 | |||||
| Present | 1.330 | 0.535–3.300 | 0.540 | ||||
| Lymph nodes dissection | D1+ | 1 | |||||
| D2 | 1.070 | 0.594–1.930 | 0.822 | ||||
| Chronic kidney disease | Absent | 1 | |||||
| Present | 1.310 | 0.642–2.660 | 0.460 | ||||
| Diabetes | Absent | 1 | |||||
| Present | 1.160 | 0.557–2.410 | 0.694 | ||||
| COPD | Absent | 1 | |||||
| Present | 0.905 | 0.437–1.870 | 0.788 | ||||
| Chronic heart failure | Absent | 1 | |||||
| Present | 2.120 | 0.769–5.850 | 0.146 | ||||
| BMI | Low-BMI | 1 | |||||
| High-BMI | 1.150 | 0.597–2.200 | 0.681 | ||||
| Preoperative Albumin (g/dl) | >3.5 | 1 | |||||
| ≤3.5 | 0.896 | 0.405–1.980 | 0.787 | ||||
| Preoperative CRP (mg/dl) | <0.5 | 1 | |||||
| ≥0.5 | 1.580 | 0.789–3.160 | 0.197 | ||||
| SMI (cm2/m2) | High-SMI | 1 | |||||
| Low-SMI | 0.967 | 0.535–1.750 | 0.911 | ||||
| VAI (cm2/m2) | Low-VAI | 1 | 1 | ||||
| High-VAI | 2.140 | 1.120–4.090 | 0.022 | 2.130 | 1.110–4.080 | 0.024 | |
OR: odds ratio, CI: confidence interval, COPD: chronic obstructive pulmonary disease, CRP: C-reactive protein, SMI: skeletal muscle mass index, VAI: visceral adipose tissue index
| Variables | Univariate analysis | Multivariate analysis | |||||
|---|---|---|---|---|---|---|---|
| OR | 95%CI | P value | OR | 95%CI | P value | ||
| Gender | Female | 1 | 1 | ||||
| Male | 2.650 | 0.860–8.160 | 0.090 | 2.050 | 0.634–6.630 | 0.231 | |
| Age (years) | <70 | 1 | |||||
| ≥70 | 1.340 | 0.539–3.340 | 0.526 | ||||
| Procedure | Distal gastrectomy | 1 | |||||
| Total gastrectomy | 1.080 | 0.398–2.920 | 0.883 | ||||
| Pathological stage | <III | 1 | |||||
| ≥III | 0.950 | 0.366–2.470 | 0.916 | ||||
| Neoadjuvant chemotherapy | Absent | 1 | |||||
| Present | 1.710 | 0.363–8.070 | 0.497 | ||||
| Lymph nodes dissection | D1+ | 1 | |||||
| D2 | 0.818 | 0.327–2.040 | 0.668 | ||||
| Chronic kidney disease | Absent | 1 | |||||
| Present | 1.450 | 0.501–4.190 | 0.493 | ||||
| Diabetes | Absent | 1 | |||||
| Present | 1.620 | 0.558–4.700 | 0.375 | ||||
| COPD | Absent | 1 | |||||
| Present | 1.130 | 0.394–3.250 | 0.819 | ||||
| Chronic heart failure | Absent | 1 | 1 | ||||
| Present | 3.850 | 1.140–13.00 | 0.030 | 3.570 | 0.980–13.00 | 0.053 | |
| BMI | Low-BMI | 1 | |||||
| High-BMI | 0.675 | 0.190–2.390 | 0.542 | ||||
| Preoperative Albumin (g/dl) | >3.5 | 1 | |||||
| ≤3.5 | 0.797 | 0.176–3.610 | 0.769 | ||||
| Preoperative CRP (mg/dl) | <0.5 | 1 | 1 | ||||
| ≥0.5 | 2.600 | 0.876–7.690 | 0.085 | 2.520 | 0.817–7.780 | 0.108 | |
| SMI (cm2/m2) | High-SMI | 1 | |||||
| Low-SMI | 0.878 | 0.350–2.200 | 0.781 | ||||
| VAI (cm2/m2) | Low-VAI | 1 | 1 | ||||
| High-VAI | 2.520 | 0.885–7.150 | 0.084 | 2.320 | 0.798–6.730 | 0.122 | |
OR: odds ratio, CI: confidence interval, COPD: chronic obstructive pulmonary disease, BMI: body mass index, CRP: C-reactive protein, SMI: skeletal muscle mass index, VAI: visceral adipose tissue index
| Variables | Univariate analysis | Multivariate analysis | |||||
|---|---|---|---|---|---|---|---|
| OR | 95%CI | P value | OR | 95%CI | P value | ||
| Gender | Female | 1 | 1 | ||||
| Male | 3.120 | 1.050–9.270 | 0.041 | 3.070 | 1.020–9.220 | 0.045 | |
| Age (years) | <70 | 1 | |||||
| ≥70 | 1.360 | 0.628–2.930 | 0.437 | ||||
| Procedure | Distal gastrectomy | 1 | |||||
| Total gastrectomy | 1.340 | 0.617–2.920 | 0.458 | ||||
| Pathological stage | <III | 1 | |||||
| ≥III | 0.785 | 0.362–1.700 | 0.538 | ||||
| Neoadjuvant chemotherapy | Absent | 1 | |||||
| Present | 1.030 | 0.335–3.180 | 0.955 | ||||
| Lymph nodes dissection | D1+ | 1 | |||||
| D2 | 1.190 | 0.539–2.620 | 0.670 | ||||
| Chronic kidney disease | Absent | 1 | |||||
| Present | 1.250 | 0.477–3.280 | 0.650 | ||||
| Diabetes | Absent | 1 | |||||
| Present | 0.880 | 0.317–2.440 | 0.806 | ||||
| COPD | Absent | 1 | |||||
| Present | 0.782 | 0.283–2.160 | 0.635 | ||||
| Chronic heart failure | Absent | 1 | |||||
| Present | 0.897 | 0.108–7.430 | 0.919 | ||||
| BMI | Low-BMI | 1 | |||||
| High-BMI | 1.320 | 0.593–2.920 | 0.500 | ||||
| Preoperative Albumin (g/dl) | >3.5 | 1 | |||||
| ≤3.5 | 0.811 | 0.314–2.100 | 0.666 | ||||
| Preoperative CRP (mg/dl) | <0.5 | 1 | |||||
| ≥0.5 | 1.040 | 0.420–2.560 | 0.937 | ||||
| SMI (cm2/m2) | High-SMI | 1 | |||||
| Low-SMI | 0.941 | 0.427–2.070 | 0.879 | ||||
| VAI (cm2/m2) | Low-VAI | 1 | 1 | ||||
| High-VAI | 1.940 | 0.845–4.460 | 0.118 | 1.970 | 0.851–4.560 | 0.113 | |
OR: odds ratio, CI: confidence interval, COPD: chronic obstructive pulmonary disease, BMI: body mass index, CRP: C-reactive protein, SMI: skeletal muscle mass index, VAI: visceral adipose tissue index
観察期間の中央値は41か月だった.全症例を含めたVAIの2群間でのOS比較の結果をFig. 1aに示す.High-VAI群がlow-VAI群と比較して有意に予後が良好だった(P<0.001).死因別の検討として原病死の比較をFig. 1bに,他病死の比較をFig. 1cに示す.原病死,他病死ともにhigh-VAI群がlow-VAI群と比較して有意に予後が良好だった(それぞれP=0.009,P=0.025).無増悪生存期間の比較をFig. 1dに示す.High-VAI群がlow-VAI群と比較して予後が良い傾向を認めた(P=0.088).続いて,全症例を含めた重症合併症の有無で2群間比較したOSの結果をFig. 2に示す.重症合併症ありの群が重症合併症なしの群と比較して有意に予後が不良だった(P=0.028).また,VAIと重症合併症で層別化したOSの結果をFig. 3に示す.High-VAIかつ重症合併症なしの群が最も予後良好で,low-VAIかつ重症合併症ありの群が最も予後不良だった(P<0.001).

Kaplan-Meier curves in all patients for overall survival (OS), cancer-specific survival (CSS), other-cause survival (OCS) and progression-free survival (PFS) according to level of visceral adipose tissue. a) OS (P<0.001), b) CSS (P=0.009), c) OCS (P=0.025), d) PFS (P=0.088).
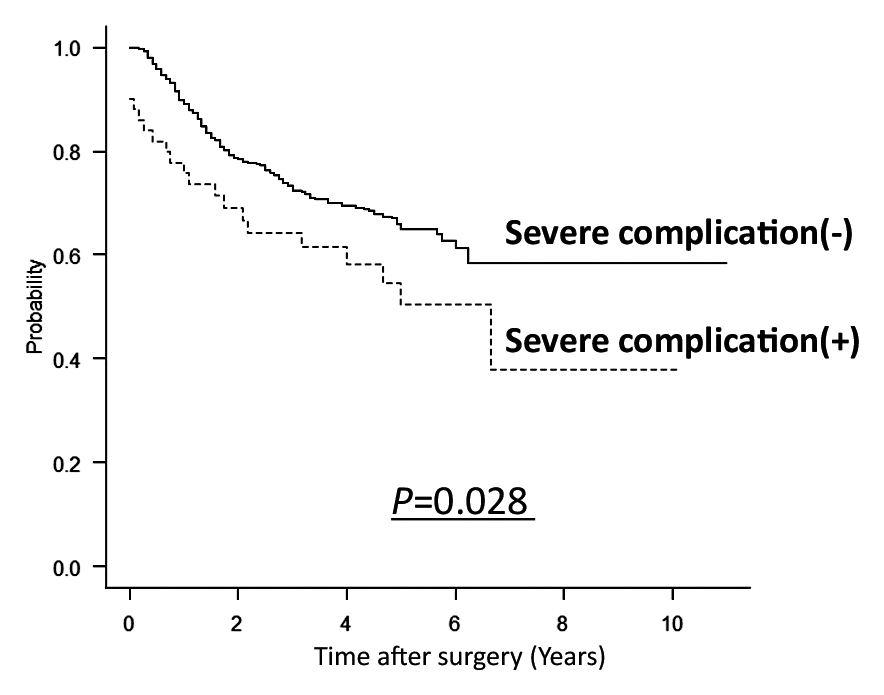
Kaplan-Meier curves for overall survival (OS) based on postoperative severe complications (P=0.028).

Kaplan-Meier curves for overall survival (OS) stratified by visceral adipose tissue and postoperative severe complications.
全症例を含めたOSに関わる予後不良因子の解析結果をTable 6に示す.単変量解析では年齢70歳以上(P<0.001),胃全摘術(P<0.001),開腹手術(P<0.001),p-stage III以上(P<0.001),術前化学療法施行(P=0.006),D2リンパ節郭清(P<0.001),high-BMI(P=0.011),術前Alb値3.5 g/dl以下(P=0.005),術前CRP 0.5 mg/dl以上(P<0.001),重症合併症(P=0.028),low-SMI(P=0.003),high-VAI(P<0.001)で統計学的有意差を認めた.続いてP値が0.10以下の因子を含めて多変量解析を行った.その結果,年齢70歳以上(HR:2.088,95%CI:1.478~2.950,P<0.001),開腹手術(HR:1.886,95%CI:1.316~2.702,P<0.001),p-stage III以上(HR:4.117,95%CI:2.808~6.034,P<0.001),D2リンパ節郭清(HR:0.581,95%CI:0.412~0.819,P=0.002),術前CRP 0.5 mg/dl以上(HR:1.700,95%CI:1.143~2.529,P=0.009),CD3a以上の術後合併症(HR:1.691,95%CI:1.058~2.703,P=0.028),high-VAI(HR:0.508,95%CI:0.363~0.711,P<0.001)が独立した予後規定因子であった.次に,腹腔鏡手術症例に絞った予後不良因子の解析結果をTable 7に示す.多変量解析の結果,p-stage III以上(HR:8.946,95%CI:4.401~18.19,P<0.001),術後化学療法(HR:0.206,95%CI:0.102~0.418,P<0.001),糖尿病(HR:3.565,95%CI:1.891~6.722,P<0.001),high-VAI(HR:0.474,95%CI:0.259~0.869,P=0.016)が独立した予後規定因子であった.最後に,開腹手術症例に絞った予後不良因子の解析結果をTable 8に示す.多変量解析の結果,年齢70歳以上(HR:1.833,95%CI:1.226~2.740,P=0.003),p-stage III以上(HR:3.342,95%CI:2.118~5.273,P<0.001),D2リンパ節郭清(HR:0.610,95%CI:0.407~0.915,P=0.017),COPD(HR:1.643,95%CI:1.032~2.615,P=0.036),high-VAI(HR:0.488,95%CI:0.333~0.714,P<0.001)が独立した予後規定因子であった.
| Variables | Univariate analysis | Multivariate analysis | |||||
|---|---|---|---|---|---|---|---|
| HR | 95%CI | P value | HR | 95%CI | P value | ||
| Gender | Female | 1 | |||||
| Male | 1.127 | 0.812–1.564 | 0.474 | ||||
| Age (years) | <70 | 1 | 1 | ||||
| ≥70 | 2.206 | 1.613–3.017 | <0.001 | 2.088 | 1.478–2.950 | <0.001 | |
| Procedure | Distal gastrectomy | 1 | 1 | ||||
| Total gastrectomy | 1.809 | 1.331–2.460 | <0.001 | 1.104 | 0.788–1.548 | 0.565 | |
| Approach | Laparoscopic surgery | 1 | 1 | ||||
| Open surgery | 2.850 | 2.043–3.976 | <0.001 | 1.886 | 1.316–2.702 | <0.001 | |
| Pathological stage | <III | 1 | 1 | ||||
| ≥III | 4.099 | 2.896–5.801 | <0.001 | 4.117 | 2.808–6.034 | <0.001 | |
| Neoadjuvant chemotherapy | Absent | 1 | 1 | ||||
| Present | 1.881 | 1.199–2.951 | 0.006 | 1.522 | 0.936–2.476 | 0.091 | |
| Postoperative chemotherapy | Absent | 1 | |||||
| Present | 0.904 | 0.656–1.246 | 0.537 | ||||
| Lymph nodes dissection | D1+ | 1 | 1 | ||||
| D2 | 0.668 | 0.492–0.908 | <0.001 | 0.581 | 0.412–0.819 | 0.002 | |
| Chronic kidney disease | Absent | 1 | |||||
| Present | 1.086 | 0.727–1.622 | 0.688 | ||||
| Diabetes | Absent | 1 | |||||
| Present | 1.224 | 0.835–1.793 | 0.300 | ||||
| COPD | Absent | 1 | |||||
| Present | 1.255 | 0.870–1.810 | 0.225 | ||||
| Chronic heart failure | Absent | 1 | |||||
| Present | 0.775 | 0.363–1.654 | 0.510 | ||||
| BMI | Low-BMI | 1 | 1 | ||||
| High-BMI | 1.536 | 1.105–2.134 | 0.011 | 1.125 | 0.784–1.616 | 0.523 | |
| Preoperative Albumin (g/dl) | >3.5 | 1 | 1 | ||||
| ≤3.5 | 1.729 | 1.182–2.529 | 0.005 | 0.919 | 0.603–1.401 | 0.694 | |
| Preoperative CRP (mg/dl) | <0.5 | 1 | 1 | ||||
| ≥0.5 | 2.051 | 1.443–2.915 | <0.001 | 1.700 | 1.143–2.529 | 0.009 | |
| Postoperative complication | Absent | 1 | 1 | ||||
| Clavien-Dindo ≥2 | 1.025 | 0.700–1.501 | 0.899 | ||||
| Clavien-Dindo ≥3a | 1.653 | 1.055–2.590 | 0.028 | 1.691 | 1.058–2.703 | 0.028 | |
| SMI (cm2/m2) | High-SMI | 1 | 1 | ||||
| Low-SMI | 1.631 | 1.185–2.246 | 0.003 | 1.226 | 0.876–1.715 | 0.234 | |
| VAI (cm2/m2) | Low-VAI | 1 | 1 | ||||
| High-VAI | 0.591 | 0.433–0.807 | <0.001 | 0.508 | 0.363–0.711 | <0.001 | |
HR: hazard ratio, CI: confidence interval
| Variables | Univariate analysis | Multivariate analysis | |||||
|---|---|---|---|---|---|---|---|
| HR | 95%CI | P value | HR | 95%CI | P value | ||
| Gender | Female | 1 | |||||
| Male | 1.073 | 0.603–1.913 | 0.810 | ||||
| Age (years) | <70 | 1 | 1 | ||||
| ≥70 | 4.127 | 2.220–7.675 | <0.001 | 1.837 | 0.933–3.615 | 0.078 | |
| Procedure | Distal gastrectomy | 1 | |||||
| Total gastrectomy | 1.063 | 0.580–1.947 | 0.844 | ||||
| Pathological stage | <III | 1 | 1 | ||||
| ≥III | 4.532 | 2.515–8.166 | <0.001 | 8.946 | 4.401–18.19 | <0.001 | |
| Neoadjuvant chemotherapy | Absent | 1 | |||||
| Present | 1.901 | 0.680–5.314 | 0.221 | ||||
| Postoperative chemotherapy | Absent | 1 | 1 | ||||
| Present | 0.337 | 0.188–0.607 | <0.001 | 0.206 | 0.102–0.418 | <0.001 | |
| Lymph nodes dissection | D1+ | 1 | |||||
| D2 | 0.644 | 0.365–1.133 | 0.127 | ||||
| Chronic kidney disease | Absent | 1 | |||||
| Present | 1.291 | 0.661–2.521 | 0.455 | ||||
| Diabetes | Absent | 1 | 1 | ||||
| Present | 2.400 | 1.324–4.349 | 0.004 | 3.565 | 1.891–6.722 | <0.001 | |
| COPD | Absent | 1 | |||||
| Present | 0.921 | 0.461–1.843 | 0.816 | ||||
| Chronic heart failure | Absent | 1 | |||||
| Present | 1.476 | 0.585–3.723 | 0.409 | ||||
| BMI | Low-BMI | 1 | |||||
| High-BMI | 1.472 | 0.782–2.769 | 0.231 | ||||
| Preoperative Albumin (g/dl) | >3.5 | 1 | |||||
| ≤3.5 | 1.831 | 0.856–3.916 | 0.119 | ||||
| Preoperative CRP (mg/dl) | <0.5 | 1 | 1 | ||||
| ≥0.5 | 2.681 | 1.399–5.136 | 0.003 | 1.822 | 0.932–3.563 | 0.079 | |
| Postoperative complication | Absent | 1 | 1 | ||||
| Clavien-Dindo | ≥2 | 1.367 | 0.714–2.616 | 0.346 | |||
| Clavien-Dindo | ≥3a | 2.844 | 1.334–6.063 | 0.007 | 1.923 | 0.869–4.255 | 0.107 |
| SMI (cm2/m2) | High-SMI | 1 | 1 | ||||
| Low-SMI | 2.502 | 1.380–4.534 | 0.003 | 1.734 | 0.941–3.197 | 0.078 | |
| VAI (cm2/m2) | Low-VAI | 1 | 1 | ||||
| High-VAI | 0.700 | 0.402–1.220 | 0.209 | 0.474 | 0.259–0.869 | 0.016 | |
HR: hazard ratio, CI: confidence interval
| Variables | Univariate analysis | Multivariate analysis | |||||
|---|---|---|---|---|---|---|---|
| HR | 95%CI | P value | HR | 95%CI | P value | ||
| Gender | Female | 1 | |||||
| Male | 1.054 | 0.708–1.570 | 0.796 | ||||
| Age (years) | <70 | 1 | 1 | ||||
| ≥70 | 1.597 | 1.103–2.311 | 0.013 | 1.833 | 1.226–2.740 | 0.003 | |
| Procedure | Distal gastrectomy | 1 | 1 | ||||
| Total gastrectomy | 1.714 | 1.173–2.507 | 0.005 | 1.359 | 0.908–2.034 | 0.136 | |
| Pathological stage | <III | 1 | 1 | ||||
| ≥III | 2.848 | 1.845–4.396 | <0.001 | 3.342 | 2.118–5.273 | <0.001 | |
| Neoadjuvant chemotherapy | Absent | 1 | |||||
| Present | 1.403 | 0.847–2.322 | 0.188 | ||||
| Postoperative chemotherapy | Absent | 1 | |||||
| Present | 1.240 | 0.796–1.934 | 0.342 | ||||
| Lymph nodes dissection | D1+ | 1 | 1 | ||||
| D2 | 0.515 | 0.356–0.746 | <0.001 | 0.610 | 0.407–0.915 | 0.017 | |
| Chronic kidney disease | Absent | 1 | |||||
| Present | 1.077 | 0.651–1.781 | 0.774 | ||||
| Diabetes | Absent | 1 | |||||
| Present | 0.789 | 0.471–1.321 | 0.367 | ||||
| COPD | Absent | 1 | 1 | ||||
| Present | 1.647 | 1.069–2.539 | 0.024 | 1.643 | 1.032–2.615 | 0.036 | |
| Chronic heart failure | Absent | 1 | |||||
| Present | 0.494 | 0.122–2.003 | 0.324 | ||||
| BMI | Low-BMI | 1 | |||||
| High-BMI | 1.331 | 0.903–1.961 | 0.148 | ||||
| Preoperative Albumin (g/dl) | >3.5 | 1 | |||||
| ≤3.5 | 1.373 | 0.883–2.135 | 0.159 | ||||
| Preoperative CRP (mg/dl) | <0.5 | 1 | 1 | ||||
| ≥0.5 | 1.548 | 1.019–2.352 | 0.040 | 1.531 | 0.988–2.372 | 0.056 | |
| Postoperative complication | Absent | 1 | |||||
| Clavien-Dindo | ≥2 | 0.843 | 0.525–1.354 | 0.480 | |||
| Clavien-Dindo | ≥3a | 1.058 | 0.604–1.853 | 0.844 | |||
| SMI (cm2/m2) | High-SMI | 1 | |||||
| Low-SMI | 1.179 | 0.806–1.727 | 0.396 | ||||
| VAI (cm2/m2) | Low-VAI | 1 | 1 | ||||
| High-VAI | 0.537 | 0.369–0.782 | 0.001 | 0.488 | 0.333–0.714 | <0.001 | |
HR: hazard ratio, CI: confidence interval
進行胃癌患者を対象とした本研究において,術前に測定した内臓脂肪量が多いと重症合併症の増加に関わることが明らかとなった.また,術後合併症の増加があるにもかかわらず,長期予後は良好となるパラドックスが存在していた.この研究では議論すべき点がいくつか見受けられた.第1に内臓脂肪量が多いと術後合併症が増加したにもかかわらず,長期予後が良好であったこと,第2にlow-SMIが合併症の因子と予後規定因子にならなかったこと,第3に治療因子として開腹手術,D2リンパ節郭清が術後の独立した予後規定因子であったこと,最後に肥満の定義とそのcut off値についてである.
予後不良因子の検討では,重症合併症はOSの予後不良因子であった.High-VAIは重症合併症の独立したリスク因子であったため,high-VAIはOSの予後不良因子となることが予想されたが,逆に予後良好因子となる肥満パラドックスが存在していた.Fig. 3に示したVAI別と重症合併症の有無で4群に層別したカプランマイヤー曲線では,重症合併症がないhigh-VAI群が最も予後良好で,次に重症合併症がないlow-VAI群と重症合併症があったhigh-VAI群が同等の生存曲線を示した.この結果は重症合併症があると予後不良になることに矛盾せず,high-VAIが予後良好因子と示唆された.以上からはhigh-VAIと重症合併症はそれぞれ独立した予後規定因子であることを認識すべきであり,high-VAIは重症合併症が予後に与える負の影響を打ち消す効果がある可能性を示している.これまで肥満についてはBMIや内臓脂肪量を用いて定義されることが多く,本研究では内臓脂肪量を身長で補正したVAIを用い,短期的および長期的アウトカムの術前予測が良好であることを示した.
肥満と予後の関係についてPubMed(2000年~2020年)で「obesity」,「prognosis」,「gastric cancer」をキーワードとして検索すると,BMIで肥満を定義し,BMI別に予後を検討している論文が多く見受けられた.しかし,BMI高値は予後に影響しないとする論文もあれば24)~26),BMI 25 kg/m2以上は予後不良であるとする論文や27),逆にBMI 25 kg/m2以上は予後良好であるとする論文が存在し28),一定の見解がなかった.これはBMIだけでは筋肉量が多いか内臓脂肪量が多いかを判別することが難しいことが挙げられる.既報ではBMIよりも内臓脂肪量が術後合併症予測に有用であることが報告されており2)7)9),本研究でもBMIのcut off値をVAIと同様の方法でROC曲線から算出したが,重症合併症とも長期予後とも相関を認めなかった.
内臓脂肪量と予後の関係についてPubMed(2000年~2020年)で「visceral adipose tissue」,「prognosis」をキーワードとして検索した.Haradaら29)は食道がんと胃癌を半数ずつ含めた507人の患者の検討で,術前CTで測定した内臓脂肪量が低値だと予後不良だったと報告している.この理由として,内臓脂肪量が低値であることは低栄養であること,内臓脂肪量が高値であれば補充可能なエネルギーがたくさんあることを指摘している.内臓脂肪量が予後に関わる理由として,胃がん特有の術後体重減少の存在が挙げられる.PubMed(2000年~2020年)で「body weight loss」,「gastric cancer」をキーワードとして検索した.胃がん術後には6か月まで体重減少が持続し,その中で筋肉量は急性期を中心として3か月程度まで減少し,それ以降は脂肪組織を中心として減少する30)~34).筋肉量減少は特に最初の1週間で大きく31),それ以降は内臓脂肪中心の体組成変化が生じ,筋肉量を維持するための代謝変化と理解されている.術後の体重減少率が大きいほど後治療のコンプライアンスが悪くなり35),生存期間が不良になる36)~38).内臓脂肪量についても,Parkら39)は術後の内臓脂肪量減少率が大きいと予後不良であると報告している.以上からは内臓脂肪量は体内の栄養蓄積量を反映し,術前から少ない症例もしくは術後の減少率が大きい症例は予後不良につながることが示唆される.今回検討した症例では術後の栄養サポートは行っておらず,栄養介入の差が予後に影響した可能性はないと考えられる.
従来,low-SMIは胃癌術後のOSを不良にすると報告されてきたが40)41),今回の結果ではlow-SMIは独立した予後不良因子とならなかった.この理由としてlow-SMIを定義するためのcut off値の差が関与している可能性がある.PubMed(2000年~2020年)で「sarcopenia」,「prognosis」をキーワードとして検索した.現在報告されているCT測定のSMIのcut off値は少なくとも5種類存在している42)~46)が,Nishigoriら47)はSMIのcut off値が異なるとOSへの影響が異なることを指摘している.今回の男性のcut off値は従来アジアから報告されている値より高く,本研究で男性割合が高いことが予後に影響したと考えられる.今回のcut off値は重症合併症を目的変数としているため,OSを目的変数としてcut off値を算出するとOSの予後不良因子となった可能性がある.Low-SMIはmeta解析の結果から重症合併症のリスク因子であると報告されているが40)41),今回の結果で重症合併症の因子とならなかった理由についてもcut off値の差が影響した可能性がある.
治療因子の中で開腹手術,D2リンパ節郭清が独立した予後規定因子だった.PubMed(2000年~2020年)で「laparoscopic gastrectomy」,「prognosis」をキーワードとして検索した.進行胃癌に対する開腹手術と腹腔鏡手術の長期予後の比較では,近年になって腹腔鏡下手術の非劣性の報告も増えてきているが48)~52),腹腔鏡の優越性を示した論文はない.今回の結果では開腹手術が予後不良因子だったが,これには患者の選択バイアスが含まれている可能性がある.大型3型や4型腫瘍に関しては腹腔鏡下手術の適応は慎重になるため,ここで手術選択のバイアスが生じている可能性がある.D2リンパ節郭清については,手術による治療効果が高かったことを示している可能性がある.
最後に内臓脂肪量の測定方法と算出方法の妥当性について述べる.肥満の判定はBMIを用いることが簡便である一方,BMIのみでは筋肉量,内臓脂肪量および皮下脂肪量の内訳を判断することはできない.CTを用いた測定方法はこれらを判別できるメリットがある.内臓脂肪量の測定方法はCTがgolden standardであり53),最近では体組成をCTで求める報告が増加している.Kobayashiら54)は臍レベルで測定した単一スライスの内臓脂肪面積は全体の内臓脂肪量と強く相関することを示している.よって本研究での単一スライスでの内臓脂肪量の測定は全身の内臓脂肪量蓄積を反映している可能性が高い.筋肉量についてはこれまでにも身長補正によるindexでcut off値の検討がなされているため42)~46),今回は内臓脂肪量についても身長補正を行って算出した.Cut off値の妥当性については,胃癌で内臓脂肪量をindexとして検討した報告はないため,今後の研究の結果が待たれるところである.
この研究の限界は単施設での後ろ向きコホート研究であること,内臓脂肪量が予後に影響を与える病態が明らかでないことが挙げられる.今後は多施設での前向きコホート研究による普遍性の証明と因果関係を明らかにするとともに,基礎研究を含めた病態の解明が期待される.
以上,術前の内臓脂肪量高値は胃癌術後の術後合併症を増加させる一方で長期予後を良好にさせる因子だった.術前の体組成評価が術後の合併症および予後予測に重要であると考えられる.
利益相反:なし