Abstract
脳梗塞とは,脳を栄養する血管が閉塞もしくは狭窄することにより,その灌流領域に血流不全が生じ十分な酸素や栄養が供給されなくなり,結果として脳神経細胞が傷害されてしまう疾患である.近年の血栓溶解薬やカテーテル治療の進歩により脳梗塞の転帰は改善してきているものの,未だそれらの再開通療法の適応となる患者は10%未満であり,大半の患者には脳梗塞が完成することになる.脳は脆弱な組織であり,かつ再生能力が限定的であることから,完成した脳梗塞に対する根本的な治療は存在しなかったが,近年では幹細胞治療により脳を再生させられる可能性が見いだされ期待が集まっている.本稿では脳梗塞に対する幹細胞治療の現状を概説後,Muse細胞を用いた新規治療開発につき述べる.
1.はじめに
脳梗塞とは,脳を栄養する血管の閉塞もしくは狭窄することにより,その灌流領域に血流不全が生じ十分な酸素や栄養が供給されなくなり,結果として脳神経細胞が傷害されてしまう疾患である.脳は体重の2%程度の質量でしかないにも関わらず,全身の酸素の15%,グルコースの20%程度を消費する,大量のエネルギーを必要とする臓器であるため,ひとたび血流不全に陥ると,脳は速やかに傷害されてしまうことが問題となる.脳の血流を阻害する血栓を薬剤で溶解させる血栓溶解療法や,カテーテルを用いて機械的に血栓を除去する血栓回収療法といった,脳が障害される前に閉塞血管を再開通させる「再開通療法」の発達により治療成績は劇的に向上したが,前述のように脳が傷害されるまでの時間が短いため,再開通療法の適応になる患者数は全体の10%程度にすぎず,90%の患者では脳梗塞が完成してしまうことになる.
脳は血流不全に脆弱なだけではなく,再生能力が限られていることも問題である.1906年にノーベル賞を受賞したCajal博士が著書の中で「Once the development was ended, the founts of growth and regeneration of the axons and dendrites dried up irrevocably. In the adult centers, the nerve paths are something fixed, ended, and immutable. Everything may die, nothing may be regenerated. It is for the science of the future to change, if possible, this harsh decree.」1)と述べており,「脳は再生しない」ということが,いわば常識として扱われてきた.その後時を経て,脳梗塞をはじめとする種々の傷害後に脳室下帯や海馬の歯状回を中心として内因性の神経再生が見られることが明らかになったが2, 3),単純な内因性の再生だけでは,残念ながら十分な機能回復には至らない.脳梗塞が完成するとリハビリテーション以外には有効な治療がないため,結果として,約半数の脳梗塞患者に何らかの障害が後遺し,大きな社会的な問題となっている.そのような現状の中で,脳梗塞により失われた神経細胞を再生させ得る幹細胞治療・神経再生療法に大きな期待が集まっている.
2.脳梗塞に対する幹細胞治療臨床試験の現状
脳梗塞に対する幹細胞治療に当初期待されていたことは,失われた組織を直接的に幹細胞で置換して修復することであった.しかしながら,様々な前臨床研究の結果から,幹細胞治療による脳梗塞の治療効果のメカニズムは,抗炎症効果,グリア瘢痕形成の抑制,オートファジーの促進や栄養因子やサイトカインによる保護効果など,間接的な効果が主体であると考えられている4–6).
ヒト脳梗塞に対する幹細胞治療として,2005年に報告された3つの報告7–9)を皮切りに現在に至るまで多数の臨床試験が行われてきた.先駆的であった3つの臨床試験に敬意を表し,概略を示す.Kondziolkaらは,基底核病変に対して,ヒトteratocarcinoma cellを起源としたLBS-neurons(Layton BioScience, Inc.)を脳内に局所投与する第2相試験を報告した7).結果として,統計学的に有意な機能回復は見られなかったが,LBS-neuronsによる治療の安全性は証明された,とされている.ただし,けいれんや失神,硬膜下血腫等の合併症が18例中3例に生じていることには注意を要する.Savitzらは,ブタ胎児線条体由来のLGE細胞(Genvec, Inc.)を脳内に局所投与する臨床試験を行ったが8),5名の被検者のうち2名に言語機能や運動機能の改善を認めたものの,2名に運動機能の悪化や痙攣等の有害事象を認め,臨床試験が中止となった.また,Bangらは重症の中大脳動脈領域の脳梗塞に対して自家間葉系幹細胞を静脈内投与した9).特に有害事象は生じなかったが,有意な機能改善も得られなかった.
その後,様々な臨床試験が行われたが,用いられた細胞種,投与量や投与経路,投与時期など様々であり,一概に論じることはできないが,幹細胞治療の安全性は受け入れられるレベルであり,治療効果がみられている試験もある.正確な評価のためには二重盲検プラセボ対照ランダム化比較試験が必要であると考えられるが,それが難しい場合でも,少なくとも評価者は盲検である必要があると思われる.渉猟しえた限りでは7つの盲検ランダム化あるいはそれに近い形のプラセボ対照ランダム化試験が報告されていた10–16)(表1).7つの試験の概要を表1に示したが,modified Rankin Scale(mRS)の有意な改善を伴う機能改善を認めた試験は2つで(Hessらの試験では3ヶ月後には有効性を示せなかったが1年後のフォローアップではmRSや,それを含めた複合的指標での改善を認めた),その他の機能的指標を含めてプラセボ群と比較して細胞治療群で改善が認められた試験は4つであった.半分程度のランダム化比較試験で有意な機能改善が認められているため,対象や治療プロトコールの最適化により,更なる治療成績向上も期待できると思われる.治療時期と細胞投与経路については,血液脳関門の破綻や炎症反応などが大きい急性期であれば静脈内投与を選択するが,炎症などが弱くなり,かつ瘢痕組織形成も進んでいる慢性期であれば,細胞を局所に直接投与するほうが良いという意見が多いようである.
表1
脳梗塞に対する幹細胞治療(一重/二重盲検ランダム化試験もしくはPROBE法を用いた試験のみ)
| 著者 |
発表年 |
治療群/対照群(人) |
投与経路 |
細胞種 |
細胞数 |
治療時期 |
結果 |
| Chen et al.10) |
2014 |
15/15 |
脳内 |
自家CD34陽性造血幹細胞 |
3~8×106 |
6ヶ月~5年 |
安全性に問題なし.
mRSを含む複数指標で有意な機能改善. |
| Prasad et al.11) |
2014 |
60/60 |
静注 |
自家骨髄単核球細胞 |
2.8×108(平均値) |
7~30日 |
安全性に問題なし.
有意な機能改善なし. |
| Hess et al.12) |
2017 |
65/61 |
静注 |
他家骨髄由来細胞(Multistem) |
4×106もしくは1.2×107 |
24~48時間 |
安全性に問題なし.
90日の主要評価項目では差がなかったが,1年の経過観察では有意なmRS等の改善. |
| Bhatia et al.13) |
2018 |
10/10 |
動注 |
自家骨髄単核球細胞 |
6.1×108(平均値) |
8~15日 |
安全性に問題なし.
有意な機能改善なし(細胞治療で改善の傾向はあり). |
| Savitz et al.14) |
2019 |
29/19 |
動注 |
自家骨髄由来細胞(ALD-401) |
3.08×106(平均値) |
13~19日 |
安全性に問題なし.
有意な機能喜全なし. |
| Fang et al.15) |
2019 |
5+5/6 |
静注 |
自家血管内皮前駆細胞もしくは骨髄間質細胞 |
2.5×106/kg×2回 |
31~37日 |
安全性に問題なし.血管内皮前駆細胞群で副作用が少ない傾向(プラセボと比較して).
mRSに差はないがSSSが3ヶ月時点で改善. |
| Jaillard et al.16) |
2020 |
16/15 |
静注 |
自家骨髄間葉系幹細胞 |
1×106/3×106 |
6週以内 |
安全性に問題なし.
mRSやNIHSSに差はないが,NIHSS motor scoreやFugl-Meyer motor score等に差あり. |
略語:mRS, modified Rankin Scale; NIHSS, National Institute of the Health Stroke Scale; SSS, Scandinavia Stroke Scale.
3.本邦で進行中の脳梗塞に対する幹細胞治療(表 2)
条件付き早期承認制度も手伝い,本邦は世界有数の再生医療先進国となりつつある.現在でも,筆者が知る限り5つの幹細胞治療の治験/臨床試験が進行中である(表2).アテローム血栓性梗塞を対象とした札幌医科大学の自家骨髄間葉系幹細胞による治験,北海道大学で行われている,発症後74日以内に自家骨髄間質細胞を脳内に局所投与するRAINBBOW研究,Healios社の他家間葉系幹細胞MultiStemを発症後18~36時間に静注する多施設共同治験,帝人株式会社/JCRの歯髄幹細胞JTR-161を発症後48時間以内に静注する多施設共同治験,そして我々東北大学が行っている,生命科学インスティテュート社の他家Muse細胞製品CL2020を発症後14~28日に静脈内投与する治験である.これらの研究の結果が明らかになり,細胞治療が発展することを期待したい.
表2
本邦で進行中の脳梗塞に対する幹細胞治療治験
| フェーズ |
製品名 |
使用細胞 |
投与経路 |
治療時期 |
デザイン |
実施施設 |
| 3 |
STR01 |
自家骨髄間葉系幹細胞 |
静注 |
74日以内 |
プラセボ対照二重盲検ランダム化 |
札幌医科大学 |
| 1 |
HUNS001-01 |
自家骨髄間質細胞 |
脳内 |
74日以内 |
オープンラベル,用量対照 |
北海道大学 |
| 2 |
CL2020 |
他家Muse細胞製品 |
静注 |
14~28日 |
プラセボ対照二重盲検ランダム化 |
東北大学 |
| 2/3 |
Multistem/HLCM051 |
他家間葉系幹細胞 |
静注 |
18~36時間 |
プラセボ対照二重盲検ランダム化 |
多施設 |
| 1/2 |
JTR-161 |
他家歯髄幹細胞 |
静注 |
48時間以内 |
プラセボ対照二重盲検ランダム化 |
多施設 |
4.Muse細胞の特徴
幹細胞治療には様々な細胞が用いられている.骨髄単核球細胞,骨髄間質細胞,間葉系幹細胞,歯髄幹細胞,脂肪幹細胞,臍帯血幹細胞,神経幹細胞,胚性幹(embryonic stem: ES)細胞,人工多能性幹細胞(induced pluripotent stem: iPS)細胞,iSC(ischemia-induced multipotent stem cell)17),Muse(multilineage-differentiating stress enduring)細胞18, 19),など,枚挙に遑がない.各々には特徴があるため,治療しようとする疾患やその時期に合わせて有利な細胞を選択すればよいと考えられる.我々の研究グループではMuse細胞を用いた脳梗塞治療の研究に取り組んできた.
Muse細胞は,骨髄から末梢血に動員され,あらゆる臓器の結合組織に分布し,様々な組織に分化する新たな多能性幹細胞である18, 19).糖鎖であるSSEA (stage specific embryonic antigen)-3を表面抗原として分離回収できる18–20).Muse細胞は浮遊培養下で自己複製能を持ち,ES細胞の胚葉体と類似したクラスターを形成し,それらはOct3/4(octamer-binding transcription factor 3/4),Sox2(sex determining region Y-box 2),Nanog(homeobox protein NANOG)などの多能性幹細胞マーカーを発現している18).また,それらのクラスターを接着培養すると,分化誘導することなく外胚葉系,中胚葉系,内胚葉系のいずれの細胞にも分化する多能性を有する18).さらに,Muse細胞は腫瘍形成の可能性が低い間葉系幹細胞中に存在しているため,Muse細胞自体も腫瘍形成の可能性が低い細胞であることが示唆される20).
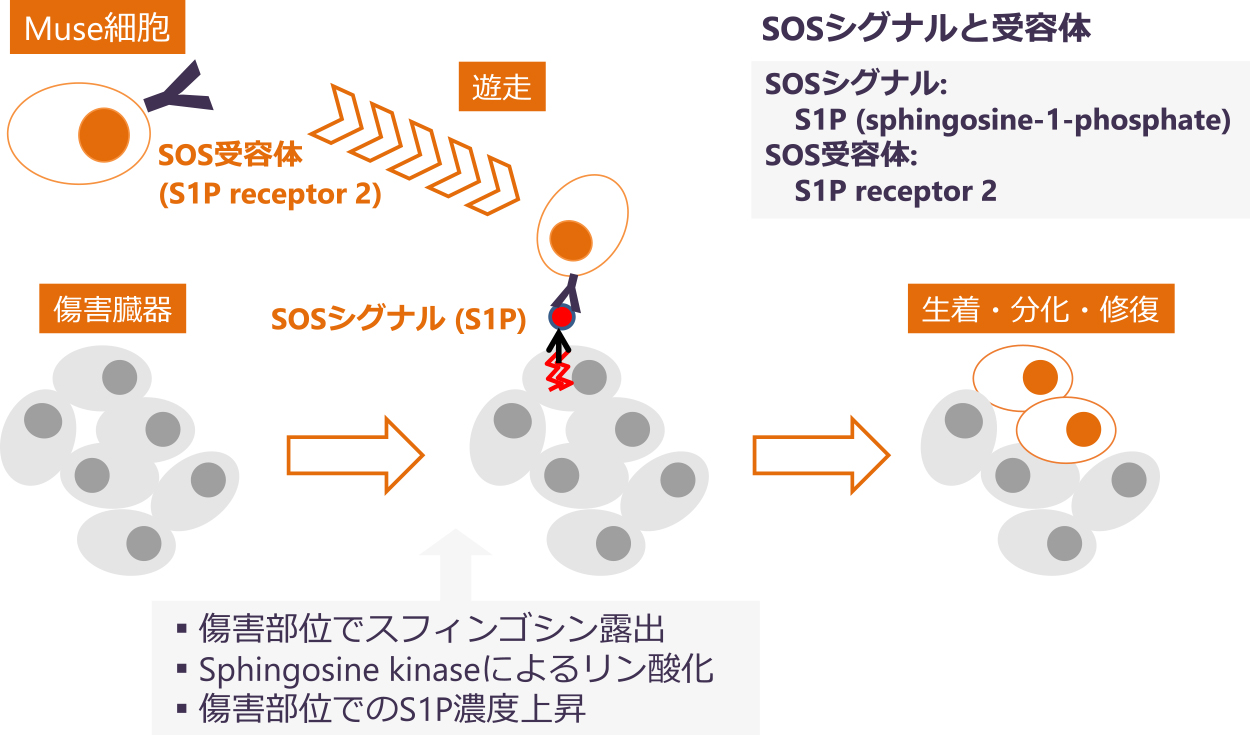
Muse細胞を治療に用いる際には目的とする細胞に分化誘導する必要がなく,そのまま静脈内に投与するだけで傷害部位に遊走,集積し,その場に必要とされる細胞に自発的に分化することで,組織を修復するという特徴を有する.S1P(Sphingosine-1-Phosphate;スフィンゴシン1リン酸)―S1P受容体2(S1PR2)を介したメカニズムによりMuse細胞は傷害組織に到達することが明らかになった21–23).細胞が損傷を受けると,細胞膜の構成要素として存在するスフィンゴシンが細胞質に存在する酵素と反応することによってS1Pが生成され,それが急性期の炎症やダメージのシグナルとなる.Muse細胞はS1PR2を有しているため,S1Pが豊富な組織を認識して遊走する23)(図1).さらに,遊走したMuse細胞は自発的に様々な細胞への分化を示す22–34)(図1).例えば脳梗塞24–26)や新生児低酸素性虚血性脳症27)では神経細胞や乏突起膠細胞に分化し,心筋梗塞では心筋細胞22, 23),表皮水疱症では角化細胞,毛包細胞,血管内皮細胞,皮脂腺細胞などの皮膚構成要素に分化した28).肝障害では肝細胞,胆管細胞,類洞細胞29, 30),腎不全では蛸足細胞,メサンギウム細胞や内皮細胞などの糸球体を構成する細胞31),大動脈瘤では血管内皮細胞と平滑筋細胞32),脊髄損傷では神経細胞33),筋萎縮性側索硬化症では星状膠細胞34)などへの分化が確認され,Muse細胞,あるいはMuse細胞製品CL2020が傷害に応じて必要な細胞に分化することが報告されている.このように高い安全性と多能性を有し,傷害組織に遊走し修復するMuse細胞は,有力な細胞治療のソースと考えられる.
5.Muse細胞による脳梗塞治療
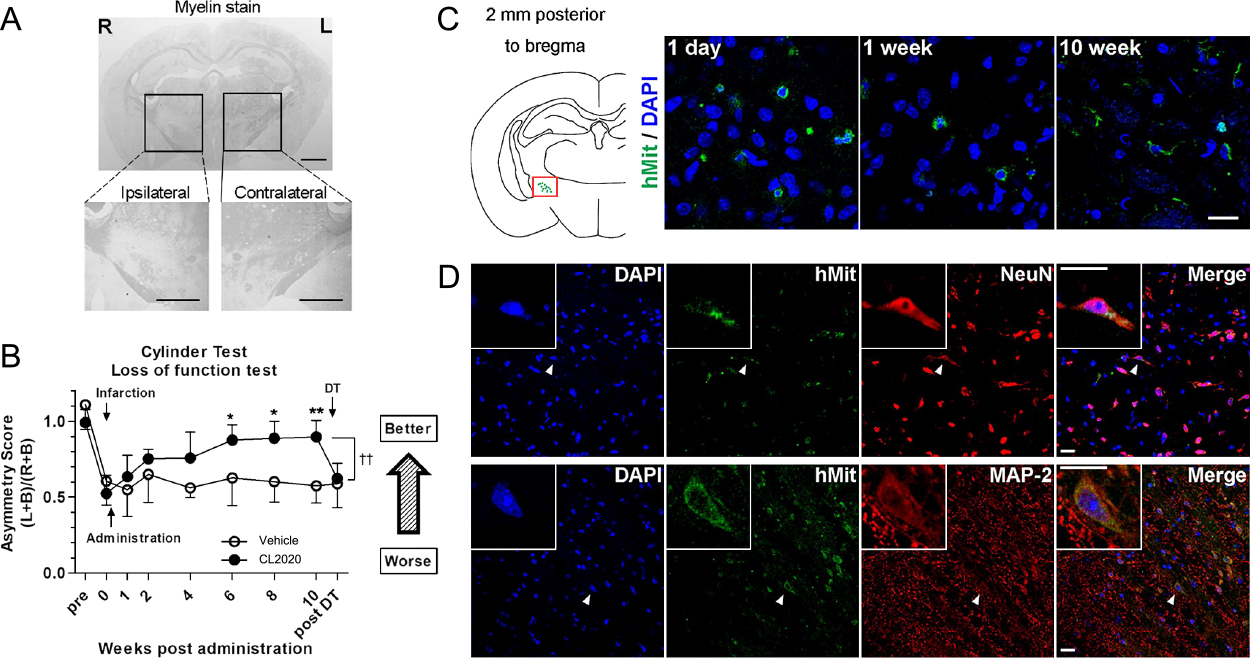
我々は,最も汎用されるラット中大脳動脈閉塞/再開通モデルの急性期にMuse細胞を局所投与するところから実験を開始した.Muse細胞は投与後84日の段階で生着しており,神経細胞および乏突起膠細胞に分化することにより神経回路網を再建し,運動および感覚機能を改善した24).さらにマウスラクナ梗塞モデルに対して亜急性期にMuse細胞を局所投与することにより運動機能が回復すること,移植されたMuse細胞から軸索が伸長し,反対側の頸髄にまで到達しうることも報告した25).この段階で,図1に示したように,Muse細胞がS1P-S1PR2の機構を用いて傷害部位に遊走することも明らになっていたため,静脈内投与を優先する方針に転換した.臨床を見据えたMuse細胞製品CL2020が開発されたことも受け,さらにマウスラクナ梗塞モデル(図2A)の亜急性期ならびに慢性期にCL2020を投与した.CL2020投与により,脳梗塞により悪化していた運動機能が有意に改善し(図2B),ジフテリア毒素を用いてマウスに移植されたヒト由来細胞を選択的に排除すると,運動機能が再度増悪した(図2B).CL2020は梗塞巣周囲に生着し神経細胞に分化していた(図2C,D).これらにより,CL2020は神経回路に組み込まれ,運動機能を改善することが示唆された.
前臨床試験を経て,2018年に我々は亜急性期脳梗塞を対象とした二重盲検プラセボ対照の第二相治験を開始した(JapicCTI-184103,脳梗塞患者を対象としたCL2020の臨床試験).本稿執筆時点では治験継続中である.
6.他臓器のMuse細胞による治験
Muse細胞は脳梗塞のみならず,様々な臓器での臨床応用も進んでいる.2021年3月の段階で,心筋梗塞,表皮水疱症,脊髄損傷,新生児低酸素性虚血性脳症,筋萎縮性側索硬化症に対する治験が行われている.脳梗塞のみならず,様々な疾患に対する新規治療法として確立することを期待したい.
7.結語
脳梗塞に対する幹細胞治療の現状を概説後に,Muse細胞の特徴を説明し,さらには我々のMuseを用いた神経再生医療に対する取り組みを述べた.Muse細胞は安全性と有効性を両立する有力な細胞ソースであり,既存の治療とは一線を画するような大きな治療効果も期待される.幹細胞治療は未だ発展途上であるが,今後様々な細胞による治療が実用化し,脳梗塞患者に福音がもたらされることを心より期待する.
著者全員の利益相反(COI)の開示:
新妻邦泰:臨床研究(治験)(生命科学インスティテュート),研究費(共同研究,寄付金等)(生命科学インスティテュート)
冨永悌二:研究費(共同研究,寄付金等)(生命科学インスティテュート)
文献
- 1) Ramón y Cajal S: Degeneration and regeneration of the nervous system (Translated by RM Day from the 1913 Spanish edition). Oxford: Oxford University Press, 1928.
- 2) Jin K, Minami M, Lan JQ, Mao XO, Batteur S, Simon RP, Greenberg DA: Neurogenesis in dentate subgranular zone and rostral subventricular zone after focal cerebral ischemia in the rat. Proc Natl Acad Sci U S A 98: 4710–4715, 2001.
- 3) Jin K, Wang X, Xie L, Mao XO, Zhu W, Wang Y, Shen J, Mao Y, Banwait S, Greenberg DA: Evidence for stroke-induced neurogenesis in the human brain. Proc Natl Acad Sci U S A 103: 13198–13202, 2006.
- 4) Bang OY, Kim EH, Cha JM, Moon GJ: Adult stem cell therapy for stroke: Challenges and progress. J Stroke 18: 256–266, 2016.
- 5) Marei HE, Hasan A, Rizzi R, Althani A, Afifi N, Cenciarelli C, Caceci T, Shuaib A: Potential of stem cell-based therapy for ischemic stroke. Front Neurol 9: 34, 2018.
- 6) Janowski M, Wagner DC, Boltze J: Stem cell-based tissue replacement after stroke: Factual necessity or notorious fiction? Stroke 46: 2354–2363, 2015.
- 7) Kondziolka D, Steinberg GK, Wechsler L, Meltzer CC, Elder E, Gebel J, Decesare S, Jovin T, Zafonte R, Lebowitz J, Flickinger JC, Tong D, Marks MP, Jamieson C, Luu D, Bell-Stephens T, Teraoka J: Neurotransplantation for patients with subcortical motor stroke: A phase 2 randomized trial. J Neurosurg 103: 38–45, 2005.
- 8) Savitz SI, Dinsmore J, Wu J, Henderson GV, Stieg P, Caplan LR: Neurotransplantation of fetal porcine cells in patients with basal ganglia infarcts: A preliminary safety and feasibility study. Cerebrovasc Dis 20: 101–107, 2005.
- 9) Bang OY, Lee JS, Lee PH, Lee G: Autologous mesenchymal stem cell transplantation in stroke patients. Ann Neurol 57: 874882, 2005.
- 10) Chen DC, Lin SZ, Fan JR, Lin CH, Lee W, Lin CC, Liu YJ, Tsai CH, Chen JC, Cho DY, Lee CC, Shyu WC: Intracerebral implantation of autologous peripheral blood stem cells in stroke patients: A randomized phase II study. Cell Transplant 23: 1599–1612, 2014.
- 11) Prasad K, Sharma A, Garg A, Mohanty S, Bhatnagar S, Johri S, Singh KK, Nair V, Sarkar RS, Gorthi SP, Hassan KM, Prabhakar S, Marwaha N, Khandelwal N, Misra UK, Kalita J, Nityanand S; InveST Study–Group: Intravenous autologous bone marrow mononuclear stem cell therapy for ischemic stroke: A multicentric, randomized trial. Stroke 45: 3618–3624, 2014.
- 12) Hess DC, Wechsler LR, Clark WM, Savitz SI, Ford GA, Chiu D, Yavagal DR, Uchino K, Liebeskind DS, Auchus AP, Sen S, Sila CA, Vest JD, Mays RW: Safety and efficacy of multipotent adult progenitor cells in acute ischaemic stroke (MASTERS): A randomised, double-blind, placebo-controlled, phase 2 trial. Lancet Neurol 16: 360–368, 2017.
- 13) Bhatia V, Gupta V, Khurana D, Sharma RR, Khandelwal N: Randomized assessment of the safety and efficacy of intra-arterial infusion of autologous stem cells in subacute ischemic stroke. AJNR Am J Neuroradiol 39: 899–904, 2018.
- 14) Savitz SI, Yavagal D, Rappard G, Likosky W, Rutledge N, Graffagnino C, Alderazi Y, Elder JA, Chen PR, Budzik RF Jr, Tarrel R, Huang DY, Hinson JM Jr: A phase 2 randomized, sham-controlled trial of internal carotid artery infusion of autologous bone marrow-derived ALD-401 cells in patients with recent stable ischemic stroke (RECOVER-Stroke). Circulation 139: 192–205, 2019.
- 15) Fang J, Guo Y, Tan S, Li Z, Xie H, Chen P, Wang K, He Z, He P, Ke Y, Jiang X, Chen Z: Autologous endothelial progenitor cells transplantation for acute ischemic stroke: A 4-year follow-up study. Stem Cells Transl Med 8: 14–21, 2019.
- 16) Jaillard A, Hommel M, Moisan A, Zeffiro TA, Favre-Wiki IM, Barbieux-Guillot M, Vadot W, Marcel S, Lamalle L, Grand S, Detante O; (for the ISIS-HERMES Study Group): Autologous mesenchymal stem cells improve motor recovery in subacute ischemic stroke: A randomized clinical trial. Transl Stroke Res 11: 910–923, 2020.
- 17) Tatebayashi K, Tanaka Y, Nakano-Doi A, Sakuma R, Kamachi S, Shirakawa M, Uchida K, Kageyama H, Takagi T, Yoshimura S, Matsuyama T, Nakagomi T: Identification of multipotent stem cells in human brain tissue following stroke. Stem Cells Dev 26: 787–797, 2017.
- 18) Kuroda Y, Kitada M, Wakao S, Nishikawa K, Tanimura Y, Makinoshima H, Goda M, Akashi H, Inutsuka A, Niwa A, Shigemoto T, Nabeshima Y, Nakahata T, Nabeshima Y, Fujiyoshi Y, Dezawa M: Unique multipotent cells in adult human mesenchymal cell populations. Proc Natl Acad Sci U S A 107: 8639–8643, 2010.
- 19) Kuroda Y, Wakao S, Kitada M, Murakami T, Nojima M, Dezawa M: Isolation, culture and evaluation of multilineage-differentiating stress-enduring (muse) cells. Nat Protoc 8: 1391–1415, 2013.
- 20) Wakao S, Kitada M, Kuroda Y, Shigemoto T, Matsuse D, Akashi H, Tanimura Y, Tsuchiyama K, Kikuchi T, Goda M, Nakahata T, Fujiyoshi Y, Dezawa M: Multilineage-differentiating stress-enduring (muse) cells are a primary source of induced pluripotent stem cells in human fibroblasts. Proc Natl Acad Sci U S A 108: 9875–9880, 2011.
- 21) Hori E, Hayakawa Y, Hayashi T, Hori S, Okamoto S, Shibata T, Kubo M, Horie Y, Sasahara M, Kuroda S: Mobilization of pluripotent multilineage-differentiating stress-enduring cells in ischemic stroke. J Stroke Cerebrovasc Dis 25: 1473–1481, 2016.
- 22) Tanaka T, Nishigaki K, Minatoguchi S, Nawa T, Yamada Y, Kanamori H, Mikami A, Ushikoshi H, Kawasaki M, Dezawa M, Minatoguchi S: Mobilized muse cells after acute myocardial infarction predict cardiac function and remodeling in the chronic phase. Circ J 82: 561–571, 2018.
- 23) Yamada Y, Wakao S, Kushida Y, Minatoguchi S, Mikami A, Higashi K, Baba S, Shigemoto T, Kuroda Y, Kanamori H, Amin M, Kawasaki M, Nishigaki K, Taoka M, Isobe T, Muramatsu C, Dezawa M, Minatoguchi S: S1P-S1PR2 axis mediates homing of muse cells into damaged heart for long-lasting tissue repair and functional recovery after acute myocardial infarction. Circ Res 122: 1069–1083, 2018.
- 24) Uchida H, Morita T, Niizuma K, Kushida Y, Kuroda Y, Wakao S, Sakata H, Matsuzaka Y, Mushiake H, Tominaga T, Borlongan CV, Dezawa M: Transplantation of unique subpopulation of fibroblasts, muse cells, ameliorates experimental stroke possibly via robust neuronal differentiation. Stem Cells 34: 160–173, 2016.
- 25) Uchida H, Niizuma K, Kushida Y, Wakao S, Tominaga T, Borlongan CV, Dezawa M: Human muse cells reconstruct neuronal circuitry in subacute lacunar stroke model. Stroke 48: 428–435, 2017.
- 26) Abe T, Aburakawa D, Niizuma K, Iwabuchi N, Kajitani T, Wakao S, Kushida Y, Dezawa M, Borlongan CV, Tominaga T: intravenously transplanted human multilineage-differentiating stress-enduring cells afford brain repair in a mouse lacunar stroke model. Stroke 51: 601–611, 2020.
- 27) Suzuki T, Sato Y, Kushida Y, Tsuji M, Wakao S, Ueda K, Imai K, Iitani Y, Shimizu S, Hida H, Temma T, Saito S, Iida H, Mizuno M, Takahashi Y, Dezawa M, Borlongan CV, Hayakawa M: Intravenously delivered multilineage-differentiating stress enduring cells dampen excessive glutamate metabolism and microglial activation in experimental perinatal hypoxic ischemic encephalopathy. J Cereb Blood Flow Metab, 2020 [Online ahead of print], doi: 10.1177/0271678X20972656.
- 28) Fujita Y, Komatsu M, Lee SE, Kushida Y, Nakayama-Nishimura C, Matsumura W, Takashima S, Shinkuma S, Nomura T, Masutomi N, Kawamura M, Dezawa M, Shimizu H: Intravenous injection of muse cells as a potential therapeutic approach for epidermolysis bullosa. J Invest Dermatol 141: 198–202.e6, 2021.
- 29) Katagiri H, Kushida Y, Nojima M, Kuroda Y, Wakao S, Ishida K, Endo F, Kume K, Takahara T, Nitta H, Tsuda H, Dezawa M, Nishizuka S: A distinct subpopulation of bone marrow mesenchymal stem cells, muse cells, directly commit to the replacement of liver components. Am J Transplant 16: 468–483, 2016.
- 30) Iseki M, Kushida Y, Wakao S, Akimoto T, Mizuma M, Motoi F, Asada R, Shimizu S, Unno M, Chazenbalk G, Dezawa M: Muse cells, nontumorigenic pluripotent-like stem cells, have liver regeneration capacity through specific homing and cell replacement in a mouse model of liver fibrosis. Cell Transplant 26: 821–840, 2017.
- 31) Uchida N, Kushida Y, Kitada M, Wakao S, Kumagai N, Kuroda Y, Kondo Y, Hirohara Y, Kure S, Chazenbalk G, Dezawa M: Beneficial effects of systemically administered human muse cells in adriamycin nephropathy. J Am Soc Nephrol 28: 2946–2960, 2017.
- 32) Hosoyama K, Wakao S, Kushida Y, Ogura F, Maeda K, Adachi O, Kawamoto S, Dezawa M, Saiki Y: Intravenously injected human multilineage-differentiating stress-enduring cells selectively engraft into mouse aortic aneurysms and attenuate dilatation by differentiating into multiple cell types. J Thorac Cardiovasc Surg 155: 2301–2313.e4, 2018.
- 33) Kajitani T, Endo T, Iwabuchi N, Inoue T, Takahashi Y, Abe T, Niizuma K, Tominaga T: Association of intravenous administration of human Muse cells with deficit amelioration in a rat model of spinal cord injury. J Neurosurg Spine 1: 1–8, 2021.
- 34) Yamashita T, Kushida Y, Wakao S, Tadokoro K, Nomura E, Omote Y, Takemoto M, Hishikawa N, Ohta Y, Dezawa M, Abe K: Therapeutic benefit of Muse cells in a mouse model of amyotrophic lateral sclerosis. Sci Rep 10: 17102, 2020.