2015 年 34 巻 2 号 p. 139-151
2015 年 34 巻 2 号 p. 139-151
細胞移植による難治疾患治療は、患者にとって実現が切望されるものである。特に、パーキンソン病は、その病因から、完治には細胞移植以外は困難といわれている。そのような背景から、組織または細胞移植によるパーキンソン病の治療に関する研究が盛んに行われてきた。その結果、細胞を移植するだけでは、生着率が極めて低いことと、たとえ生着しても挫滅した組織は移植細胞を制御できるだけの能力を有していないという問題から、病態の劇的な改善には至らないことがわかってきた。そこで我々は、「生存率向上」と「in situでの細胞精密制御」の両方を達成できる生理活性バイオマテリアルの創製を着想した。開発した材料は、生存率向上およびin situでの細胞精密制御の両方を達成できる機能を有するコラーゲンハイドロゲルである。本稿では、各機能について解説し、本ハイドロゲルを用いた細胞移植によるパーキンソン病の治療への可能性について述べる。
細胞を用いた医療の実現は、近い将来、実現すると断言できる段階に差し掛かっている。その一番の理由は、やはり、ヒト人工多能性幹細胞(hiPSC)1)の樹立に他ならない。hiPSCは実用化に向けて様々な研究が進められ、種々の課題が次々と克服されていることから、細胞ソースの確保という問題は、解決する見込みが立っているといっても過言ではない。しかしながら、細胞移植による疾患治療は、細胞源確保の問題を解決するだけでは実現しない。いかに細胞を生着させるか、挫滅した組織で移植細胞を精密に制御し再生の足掛かりをどのように形成させるか、さらには、どのようにしてホスト組織と統合させるか等、様々なハードルが存在する2,3,4)。
特に、難治疾患の治療・根治において、細胞移植医療は最後の望みといわれるものであろう。中でも、細胞移植以外では根治が不可能とまでいわれているのが、パーキンソン病である。パーキンソン病は、中脳黒質に存在するドーパミン神経が変性・脱落することによって発症する難治疾患である。変性・脱落による“消失”が病因であるが故に、細胞移植により補充する以外に完治の方法は無いと考えられている。京都大学CiRAの高橋淳教授がパーキンソン病の治療に向けたhiPSC由来の神経前駆細胞の移植の臨床治験開始を公表したのは、記憶に新しい。彼らは、これまでに、パーキンソン病を発症したマウス・ラット・サルへの胚性幹細胞(ESC)またはhiPSC由来のドーパミン神経、あるいは、神経前駆細胞の移植によるパーキンソン病態の改善に関して多くの研究成果を挙げている5,6,7)。しかしながら、病態の明確な改善が認められるものの、完治・根治までには至っておらず、完全に治癒させるためには、さらなるブレイクスルーが必要であると考えられる。
そこで、細胞を移植直後から保護し、生着を促し、さらに、生着細胞を制御して再生に向かわせるという一連の補助を行えるシステムを構築できれば、挫滅し機能を失ったホストを再生できるのではないかと発想した。すなわち、細胞だけではなく、再生を担う「材料」との共移植により、移植細胞を起点とした組織再構築が可能ではないかと考えた。このような背景から開発したのが、本稿で紹介する、細胞移植用ハイドロゲルシステムである(図1)。

パーキンソン病治療のための細胞移植医療のストラテジーと課題および移植細胞補助ハイドロゲルの設計コンセプト。
(T. Nakaji-Hirabayashi8)より許諾を得て改変)
移植細胞を保護する材料の開発は、後述するパーキンソン病治療のための細胞移植で用いるハイドロゲル以外にも、数多く研究・開発が進められている。例えば、Ⅰ型糖尿病の膵島移植による治療では、膵島細胞の生着率が非常に悪いことから、アガロース8)やアルギン酸9)によるカプセル化やPEG脂質による薄層被覆10)などによる膵島細胞保護により、生着率を向上させる研究が進められている。また、重症下肢虚血において、ハイドロゲルと血管新生の基となる細胞を移植し、細胞を生着させ、血管を再生するという研究、実用化に向けた取組みもなされている11)。その他には、ゼラチンハイドロゲルの中に包埋した幹細胞を皮下に移植することによって、機能不全の肝臓の代替として機能させるという研究12)や、ドーパミン産生細胞をハイドロゲルに包埋し移植することでドーパミン産生を行わせるという研究13)も行われている。これらすべてにおいて、材料を用いて細胞を保護し、目的通りに機能させるという共通した考えの基に設計されている。
さて、我々が開発した移植細胞を保護し制御するシステムは、様々な機能を有するデバイスであるが、本稿では、2014年に日本組織培養学会奨励賞を頂いた際の受賞理由となった、3つのシステムについて述べる。各システムを紹介する前に、本材料の最大の特徴を記す。本材料は、複数の機能ドメインを一つに融合したキメラタンパク質を用いた材料設計(図2)を基本としており、これによって、ハイドロゲルに包埋された細胞のみに継続的にシグナルを与えたり、後述するタンパク質を選択的に徐放させるシステムを構築することができる。

キメラタンパク質を応用した生理活性バイオマテリアルの設計コンセプト。二次元基板や三次元ハイドロゲルへのタンパク質の担持により、局所で安定的に細胞へシグナルを与えることができる。
(T. Nakaji-Hirabayashi15)より許諾を得て改変)
まず1つ目の機能が、ベースハイドロゲルであるアテロコラーゲンに神経系細胞接着性を付与するために、ラミニン由来の細胞接着性ドメインとアテロコラーゲンに特異的に結合するペプチドドメインを融合した「神経細胞接着性キメラタンパク質」である14)。これをハイドロゲルに担持することで、細胞生存率の大幅な向上が可能であることを見出した15)。また2つ目の機能として、移植細胞が初期免疫応答によりほとんど死滅するという点を回避するべく、炎症反応が惹起されたときにのみ、ハイドロゲルから抗炎症性サイトカイン(インターロイキン10、IL10)が徐放されるシステムを構築し、移植細胞の生着率を向上させることができることを見出した16)。さらに、神経前駆細胞が必要としたときにのみ神経栄養因子が放出される「タンパク質精密徐放微粒子」を構築し、この微粒子によりin vivo/in situ分化誘導制御を行うことができることを示した17)。それぞれの機能について、項目立てて紹介し、パーキンソン病治療のための細胞移植治療に有効な医用材料であることを示す。
神経系細胞接着性キメラタンパク質担持コラーゲンハイドロゲルの開発細胞移植において、生着率を向上させるために考えなければならないことは、(1)免疫応答・拒絶からの回避と、(2)細胞に接着足場を提供し、アノイキス細胞死を抑制するという2点である。そこで我々は、細胞を保護し、且つ、足場を与えることが可能な材料の開発を目指した。移植材料を設計する上でもう一つ大切なことは、移植時に、できる限り低侵襲であり、且つ、インジェクションによる簡便な細胞移植に適応する材料であることである。そこで、ベース材料として、抗原認識部位であるテロペプチドを除去したアテロコラーゲン18)(以後コラーゲンと呼称する)を用いることとした。これは、冷却状態では溶液状態(ゾル)であり、37oCでは、急速に固化(ゲル)することから、細胞を混合してインジェクションにより移植することが可能となる。
しかしながら、ここで問題となったのは、コラーゲンゲルが神経系細胞の接着足場として機能しなかったことであった(Data not shown)。それを改善するべく、我々は、神経系細胞の足場としてよく知られているラミニンの細胞接着ドメイン、α鎖G3ドメインと、γ鎖C末端のオリゴペプチド(アミノ酸配列:FNTPSIEKP)からなる、神経系細胞接着性キメラタンパク質を構築し、コラーゲンゲルに担持させることを着想するに至った14,15)。
まず、構築した神経細胞接着性キメラタンパク質担持コラーゲンゲル中での神経前駆細胞の挙動についてin vitro評価を行った。その結果、キメラタンパク質を担持させたコラーゲンゲル中では、神経前駆細胞が伸展しネットワーク様形態を示しており、ゲル内で接着していると示唆され、また、増殖も確認された。これに対し、ネイティブコラーゲンゲル(キメラタンパク質非担持)中では、細胞の伸展がほとんど見られず、接着している様子がうかがえないことに加え、Calcein-AM(生細胞の細胞質を緑色に染色する)陰性でありPropidium iodide(死細胞の細胞核を赤色に染色する)陽性の細胞が多数存在した(図3)。これらの結果から、本設計ゲルが、移植細胞の足場材料として有用であると示唆されたことから、in vivoによる細胞生着を促進する材料としての有効性を評価した。

(A)神経細胞接着性キメラタンパク質担持/非担持コラーゲンゲル中で7日間培養した神経前駆細胞の位相差顕微鏡および蛍光顕微鏡像。本評価は、細胞を観察しやすくするため、サンドイッチゲル培養を採用した。Green:生細胞の細胞質を染色、Red:死細胞の細胞核を染色。(B)各培養期間におけるコラーゲンゲル中の生存細胞数。○:神経細胞接着性キメラタンパク質担持コラーゲンゲル、●:ネイティブコラーゲンゲル。*p<0.05(Tukey’s HSD test)
(T. Nakaji-Hirabayashi et al.16)より許諾を得て改変)
パーキンソン病治療を目指した細胞移植において、これまでに、胎児由来の線条体組織をパーキンソン病を発症した脳に移植することで、病態の改善が認められている19)。しかしながら、パーキンソン病態を改善させるためには、相当数の胎児(約5~6胎児)を必要とすることがわかり、現実的ではないと判断された。そのような経緯から、ドーパミン神経の移植が提案されたが20)、ドーパミン神経をはじめとする成熟神経は一様に、極めて脆弱であり、in vitroで誘導した成熟神経をトリプシン処理により回収するだけで死滅してしまうことや、回収できたとしてもインジェクションによるダメージや、移植後の免疫応答などによりほとんど生着しないという問題があった。現在では、胚様体で成熟神経へ誘導した細胞凝集体の移植5,6)や、単個細胞での神経前駆細胞の移植21)などが考えられているが、依然として生着率が極めて低い(5%以下)ことが問題として残っている2)。
そこで、前述した神経系細胞接着性キメラタンパク質担持コラーゲンゲルを用いた、ラット線条体への細胞移植とその生着率の向上について評価した。移植細胞の生着評価には、緑色蛍光タンパク質(EGFP)を恒常発現する神経幹前駆細胞を用いており、これにより、移植細胞を可視化でき、且つ、EGFPのmRNA発現量から生存細胞数を定量できる実験系を構築した。図4に、移植3、7、および15日の細胞移植部位周辺組織の免疫染色像を示す。細胞接着性キメラタンパク質担持コラーゲンゲルと共に移植した細胞は、観察期間を通して確認(移植生細胞は緑色蛍光に呈色)できたが、ネイティブコラーゲンと共に移植した場合では、3日後でほとんどの細胞が死滅し、7日後ではわずかに生着した細胞が増殖したためか若干量の細胞が認められたものの、15日後では、再び移植部位周辺で緑色蛍光を確認することができず、ほぼ死滅したと考えられる。このことから、移植細胞が、神経細胞接着性キメラタンパク質担持コラーゲンゲルを足場として生着できていると示唆される。
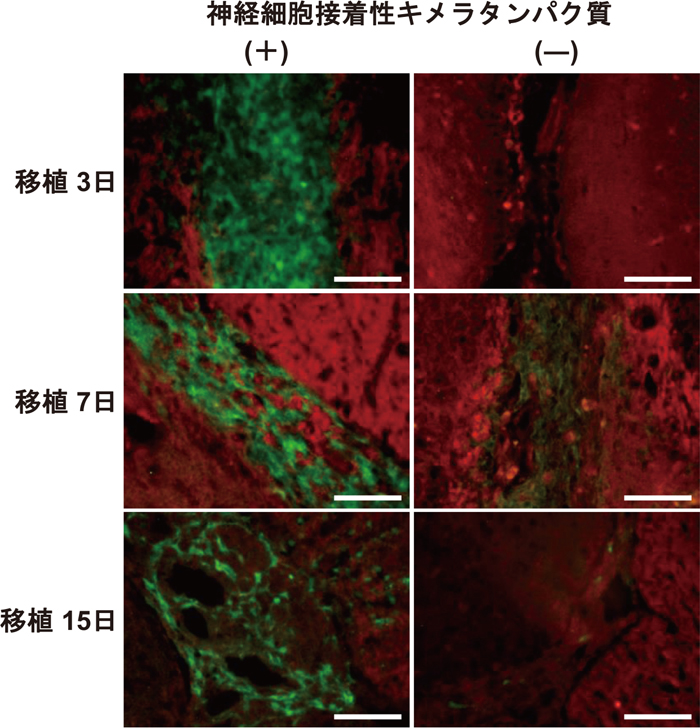
EGFP恒常発現神経幹前駆細胞を移植したラット線条体周辺の組織染色像。Green:移植細胞、Red:ホスト組織由来のミクログリア。Scale bars: 50 μm。
(T. Nakaji-Hirabayashi et al.17)より許諾を得て改変)
移植細胞の初期生着率を定量的に評価したところ、図5に示す通り、細胞のみでの移植では、移植直後でさえ生存率が50%を下回っており、3日後の生着率は5%弱となった。また、コラーゲンゲル(キメラタンパク質非担持)を用いた場合、移植直後の細胞生存率は高いが、3日後で、細胞のみの移植と同様、約5%まで生存率が低下した。それに対し、神経細胞接着性キメラタンパク質担持コラーゲンゲルでは、移植3日において40%弱の生存率を示し、さらに移植7日では細胞が増殖していることから、完全に生着していると判断された。移植直後におけるコラーゲンゲルの有無による生存細胞数の差異は、コラーゲンによる物理的なバリアの効果であり、極初期における細胞保護が実現できていると推察できる。また、キメラタンパク質担持/非担持での生着細胞数の差異は、コラーゲンゲルが接着足場として機能するか否かによるアノイキス依存細胞死の惹起の有無に伴う差異であると考えられる。以上のことから、開発したコラーゲンゲルを用いることにより、移植細胞生着率の大幅な向上が可能であると強く示唆される。

移植後3時間、3および7日後の移植神経幹前駆細胞の生着細胞数。Gray bar:細胞のみの移植、White bar:細胞とネイティブコラーゲンゲルの移植、Black bar:細胞と神経細胞接着性キメラタンパク質担持コラーゲンゲルの移植。*p<0.05、‡p<0.01(Tukey’s HSD test)
(T. Nakaji-Hirabayashi et al.17)より許諾を得て改変)
前項で、移植細胞の生着率を大幅に向上できることを示した。このハイドロゲルの使用は、細胞への足場の提供と、細胞の炎症細胞等からの物理的な隔離の2つの効果が期待できると考えられる。しかしながら、移植後初期では、炎症細胞が浸潤してくるだけではなく、炎症細胞から産生される炎症性サイトカインによる攻撃もあるため、生着率が低下してしまうことは容易に想像できる22,23)。そこで、炎症・免疫拒絶を局所(移植部位のみ)で鎮静化させることができれば、免疫抑制剤の全身投与という大きなリスクを患者に負わせることなく、生着率のさらなる向上を見込めるのではないかと考え、抗炎症性サイトカイン選択放出システムの開発16)を目指した。
このシステムの最大の特徴は、ハイドロゲルへの、抗炎症性サイトカイン、インターロイキン10(IL10)のキメラタンパク質の担持である。これは、移植部位以外の必要な生体防御反応に対して作用させないためである。しかしながら、ハイドロゲルに単に担持させるだけでは、炎症細胞の浸潤時以外にはIL10 を作用させることができず、移植細胞は、炎症性サイトカインによる攻撃が避けられない。そこで、このIL10 キメラタンパク質に、炎症反応が惹起されたときにのみゲルから遊離し、移植部位に浸潤してこようとする炎症細胞に作用する仕組み(選択徐放)を導入した。具体的には、IL10 のC末端とコラーゲン結合ペプチドの間に、脳内の炎症反応を司るミクログリアが活性化されたときに大量に産生するマトリックスメタロプロテアーゼ9で切断される配列(GPPG↓VVGEQPP)を導入している(図6)。
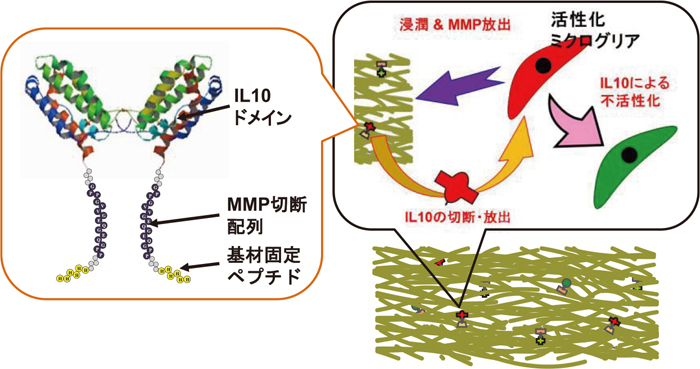
抗炎症性サイトカイン(IL10)キメラタンパク質担持コラーゲンゲルのIL10 選択徐放システムの概略図。
(T. Nakaji-Hirabayashi et al.15)より許諾を得て改変)
このIL10 キメラタンパク質を担持させたコラーゲンゲル(神経系細胞接着性キメラタンパク質も共担持)に埋入した神経幹前駆細胞と活性化ミクログリアを共培養し、神経幹前駆細胞の生存率を評価した(図7)。その結果、IL10 キメラタンパク質を担持していないコラーゲンゲル中の細胞は、約3分の2が死滅するのに対し、IL10 キメラタンパク質を担持させた場合には、生存率がほぼ維持されることがわかった。さらにIL10 キメラタンパク質担持/非担持における、培養液中の炎症性サイトカイン、IL1β・IL6・TNFαの産生量について調査した結果(図8)、IL10 キメラタンパク質の存在により、その産生量が大幅に減少していることがわかった。これらの結果から、IL10 キメラタンパク質担持コラーゲンゲルは、局所で炎症を抑制でき、移植初期の生着率のさらなる向上が見込めることから、移植実験による生着率の評価を実施した。
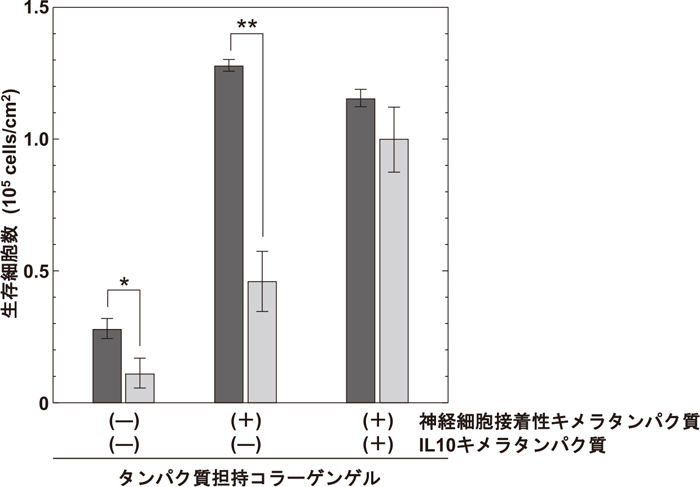
不活性化(dark gray bar)および活性化(light gray bar)ミクログリア共存下で、2日間コラーゲンゲル中で培養した神経前駆細胞の生存細胞数。*p<0.05、**p<0.01(Tukey’s HSD test)
(T. Nakaji-Hirabayashi et al.18)より許諾を得て改変)
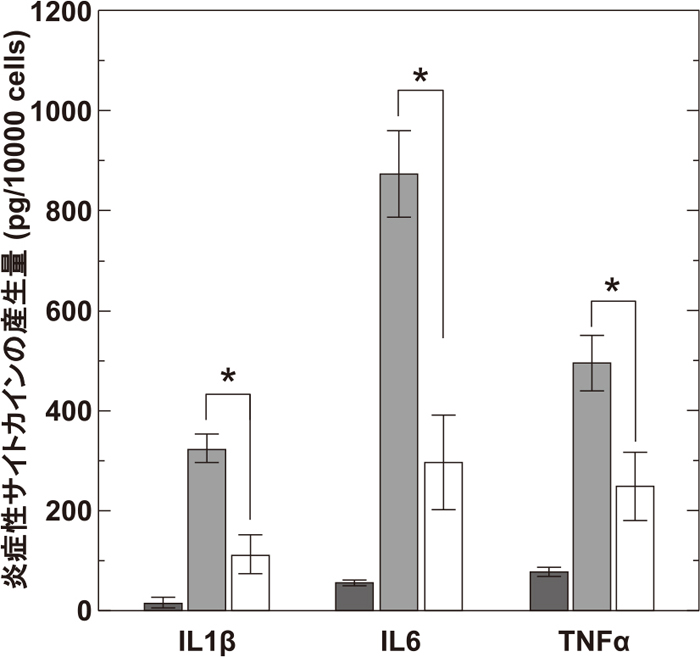
不活性化(dark gray bar)および活性化(light gray bar)ミクログリア、また、神経前駆細胞を埋入させたIL10 キメラタンパク質担持コラーゲンゲルと共培養された活性化ミクログリア(white bar)から産生された炎症性サイトカイン量。*p<0.05(Tukey’s HSD test)
(T. Nakaji-Hirabayashi et al.18)より許諾を得て改変)
移植細胞の生着率評価は、神経系細胞接着性キメラタンパク質担持コラーゲンゲルのin vivo評価と同様の手法により行った。その結果、細胞接着性キメラタンパク質とIL10 キメラタンパク質を共担持させたコラーゲンゲルを用いて移植した細胞の生着率は、IL10 キメラタンパク質を担持していないゲルの場合(39.1±3.3%)に対して、1.4倍増加した(55.2±3.8%)(図9)。しかしながら、期待したほど大幅な生着率の増加には至らなかった。さらなる改良を行って生着率向上を目指す必要があると考えられるが、現時点では、細胞のみの移植における生着率に比べ、10倍以上に向上させることができているという点では大きなブレイクスルーであると判断できる。生着率を向上させることは、移植細胞数の大幅な軽減に繋がり、高い有用性を持つだろう。
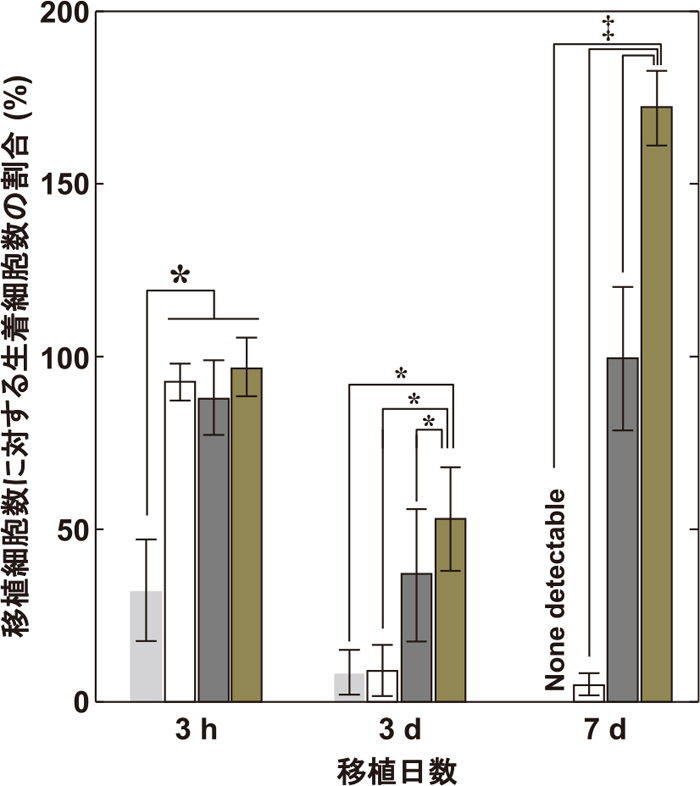
移植後3時間、3および7日後の移植神経幹前駆細胞の生着細胞数。Gray bar:細胞のみの移植、White bar:細胞とネイティブコラーゲンゲルの移植、Black bar:細胞と神経細胞接着性キメラタンパク質担持コラーゲンゲルの移植、Beige bar:細胞と神経細胞接着性キメラタンパク質およびIL10キメラタンパク質担持コラーゲンゲルの移植。*p 0.05、‡p<0.01(Tukey’s HSD test)
前述したように、移植神経幹前駆細胞の生着率の大幅な向上を達成できるインジェクタブルハイドロゲルの構築に成功した。そこで、次に、移植した細胞をin situでドーパミン神経に誘導できるシステムをハイドロゲルに付与しようと考えた。この背景には、前項で少し触れたが、細胞が脆弱であるがゆえに、成熟神経の移植は、移植時のダメージに耐えられず生着しないため、比較的強い神経幹前駆細胞をソースとして用いるのが適当であるという考え方に基づいている。
前項の図5に示したように、移植した神経幹前駆細胞は、移植7日目では増幅している。これは、移植細胞数と同等になっており、一見好都合に思われるが、違う見方をすれば、移植した細胞は分化の制御ができておらず、前駆細胞のまま増殖しているということができる。我々は、挫滅した組織では、移植細胞を制御するだけの能力は残っておらず、細胞を移植し生着させたところで神経網の再構築は起こらないと考えた。そこで、生着した細胞をドーパミン神経へ誘導するためのシステムをコラーゲンハイドロゲルに付与するという考えに至った。
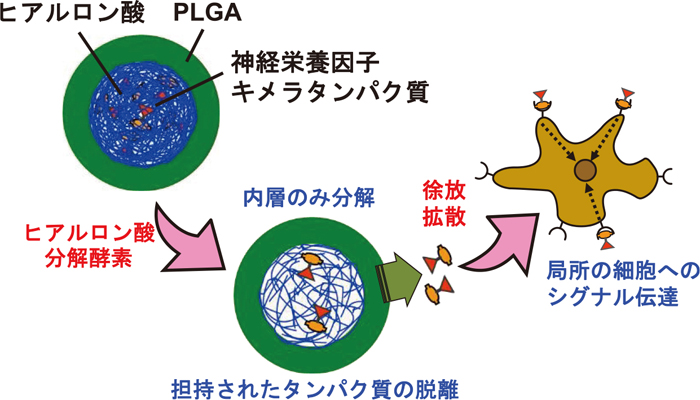
我々が構築したin situ分化制御システムは、神経前駆細胞からドーパミン神経に分化する際に、複数の因子が段階的に作用することにより効率的な分化を誘導できるという生物学的な知見に基づいて設計している。具体的には、図10に示すような、二層構造の高分子微粒子を開発した。これは、外層を月単位で分解する乳酸-グリコール酸共重合体、内層をヒアルロン酸として、その内層に、ドーパミン神経への誘導を担うことが知られている、グリア細胞由来神経栄養因子(GDNF)にヒアルロン酸結合ペプチド(HBP)を融合したキメラタンパク質(GDNF-HBP)を担持させた微粒子である。神経細胞は、ヒアルロン酸に結合するCD44 受容体を持っており、ヒアルロン酸を足場とすることが知られており、ヒアルロン酸分解酵素を産生することがわかっている。このことを利用して、未成熟神経存在下でのみ、微粒子の内層が分解されてGDNF-HBPが徐放されるシステムを設計した。このシステムは、2013年に我々のグループがJournal of Controlled Releaseに発表17)した、タンパク質選択徐放高分子微粒子を発展させたものである。
まずin vitroで、この微粒子を用いて、ハイドロゲル中の神経前駆細胞を成熟神経~ドーパミン神経に誘導できるかを調査した。その結果、微粒子を共存させたゲル中の細胞では、ドーパミン神経マーカーである、チロシンハイドロキシラーゼ(TH)の発現が認められた(図11)。また、細胞に対する微粒子量に応じてTHの発現量が極大を示すことから、細胞数に対する微粒子の最適量が存在することも明らかとなった。
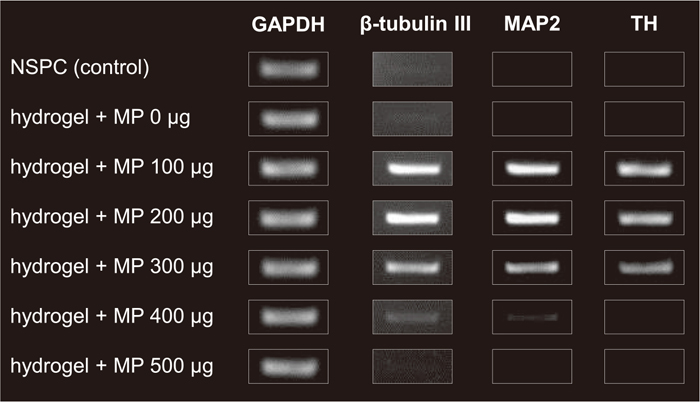
コラーゲンゲルに埋入した神経前駆細胞(5×106 cells/gel)をGDNF精密徐放微粒子を共存させ、2週間培養後、その細胞をRT-PCRにより各神経マーカー遺伝子の発現を評価したところ、微粒子と共存させた細胞のみで、中脳成熟神経マーカーであるMAP2 およびドーパミン神経マーカーであるTHの発現が認められた。また、共存微粒子量が多すぎる場合は、MAP2 およびTHの発現が認められなかった。これは、徐放されるGDNFが多すぎて、神経毒性が出たためと考えられる。
現在、これらの成果を踏まえて構築したハイドロゲルシステムと神経前駆細胞をパーキンソン病ラットへ共移植し、その病態改善について評価した結果をまとめた論文を投稿中であり、詳細を本稿で述べることはできないが、我々が設計したハイドロゲルシステムは、パーキンソン病治療のための細胞移植において、強力なツールになることが明らかになった。
当研究グループでは、高分子とキメラタンパク質を複合化することにより、細胞を精密に制御できるバイオマテリアルの設計に関して研究を進めている。その中で、最も成果が挙がっている、パーキンソン病治療のための移植細胞補助ハイドロゲルに関して、本稿で紹介した。本研究で開発した手法を用いれば、土台となる材料(基材)や制御させたい細胞に合わせてキメラタンパク質を自在に設計することによって、特定の生理活性を有する様々なバイオマテリアルを創製することができると期待される。生体内での制御が困難とされてきた移植細胞をできる限り精密に制御できる材料の創製を目指し、さらに研究を進めていきたいと考えている。
末尾ではありますが、若手の登竜門であり狭き門と言われる、日本組織培養学会奨励賞を頂けましたことは、執筆者にとって、さらに研究にまい進しようというモチベーションにつながっております。同学会関係の皆様、また、奨励賞に挑戦するに当たり、様々なアドバイスを下さった先生方、そして、本研究を進めるに当たり支えてくださった方々に深く感謝しております。この紙面を借りて厚く御礼申し上げます。