2016 Volume 58 Issue 2 Pages 58-64
2016 Volume 58 Issue 2 Pages 58-64
ヒトの歯根の発生において,Hertwig上皮鞘(Hertwig's Epithelial Root Sheath,以下HERS)は歯乳頭と歯小嚢の間を分断するように根尖方向に伸び,歯乳頭の細胞を分化させて象牙芽細胞を誘導する。さらにHERS細胞は,歯小嚢の間葉系細胞をセメント芽細胞に分化させ,このセメント芽細胞は断裂したHERSの隙間を通って歯根面上にセメント質を形成する。
HERSは,最終的に歯根膜中にMalassezの上皮遺残(Epithelial cell rests of Malassez,以下ERM)となるが1),一部はアポトーシスに至る1,2)。歯根膜中に残されたERMの働きは,(1)歯根膜腔の維持,(2)根吸収とアンキローシスの防止,(3)歯根膜の恒常性の維持,(4)無細胞セメント質の形成誘導など多岐にわたると考えられている3)。
近年,HERS細胞そのものが上皮間葉転換(Epithelial-Mesenchymal Transition,以下EMT)を起こしてセメント芽細胞に分化するという説が提唱されている。特にin vitroの実験系において,この説を支持する多くの報告が出されている。しかしセメント芽細胞に分化するHERS細胞は無いとする研究もあり,未だ結論が出ていない。
本レビューでは,歯の発生と歯周組織の再生において重要と考えられるHERSとERMの役割について,特にHERS細胞のEMTに着目し,これまでの基礎研究と我々が行った実験を紹介して将来を展望したい。
HERSがEMTを起こしてセメント芽細胞に分化することを支持する研究は,in vitroとin vivoで報告されている4-8)。最初の報告は,1996年にWebbら4)が,ラット臼歯の無細胞セメント質形成時のセメント芽細胞においてkeratinとvimentinの免疫組織化学的な共局在を示したものである。彼らは,これらがHERS由来であるとし,無細胞セメント質はHERS由来の細胞がつくる可能性があるとした4)。
Zeichner-Davidら5)は,不死化遺伝子の活性を調節できる遺伝子改変マウスの臼歯からHERS細胞を分離し,HERS由来のセルラインを作成した。これらの細胞は,当初ameloblastinなどのエナメル関連タンパクを分泌していたが,次第に形態を変えて無細胞セメント質の構造に似た石灰化を伴う細胞外基質を分泌するようになった。彼らはこの所見から,無細胞セメント質はHERS由来のセメント芽細胞から形成され,有細胞セメント質は神経堤由来のセメント芽細胞から形成されているという仮説を提唱した5)。
Sonoyamaら6)はヒトHERS細胞を不死化してセルラインとして確立し,in vitroにてその性質を調べた。その結果,HERS細胞は歯根膜幹細胞periodontal ligament stem cellを分化させて石灰化ノジュールを作らせることができた。またHERS細胞はエナメルタンパク,cytokeratin,vimentin,E-cadherinなど,セメント質・骨に関連するタンパクのマーカーを同時に発現した。さらにTGF-β1により処理したHERS細胞はPI3K/AKT経路を活性化してEMTを生じ,TGF-β1処理後のHERS細胞をマウス皮下に移植すると,セメント質様の石灰化物を認めることができた6)。
Huangら7)は,K14-Cre;R26Rマウスを用いた実験で,keratin14陽性のHERS細胞がβgal陽性となる仕組みを作って臼歯部におけるセメント質形成を調べた。その結果,根尖近くのセメント質中にβgal陽性細胞を多数認め,彼らはHERS細胞がセメント芽細胞に分化したと結論づけた。さらに根分岐部では,βgal陽性細胞はセメント質表層のみに認められ,根尖部分でのセメント質形成や,無細胞セメント質の形成とは異なった複数のセメント質形成のメカニズムが存在すると考えた7)。
Akimotoら8)は,HERS由来のセルラインを用いて,in vitroにて遺伝子発現とタンパク発現を調べた。その結果,vimentinとN-cadherinなどの間葉系細胞マーカー,cytokeratin14,E-cadherin,p63などの上皮系幹細胞マーカーをともに認めた。さらにTGF-βの刺激によって,多くの間葉系マーカーとともに,snail1,snail 2などのEMTマーカーをとらえた。これらの結果からHERS細胞が歯根形成時にEMTを起こす可能性が示された8)。
このように多くのin vitroとin vivoにおける研究で,HERS細胞がセメント芽細胞に分化する可能性が示されている。また有細胞セメント質と無細胞セメント質は,異なる由来の細胞が異なるメカニズムによって形成している可能性が示唆されている4,7)。
歯根発生時における歯小嚢に対するHERSの関与は広く認められるところであるが,HERS細胞がEMTを生じてセメント芽細胞に分化しているとする確証は未だにない。Luanら9)は,マウス臼歯の歯根面の観察において,HERS/ERM細胞のマーカーとしてkeratin14を用いた。セメント質中にkeratin14陽性の上皮系細胞を多数認めたが,これらはHERS細胞がセメント芽細胞に分化したのではなく,石灰化していくセメント基質に封じ込められて取り込まれた結果であるとした9)。ERMの一部は,セメント質表面に近い位置に留まってはいるが,セメント質形成に強く関わってはいない9)。彼らの研究は根表面の上皮細胞はセメント質に結合している可能性があるというLesterの見解10)を裏付けるものであった。また比較発生学的な見地からHERS細胞の機能について検証するために,軟骨魚類,硬骨魚類,両生類,爬虫類,齧歯類,ヒトなどの歯を免疫組織化学的に調べた結果,HERS細胞は歯根膜腔の制御と維持に大きく関わっていることが示唆された9)。
HirataとNakamura11)はマウス臼歯を用いて,keratin-osteopontinの共局在またはkeratin-bone sialoproteinの共局在を有細胞セメント質形成において認めなかったことを報告した11)。Yamamotoら12)もラット臼歯部の組織切片を用いて免疫組織化学染色を行い,セメント芽細胞のうちにkeratin-vimentinの共局在や,Runx2-keratinの共局在を認めなかったとし,上皮系細胞が間葉系細胞に分化したり,石灰化したりする所見はなかったとした。セメント質中のkeratin陽性細胞はセメント芽/セメント細胞ではなく,セメント質形成の過程でセメント質中に取り残されたHERS細胞と考えた12,13)。有細胞,無細胞のセメント質にかかわらず,HERS細胞がセメント芽細胞に分化することはなく,従来の学説通り歯小嚢の細胞がセメント芽細胞に分化すると結論づけた。
以上のようにin vivo研究では,未だ明確な結論が出ていない。これは,研究手法の限界に起因する問題であるとわれわれは考えている。なぜならin vivo研究の多くは,HERS細胞の同定方法として,keratinを標的とし抗keratin抗体を用いるか,遺伝子改変マウスを用いてkeratin産生細胞をLacZで見出す方法を採用しているからである。このためもしHERS細胞のEMTが進んでkeratin産生がなくなると,追跡不能となる危険性がある。従来の実験方法では,keratin陽性のHERS由来細胞は確認可能であるが,keratin陰性となったHERS由来細胞は確認できない可能性がある。
そこでわれわれは,HERS細胞の由来をGFPマウスとし,これを野生型のマウスに移植してGFPの緑色蛍光を頼りにHERS細胞の動態を追跡するという実験手法を考えた14)。実験部位としては,生涯にわたり伸長し続ける下顎切歯を選んだ15)。
齧歯類上下顎切歯は特異な解剖学的構造をしている。エナメル質構造が唇側に形成され,舌側に歯根膜が形成される。切歯の最根尖側は,もともとはLabial cervical loopと呼ばれていたが,Haradaらによって新たにapical budと名付けられた16-18)。apical budには,爪や毛包と同様に多能性細胞と幹細胞nicheが存在することが証明されている19,20)。apical budはマウス臼歯やヒトの歯の発生段階におけるcervical loopのアナログとみなされている。この組織を移植材料として利用することは上皮間葉相互作用と細胞の分化を研究するための理想的なモデルになると考えられた。
本実験では,レシピエントの細胞をドナー由来GFP陽性細胞に置換し,分化した細胞の形質を判別するためにpodoplaninに対する免疫蛍光染色を行った。podoplaninはリンパ管などに見られる細胞表面マーカーである。Sawaらはマウス切歯の内エナメル上皮と象牙芽細胞においてpodoplanin陽性細胞が見られると報告している21,22)。podoplanin染色とHE染色とを組み合わせて見ることによって,エナメル芽細胞,象牙芽細胞,apical budのような特異的な細胞形質を持った細胞の識別が可能となった。
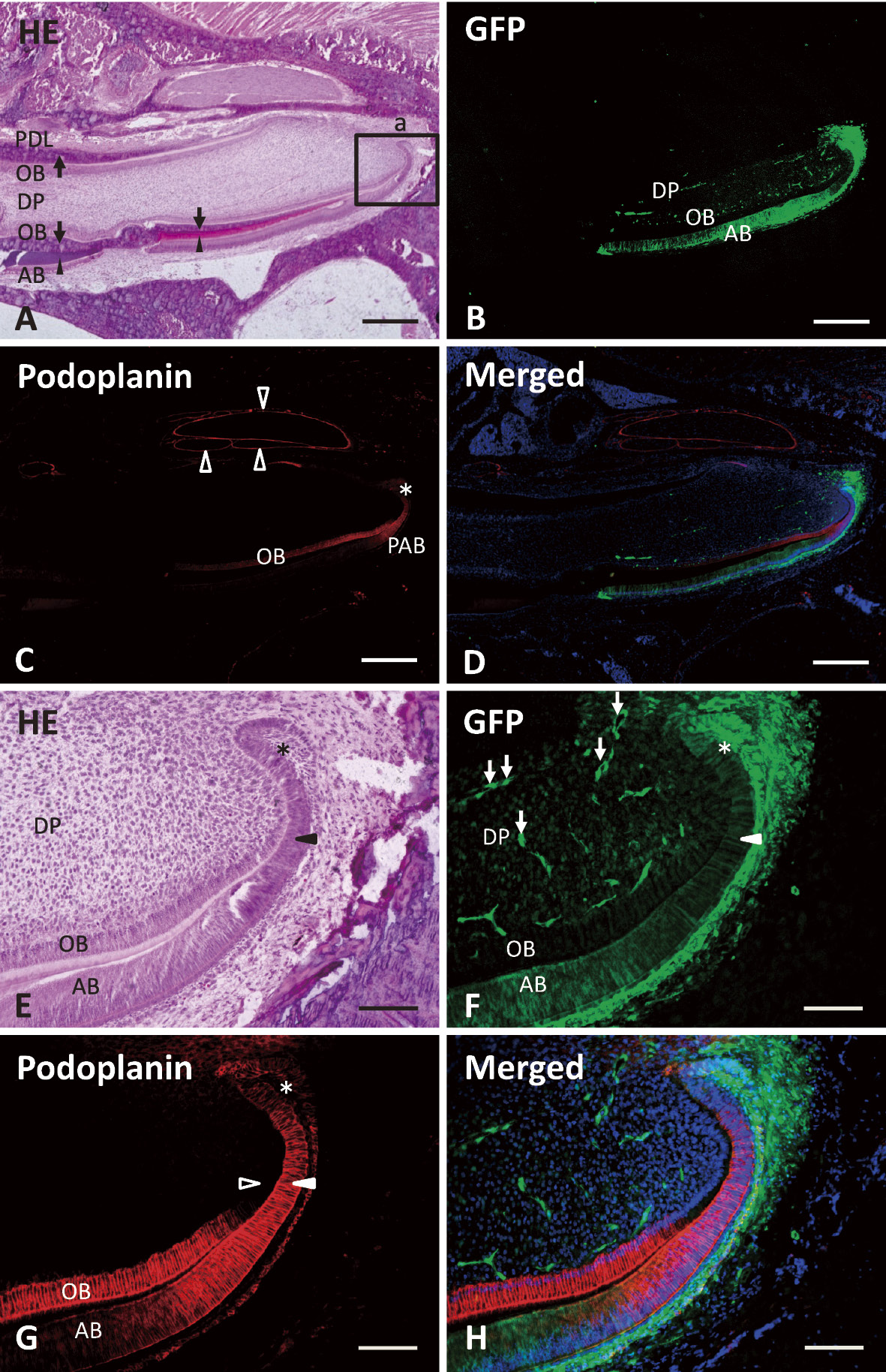
実験にはapical budを含む,根尖から200 μmの大きさの移植片を使用した(Fig. 1)。摘出されたドナーの歯小嚢は実体顕微鏡下で可能な限り除去した。移植手術後2週間で,移植した緑色蛍光細胞は生着し切端方向に向かって約3 mm遊走していた(Fig. 2)。切歯の唇側において,レシピエントとドナー由来の構造が切端側と根尖側にそれぞれ見られた。緑色蛍光細胞は下顎切歯の唇側にのみ認められ,エナメル芽細胞,象牙芽細胞,歯髄細胞に観察された。podoplaninはapical bud,前エナメル芽細胞,象牙芽細胞,神経鞘に観察された。移植された緑色蛍光組織はダメージを受けることなく生着し,正常像に近い連続した構造を切縁方向にのばしていた(Fig. 2)。
移植手術後12週では,舌側の緑色蛍光細胞は象牙質の近くのセメント質内に封入されていた(Fig. 3)。それらは,有細胞セメント質のみに位置し,歯根膜付近や歯根膜腔内には認められなかった。これらの緑色蛍光セメント細胞様細胞はHERS由来の細胞と考えられた。この細胞が,類セメント質を分泌するセメント芽細胞/セメント細胞に分化しているのか,セメント質に埋められた上皮系細胞のままなのかはまだ検証していない。しかしながら我々は,その位置と形態からセメント芽細胞/セメント細胞に分化している可能性が高いと考えている(Fig. 4)。さらなる理解を得るためにセメント芽細胞/セメント細胞に特異的な分子マーカーを使用して検証する必要がある。
今後の研究では,移植の精度をさらに高めるために,移植片に酵素処理を行い,単離されたapical budのみを使用する予定である。我々はこの新たなアプローチで,HERS細胞の歯根発生時の役割の詳細を追跡できることを期待している。

(A)C57BL/6-Tg(CAG-EGFP)mouse(green mouse,上)とC57BL/6 mouse(wild type,下),黄色破線部で移植片を切断し移植した。
(B)Aを蛍光顕微鏡で観察。green mouse だけが発光している。
(C)Green mouse 下顎切歯の矢状断のHE染色像。*はapical bud。黄色破線は移植時の切断部位。
(D)Cを蛍光顕微鏡で観察。
スケールバー:A,B 200 μm;C,D 100 μm。
各々のパネルにおいて上が舌側,下が唇側,左が切端側,右が根尖側。
(A)HE染色像。切歯の舌側に象牙芽細胞(OB),象牙質(黒矢印),歯根膜(PDL),唇側に象牙芽細胞(OB),象牙質(黒矢印),エナメル質(黒矢頭),エナメル芽細胞(AB)を示す。
(B)Aの蛍光組織像。緑色蛍光細胞が下顎切歯の唇側半分に現われている。緑色蛍光はエナメル芽細胞(AB),象牙芽細胞(OB),歯髄細胞(DP)で観察される。
(C)Aの蛍光組織像。podoplanin発現がapical bud(*),前エナメル芽細胞(PAB),象牙芽細胞(OB),神経鞘(白矢頭)で観察される。
(D)GFPの緑色蛍光,podoplaninの赤色蛍光,DAPIの青色蛍光の重ね合せ。
(E)A(a)の中倍率像。apical bud(*),前エナメル芽細胞(黒矢頭),歯髄細胞(DP),象牙芽細胞(OB),エナメル芽細胞(AB)が観察される。
(F)Eの蛍光組織像。緑色蛍光がapical bud(*),前エナメル芽細胞(白矢頭),エナメル芽細胞(AB),象牙芽細胞(OB),歯髄細胞(DP),歯髄の毛細血管(白矢印)に見られる。
(G)Eの蛍光組織像。podoplanin抗体での免疫反応。Apical bud(*),前エナメル芽細胞(白矢頭),象牙芽細胞(OB)において強く,エナメル芽細胞(AB)と前象牙芽細胞(外枠矢印)において弱く発現している。
(H)GFPの緑色蛍光,podoplaninの赤色蛍光,DAPIの青色蛍光の重ね合せ。
スケールバー:A-D 500 μm;E-H 100 μm。

各々のパネルにおいて上が舌側,下が唇側,左が切端側,右が根尖側。
(A)HE染色像。切歯の舌側に歯根膜(PDL),セメント質(C),象牙質(D),象牙芽細胞(黒矢印),歯髄(DP),唇側に象牙芽細胞(OB),象牙質(D),エナメル質(E),エナメル芽細胞(黒矢印)を示す。
(B)Aの蛍光組織像。green mouse由来細胞の遊走を示す。唇側のエナメル芽細胞(白矢印)と舌側のセメント質(外形矢頭)に緑色蛍光を認める。
(C)Aの蛍光組織像。podoplanin発現が神経鞘(*),象牙芽細胞(白矢頭),エナメル芽細胞(白矢印)に観察される。エナメル質基質(**)に交差反応が見られる。
(D)GFPの緑色蛍光,podoplaninの赤色蛍光,DAPIの青色蛍光の重ね合せ。
(E)A(a)の中倍率像。歯根膜(PDL),セメント質(C),象牙質(D)。
(F)Eの蛍光組織像。緑色蛍光細胞はセメント質中に認めるが,歯根膜中には認めない。
(G)E(b)の高倍率像。セメント質(C),象牙質(D)。
(H)Gの蛍光組織像。GFPの緑色蛍光,DAPIの青色蛍光の重ね合せ。セメント質中にセメント細胞様細胞を認める。セメント質(C),象牙質(D)。
スケールバー:A-D 500 μm;E-F 100 μm;G-H 100 μm。

近年,HERS細胞による歯小嚢細胞の分化誘導は,Wnt経路を介するという報告がなされている23,24)。歯小嚢細胞はHERS細胞との共培養によって,bone sialoproteinやosteocalcinなどのセメント芽細胞への分化に関連したマーカーの発現が確認されている24)。HERS細胞はcanonical Wntリガンドを発現している可能性もあり,この方面での研究が進んでいる23)。
HERS細胞には,上皮系の幹細胞に関係する遺伝子や,Oct-4,Nanog,SSEA-4などの胚性幹細胞マーカーを認めるとの報告もあり25),将来的にはHERSやERMなどの細胞をソースとした再生療法へと発展する可能性がある。
歯周組織再生療法においては,セメント質再生をともなう歯根膜再生が目指すべきゴールとなっている。セメント質は石灰化した歯周組織であり,歯根膜の線維の一端がSharpy線維として入り込み,もう一端は歯槽骨に入り込んで歯を保持するのに役立つ。セメント質の形成と恒常性の維持には,HERSとERMの細胞が深く関わっているが,詳細については未だ不明である3)。本レビューで取り上げたHERS細胞がEMTを生じてセメント芽細胞になるかどうかについても,さらなる検証が必要である。
動物実験は福岡歯科大学動物実験指針に基づき,「動物の愛護及び管理に関する法律の一部を改正する法律」を遵守した上で,動物実験委員会の承認(平成25年10月8日承認,承認番号12008)に沿って行われています。
今回の論文に関連して,開示すべき利益相反状態はありません。