はじめに
インターロイキン-1(IL-1)は1970年代後半に胸腺細胞の増殖に関与する「リンパ球活性化因子」1),脳での「内因性発熱物質」2),骨から産生される破骨細胞活性化因子3),筋や軟骨の分解に働く「カタボリン」4)など産生細胞やその生物学的機能に基づいて様々な名称がつけられていたが,同じタンパクであることが明らかとなり,1979年にIL-1という名称に整理された。その後,1984年にクローニング5)され今日に至るが,IL-1の機能を詳細に調べた初期の研究結果は今でも非常に重要であり,私ならびに私のグループでは歯周病原細菌の内毒素(LPS)や莢膜多糖(CP)がin vitroの実験系において,骨吸収活性や破骨細胞形成能を有すること6,7)や,LPSやCPによる骨吸収や破骨細胞形成に,プロスタグランディンE2とIL-1が深く関与していることを報告してきた8,9)。その後,1990年にはIL-1のインヒビターとして働くIL-1レセプターアンタゴニスト(IL-1Ra)が発見された10)。
そこで,IL-1とIL-1Raのアンバランスが歯周病の発症に深く関与するのではないかと考え,IL-1とIL-1Raについて,臨床研究ならびに基礎研究を行ってきた。本稿では,これまでの研究成果および関連する報告について概説する。そして,近年,IL-1Raをはじめとする抗炎症性サイトカインや抗炎症性サイトカイン抗体などは,生物製剤として,関節リウマチ,クリオピン関連周期性発熱症候群(CAPS)11,12)に利用されているが,歯周病において,歯周組織の炎症を直接コントロールするような形での生物製剤の応用はまだされていない。そこで,IL-1Raの歯周病疾患マーカーや歯周病治療薬としての応用の可能性など,今後の展望について紹介する。
1) IL-1α,IL-1βおよびIL-1Raの産生とシグナル伝達
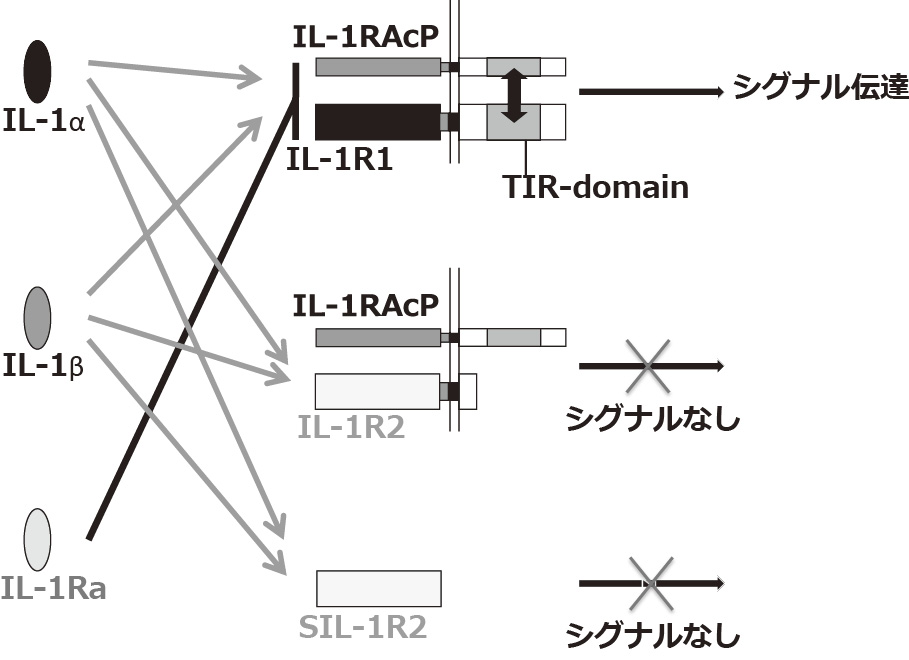
IL-1の11のファミリーメンバーの中には2つのアゴニストであるIL-1α,IL-1βとアンタゴニストとして働くIL-1Raが存在する13)。IL-1βはマクロファージや単球からはインフラマソームを介したカスペース-1,好中球では細胞内プロテアーゼの活性化により前駆型から活性型IL-1βとして細胞外に産生され14),IL-1αは特に上皮細胞において細胞の損傷や壊死によって細胞外に放出される細胞内分子である15)。IL-1は好中球,TH17細胞,自然リンパ球,破骨細胞,軟骨細胞などを標的細胞とし,PGE2,IL-1β,IL-17,MMP,RANKLなどの産生を促進しすることが知られている。IL-1α,IL-1βは,細胞膜上に発現する2つの受容体,IL-1レセプタータイプ1(IL-1R1)とIL-1レセプタータイプ2(IL-1R2)に結合することが知られている16)。細胞内ドメインを有するIL-1R1は,IL-1と結合し,シグナル伝達するのに対し,IL-1R2は,IL-1R1に比べ細胞内領域が形態的に極めて短く,IL-1のシグナル伝達にはほとんど関与しないことから17),デコイレセプターとして,IL-1の活性を抑制している。また,IL-1R2は細胞膜上から遊離し,可溶性IL-1R2(SIL-1R2)として,とくにIL-1βと結合することによりIL-1活性の調節に関与していることが知られている18)。一方,IL-1Raは,活性化マクロファージなどから産生され,IL-1R1に結合するものの,IL-1レセプター補助タンパク(IL-1Racp)を結合できないため,シグナル伝達を引き起こさず,IL-1の活性調節に働いている19,20)(図1)。
2) 歯周病患者の歯肉溝滲出液中IL-1,IL-1RaおよびSIL-1R2量の比較
歯周病の臨床検査において,プロービング時出血から歯周ポケット内の炎症の有無を知ることはできても,その炎症の程度を定量的に測定することはできない。そこで,1990年代に高感度ELISAが利用できるようになると,IL-1が炎症性骨吸収に関与することに着目し,歯周組織の炎症の定量化を目的に,歯周炎患者の歯肉溝滲出液(gingival crevicular fluid,GCF)中のIL-1とIL-1Raを測定することにした。慢性歯周炎患者を,軽度歯槽骨吸収群,中程度歯槽骨吸収群,重度歯槽骨吸収群に分類し,初診時に採取した各群のGCF中のIL-1とIL-1Ra量を測定し,3群間で,IL-1とIL-1Ra量を比較検討した。その結果,軽度群と中程度群に比べ,重度群ではGCF中のIL-1αとIL-1β量が有意に高いことが明らかとなった(図2A,B,C)。しかし,軽度群と中程度群に比べ,重度群では,GCF中のIL-1Ra量が低い傾向を示したことから,歯周組織でのIL-1過剰産生とその活性調節に働くIL-1Raの産生低下が,歯槽骨吸収に深く関与していることが示唆された21)。
一方,慢性関節炎患者の血清中SIL-1R2濃度は関節破壊の程度と負の相関を示すこと22)や,変形性関節炎患者の軟骨においてSIL-1R2産生は著しく減少することが報告されている23)。さらに,歯周組織に関係した報告として,炎症性歯肉由来線維芽細胞のIL-1R2発現は増加し24),IL-1R2を過剰発現させたヒト歯肉線維芽細胞ではIL-1βmRNA発現を抑制させている25)ことが報告されている。そこで,病態によりIL-1βとSIL-1R2量に違いがないかを比較検討するため,年齢以外の臨床所見に有意差のない慢性歯周炎患者と侵襲性歯周炎患者のGCF中IL-1βとSIL-1R2量を測定した。その結果,慢性歯周炎患者群では47名中46名,侵襲性歯周炎患者群では17名中15名のGCF中にIL-1βが検出されていた。一方,SIL-1R2は慢性歯周炎患者群の46名中26名に検出が認められたのに対し,侵襲性歯周炎患者群では17名中6名のみに検出が認められ,検出頻度に低い傾向が認められた26)。このことから,侵襲性歯周炎患者の歯周組織破壊において,SIL-1R2の発現低下の関与が示唆された。そこで,次に,歯肉上皮細胞を用いたIL-1R2発現メカニズムの解析を行い,また,IL-1Rを候補として遺伝子多型解析を行うこととした。
3) 歯肉組織におけるIL-1R2発現メカニズムの検討
歯周組織におけるIL-1R2発現を確認するため,歯周病患者の歯肉組織を免疫組織化学染色した結果,歯肉重層扁平上皮内の有棘層の歯肉上皮細胞にIL-1R2の局在が認められた。そこで,マウス株化歯肉上皮細胞であるGE1細胞を各種サイトカイン刺激しIL-1R2 mRNA発現を検討したところ,IL-1R2 mRNA発現の増加にはIL-4とIL-13が関与し,インターフェロン-γ(IFN-γ)は発現の抑制に関与することと,IFN-γはIL-4,IL-13のシグナル伝達に関与するSTAT6のリン酸化を抑制していることが明らかとなった27)。侵襲性歯周炎患者では慢性歯周炎患者や健常被験者に比べ,単球が樹状細胞分化しやすく28)その樹状細胞がNK細胞を刺激し,早期のIFN-γ産生に関与すること29,30),さらに侵襲性歯周炎患者のGCF中ではTh1型サイトカインが多量に産生されること31)から考えると,侵襲性歯周炎患者においてGCF中に可溶性IL-1R2が産生されにくかったことにIFN-γ産生亢進が関与していることが考えられた。
4) IL-1R遺伝子多型と歯周病病態の関連解析
歯周病の疫学研究の結果,その発症や進行には,修飾的因子のひとつとして,遺伝的因子が関与していると考えられ32,33),とくに侵襲性歯周炎は,若年者に発症し,急速な歯周組織破壊が認められることから,より強い遺伝的因子の関与が示唆された34)。遺伝子多型解析からは,歯周炎と多数の遺伝子との関連性が示唆されており,とくにヒト第二染色体上のIL-1遺伝子クラスターを対象とした研究報告は多い。その中でもIL-1遺伝子と歯周炎との関連性については議論が重ねられ,近年のメタ解析では,コーカサス人の慢性歯周炎とIL-1A遺伝子多型(rs1800587,rs17561),IL-1B遺伝子多型(rs1143634)との間に,統計的に有意な関連性があるという結果が示された35)。一方で,我々の研究により侵襲性歯周炎における歯周組織破壊への関与が示唆されたIL-1Rをコードする遺伝子と歯周炎との関連性を示唆する報告はなかった。
そこで日本人侵襲性歯周炎患者と歯周組織健常者の末梢血から抽出したゲノムDNAを用い,IL-1R1とIL-1R2遺伝子について,侵襲性歯周炎との関連解析を行った。被験者は,侵襲性歯周炎と診断された患者(n=119,平均年齢31.4±6.3歳)と歯周組織健常者(n=102,平均年齢43.6±7.0歳)とした。まず,被験者(n=48,各群n=24)について,エクソン領域およびエクソン・イントロン境界領域を含むゲノム領域(計15 kb)の塩基配列を決定し,相互比較によりその領域に38の一塩基多型(single nucleotide polymorphism,SNP)を同定した。さらに,それらのSNPsを用い連鎖不平衡解析を行い,その結果を基に侵襲性歯周炎について,それぞれの遺伝子との関連性の検討を行ったところ,IL-1R2遺伝子におけるSNPsにおいて,両群間に統計学的な有意差が認められた。また,性別と喫煙歴の有無を調整した場合の,両遺伝子と侵襲性歯周炎との関連性を,多重ロジスティック回帰分析により検討した結果,特定のSNPs(rs3819370,rs3218974,rs3218977)において,両群間に有意差が認められ,さらに2 SNPs(rs3819370,rs3218974)で構成したハプロタイプにおいても,両群間に有意差が認められた36)。以上の結果から,IL-1R2遺伝子における特定のSNPs(rs3819370,rs3218974,rs3218977)や,それらと連鎖不平衡にあるSNPs(rs2302589,rs2282744,rs2282743,rs2072480,rs2072475,rs2072473,rs3212326)が,歯周病疾患マーカーとして,歯周炎の発症前リスク診断の遺伝子マーカーになり得る可能性が示唆された。
5) IL-1RaがIL-1以外の炎症性サイトカイン産生に与える影響
東京大学医科学研究所システム疾患モデル研究センター・分子病態研究分野 岩倉研究室で開発されたBALB/c背景IL-1Ra欠損(KO)マウスは,約12週齢頃から抗免疫グロブリン抗体,抗DNA抗体など自己抗体産生レベルを亢進し,四肢関節に軟骨破壊,炎症性細胞浸潤,フィブリンクロットの形成,および破骨細胞の活性化などを伴うヒト関節リウマチに類似した関節炎を発症する37)。そこで我々は,IL-1Ra KOマウスに対し,歯周病原細菌感染による歯周炎を惹起できれば,歯周炎におけるIL-1Raの機能解析を行う上で,有用な実験的歯周炎モデルになるのではないかと考えた。まず,IL-1Ra KOならびに野生型マウス腹腔マクロファージを歯周病原細菌菌体成分刺激による炎症性サイトカイン発現について調べることを目的に,13週齢雄IL-1Ra KOと野生型マウスから腹腔マクロファージを回収し,Aggregatibacter actinomycetemcomitans LPSで刺激した後,IL-1α,IL-1β,TNF-α,IL-6のmRNA発現を,real-time quantitative polymerase chain reaction(qPCR)法にて解析した。qPCR法による各群の相対比較では,A. actinomycetemcomitans LPS刺激したIL-1Ra KOマウスは野生型マウス腹腔マクロファージに比べてIL-1α mRNAは約1.6倍,IL-1β mRNAは約3.5倍,IL-6 mRNAは約2.2倍と有意に高い発現を認めた。また,A. actinomycetemcomitans LPS未刺激時でも,IL-1Ra欠損マウスは野生型マウスに比べて,炎症性サイトカインmRNAの有意に高い発現を認めた38)。IL-1 KOマウスでは野生型マウスに比べて炎症惹起時におけるTNF-αやIL-6の産生が少ないことや39),肺胞マクロファージからのIL-1βとTNF-α産生をIL-1Raが抑制したこと40),さらに,IL-1Ra KOマウスの肝細胞は未刺激でも高いNFκ-Bの転写活性を有していたこと41)が報告されている。これらのことから,LPSあるいはIL-1,TNF-αなどの炎症性サイトカイン刺激が,細胞内のNFκ-B活性化を介してIL-1,TNF-α,およびIL-6 mRNAの転写を互いに活性化し,これをIL-1Raが制御しているのではないかと考えられた。したがって,IL-1RaはIL-1に特異的なインヒビターであるものの,間接的にTNF-αやIL-6を顕著におさえる抗炎症性サイトカインであると考えられる。
6) IL-1Ra欠損マウスの実験的歯周炎における組織破壊亢進
IL-1RaKOマウスは野生型マウスに比べ,炎症性サイトカインの有意に高いmRNA発現が認められたことから,IL-1RaKOマウスは野生型マウスに比べ,容易に歯周病を発症させることができるのではないかと考えた。そこで,両マウスに実験的歯周炎を惹起し,比較検討を行うこととした。13週齢IL-1Ra KOマウスと野生型マウスの口腔内にカルボキシメチルセルロース溶液にて調製したA. actinomycetemcomitans(ATCC29524株)菌体浮遊液を1日おきに5回経口投与した。菌体浮遊液投与終了45日後に屠殺し,下顎骨を採取した。その後,歯槽骨破壊の程度をμCTにて確認した後,組織切片を作製し,H-E染色とTRAP染色を行った。A. actinomycetemcomitans血清抗体価はIL-1Ra KOマウスにおいて有意に増加しており,このことは局所型侵襲性歯周炎患者末梢血単球をPokeweed mitogenで刺激した時IgG2産生がIL-1Raによって抑制されていたことと一致した結果であった42)。マイクロCTによる実験的歯周炎惹起後の歯槽骨変化を観察したところ,A. actinomycetemcomitans感染IL-1Ra KOマウスでは歯槽骨表面が粗造となり,歯槽骨頂部は歯槽骨吸収を伴う不整な形態が観察され,下顎第二臼歯の近遠心接触点下部の槽間中隔と根分岐部に明らかな歯槽骨の吸収が観察された(図3A)。さらに,下顎第二臼歯近心舌側の歯槽骨残存度を測定したところ,A. actinomycetemcomitans感染IL-1Ra KOマウスは未処置IL-1Ra KOマウス,未処置野生型マウスおよびA. actinomycetemcomitans感染野生型マウスと比較して約30%,歯槽骨残存度が有意に低下していた。H-E染色による実験的歯周炎惹起後の歯周組織変化を観察したところ,A. actinomycetemcomitans感染野生型マウスでは,上皮突起の伸張や歯肉固有層での結合組織線維の走行の乱れや歯槽骨頂部における炎症性細胞浸潤は観察されなかったのに対し,A. actinomycetemcomitans感染IL-1Ra KOマウスでは歯肉頂部に辺縁不整な上皮と結合組織線維の走行の乱れ,上皮直下に炎症性細胞浸潤,付着の喪失が観察された(図3B)。A. actinomycetemcomitans感染IL-1Ra KOマウスはA. actinomycetemcomitans感染野生型マウスと比較して歯肉固有層直下の骨頂部だけでなく,槽間中隔表層と根間中隔表層と骨髄側にTRAP陽性細胞が観察された(図3C)。さらに,それぞれのマウスから採取した骨芽細胞をA. actinomycetemcomitans菌刺激したところ,骨吸収に働くRANKL,M-CSFの発現はIL-1RaKOマウスで増加しており,骨形成に働く,RUNX2,ALP,OCN/BGP,およびBSP発現は低下していた43)。(図3B)の付着の喪失はIL-1Raに依存した現象かどうかについて,ヒト上皮細胞のIL-1Raをノックダウンしたところ,MMP-13発現は4から8倍上昇することを明らかとした。そこで,A. actinomycetemcomitans感染IL-1Ra KOマウスの歯肉でのMMP-13局在を調べたところ接合上皮に強い局在が観察され,上皮性付着の構成成分であるラミニン5局在の消失が観察された。したがって,IL-1RaはMMP-13発現を抑制し,付着の喪失を制御していることが明らかとなった44)。

7) 歯周領域におけるIL-1Raの臨床応用と今後の展望
GCF中の微量タンパクの測定は,歯周組織の炎症を反映する点や,1歯ごとの重症度を把握する点において,優れた検査である。しかし,歯周組織の顕著な炎症や,それに伴う深い歯周ポケットを有する歯周病患者からのGCF採取は容易であるものの,歯周治療が奏功し,炎症がコントロールされ,歯周組織の治癒や病状安定の得られた患者から,測定に十分なGCFを採取することは容易ではない。また,GCFの採取は,操作が煩雑であることから,大規模な疫学検査には不向きである。したがって,これらの問題点を解決するためには,歯周組織の状態に依存せず,より簡便に採取できる末梢血血清中の歯周病疾患マーカーの開発が期待されている。前述の通り,我々は歯周炎患者の末梢血から抽出したゲノムDNAを用い,IL-1R2遺伝子多型解析を行った結果,特定のアリルの頻度において,歯周組織健常者との間に有意差を見いだした36)。一方で,Smithらの報告によると,健常者100名の血清中IL-1濃度の測定において,IL-1βは28名が検出限界以下であったのに対し,SIL-1R2濃度は測定が可能であり,平均8 ng/ml(最小2 ng/ml,最大16 ng/ml)であった45)。これらのことから,IL-1R2遺伝子多型や血清中SIL-1R2濃度は,歯周病疾患マーカーになり得る可能性が期待される。将来,健康診断時や医科受診時の血液検査に活用し,SIL-1R2による歯周病のスクリーニングを行うことで,歯周病が疑われる者に対しては,歯科にて精密検査(歯周組織検査)を行うような,医科歯科連携の架け橋となることが期待される。また,大規模な疫学調査においても,有用な歯周病疾患マーカーのひとつになり得るかもしれない。
IL-1Ra製剤は,2001年にアメリカ食品医薬品局においてアナキンラ(商品名KineretⓇ)として承認され,リウマチ治療薬として利用されている46)。また,リウマチ患者に対して,IL-1Raを使用したところ,炎症や疼痛の軽減に効果的であることが明らかとなった47)。さらに,リウマチ,CAPSだけでなく,糖尿病や心臓血管疾患の発症や進行においても,歯周病と同様に,慢性炎症からのIL-1,IL-6,TNF-αが深く関与していることから,医科では直接的に炎症性サイトカインをコントロールする試みとして,2型糖尿病患者にアナキンラを投与し検討している。その結果,プラセボ患者に比べ,プロインシュリン/インシュリン比とプロインシュリンの構成成分であるC-ペプチドが改善48)し,休薬後も改善が持続することが明らかとなっている49)。一方で,縦断研究において,糖尿病を発症した335名と発症しなかった2475名について,血清中のIL-1Raを経年的に測定したところ,糖尿病発症者では非発症者と比べると,発症の13年前にさかのぼってIL-1Raのレベルが上昇していたことや,さらに発症の6年前から血清中のIL-1Ra濃度の上昇速度が増加していたことが明らかとなった50)。さらに,IL-1βモノクローナル抗体カナキンマブは2型糖尿病患者の糖化ヘモグロビン値を下げることがランダム化比較試験から明らかとなっている51)。また冠動脈疾患を有するリウマチ性関節炎患者を対象とした研究においては,アナキンラを30日間投与したところ冠状動脈の流量,左心機能と炎症マーカーが改善したと報告されている52)。我々の今回の臨床研究においては,重度歯槽骨吸収群のGCF中IL-1Ra量に低い傾向が認められ,基礎研究においては,実験的歯周炎を惹起したIL-1Ra KOマウスは野生型マウスに比べて,骨吸収マーカー発現の増加,骨形成マーカー発現の低下および顕著な歯槽骨吸収が認められた。これらのことから,IL-1Raを歯周病治療薬として利用し,炎症性サイトカインを制御することは,歯周病の病態改善において有効である可能性が考えられる。しかし,IL-1αの産生メカニズムは組織壊死や損傷に応答していることから,IL-1を極端にコントロールすることは組織の治癒を遅延させる可能性もあるため,その利用法は慎重に考えなければならない。
すでに海外では,リウマチ以外の全身疾患に対しても,IL-1Raや抗IL-1β抗体の有効性が検討され,糖尿病や,心臓血管疾患において,病態改善に有用であること48-51)が示唆されてきた。これらを考慮すると,これまでの実験系を応用し,歯周病の病態改善におけるIL-1Raの効果を実証することができれば,新規の歯周病治療薬として応用されることが期待できると考えている。
謝辞
稿を終えるにあたり,私に研究の機会を与えていただいた野口俊英愛知学院大学名誉教授に感謝いたします。また研究者として直接研究指導していただいた故古賀敏比古九州大学大学院教授,西原達次九州歯科大学教授に深謝いたします。最後に研究をスタートしてから現在までご協力いただいた愛知学院大学歯周病学講座ならびに松本歯科大学歯科保存学講座の多くの教室員の先生方に深謝いたします。
本総説の要旨は第60回春季日本歯周病学会学術大会(平成29年5月12日)において発表した。
今回の論文に関連して,開示すべき利益相反状態はありません。
References
- 1) Gery I, Waksman BH: Potentiation of the T-lymphocyte response to mitogens. J Exp Med, 136: 143-155, 1972.
- 2) Dinarello CA, Goldin NP, Wolff SM: Demonstration and characterization of two distinct human leukocytic pyrogens. J Exp Med, 139: 1269-1281, 1974.
- 3) Horton JE, Raisz LG, Simmons HA, Oppenheim JJ, Mergenhagen SE: Bone resorbing activity in supernatant fluid from cultured human peripheral blood leukocytes. Science, 177: 793-795, 1972.
- 4) Dayer JM, Graham R, Russell G, Krane SM: Collagenase production by rheumatoid synovial cells: stimulation by a human lymphocyte factor. Science, 195: 181-183, 1977.
- 5) Lomedico PT, Gubler U, Hellmann CP, Dukovich M, Giri JG, Pan YC, Collier K, Semionow R, Chua AO, Mizel SB: Cloning and expression of murine interleukin-1 cDNA in Escherichia coli. Nature, 312: 458-462, 1984.
- 6) Ishihara Y, Nishihara T, Maki E, Noguchi T, Koga T: Role of interleukin-1 and prostaglandin in in vitro bone resorption induced by Actinobacillus actinomycetemcomitans lipopolysaccharide. Journal of periodontal research, 26: 155-160, 1991.
- 7) Takahashi T, Nishihara T, Ishihara Y, Amano K, Shibuya N, Moro I, Koga T: Murine macrophage interleukin-1 release by capsularlike serotype-specific polysaccharide antigens of Actinobacillus actinomycetemcomitans. Infection and immunity, 59: 18-23, 1991.
- 8) Ueda N, Nishihara T, Ishihara Y, Amano K, Kuroyanagi T, Noguchi T: Role of prostaglandin in the formation of osteoclasts induced by capsular-like polysaccharide antigen of Actinobacillus actinomycetemcomitans strain Y4. Oral microbiology and immunology, 10: 69-75, 1995.
- 9) Nishihara T, Ueda N, Amano K, Ishihara Y, Hayakawa H, Kuroyanagi T, Ohsaki Y, Nagata K, Noguchi T: Actinobacillus actinomycetemcomitans Y4 capsular-polysaccharide-like polysaccharide promotes osteoclast-like cell formation by interleukin-1 alpha production in mouse marrow cultures. Infection and immunity, 63: 1893-1898, 1995.
- 10) Hannum CH, Wilcox CJ, Arend WP, Joslin FG, Dripps DJ, Heimdal PL, Armes LG, Sommer A, Eisenberg SP, Thompson RC: Interleukin-1 receptor antagonist activity of a human interleukin-1 inhibitor. Nature, 343: 336-340, 1990.
- 11) Carter DB, Deibel MR Jr, Dunn CJ, Tomich CS, Laborde AL, Slightom JL, Berger AE, Bienkowski MJ, Sun FF, McEwan RN, Harris PKW, Yem AW, Waszak GA, Chosay JG, Sieu LC, Hardee MM, Zurcher-Neely HA, Reardon IM, Heinrikson RL, Truesdell SE, Shelly JA, Eessalu TE, Taylor BM, Tracey DE: Purification, cloning, expression and biological characterization of an interleukin-1 receptor antagonist protein. Nature, 344: 633-638, 1990.
- 12) Chakraborty A, Tannenbaum S, Rordorf C, Lowe PJ, Floch D, Gram H, Roy S: Pharmacokinetic and pharmacodynamic properties of canakinumab, a human anti-interleukin-1β monoclonal antibody. Clin Pharmacokinet, 51: e1-e18, 2012.
- 13) Garlanda C, Dinarello CA, Mantovani A: The interleukin-1 family: back to the future. Immunity, 39: 1003-1018, 2013.
- 14) Netea MG, Nold-Petry CA, Nold MF, Joosten LA, Opitz B, van der Meer JH, van de Veerdonk FL, Ferwerda G, Heinhuis B, Devesa I, Funk CJ, Mason RJ, Kullberg BJ, Rubartelli A, van der Meer JW, Dinarello CA: Differential requirement for the activation of the inflammasome for processing and release of IL-1β in monocytes and macrophages. Blood, 113: 2324-2335, 2009.
- 15) Chen CJ, Kono H, Golenbock D, Reed G, Akira S, Rock KL: Identification of a key pathway required for the sterile inflammatory response triggered by dying cells. Nat Med, 13: 851-856, 2007.
- 16) Sims JE, Gayle MA, Slack JL, Alderson MR, Bird TA, Giri JG, Colotta F, Re F, Mantovani A, Shanebeck K, et al: Interleukin 1 signaling occurs exclusively via the type I receptor. Proceedings of the National Academy of Sciences of the United States of America, 90: 6155-6159, 1993.
- 17) Dinarello CA: Interleukin-1, interleukin-1 receptors and interleukin-1 receptor antagonist. International reviews of immunology, 16: 457-499, 1998.
- 18) Clark W, Jobanputra P, Barton P, Burls A: The clinical and cost-effectiveness of anakinra for the treatment of rheumatoid arthritis in adults: a systematic review and economic analysis. Health technology assessment, 8: iii-iv, ix-x, 1-105, 2004.
- 19) Greenfeder SA, Nunes P, Kwee L, Labow M, Chizzonite RA, Ju G: Molecular cloning and characterization of a second subunit of the interleukin 1 receptor complex. The Journal of biological chemistry, 270: 13757-13765, 1995.
- 20) Dinarello CA: Interleukin-1 and interleukin-1 antagonism. Blood, 77: 1627-1652, 1991.
- 21) Ishihara Y, Nishihara T, Kuroyanagi T, Shirozu N, Yamagishi E, Ohguchi M, Koide M, Ueda N, Amano K, Noguchi T: Gingival crevicular interleukin-1 and interleukin-1 receptor antagonist levels in periodontally healthy and diseased sites. Journal of periodontal research, 32: 524-529, 1997.
- 22) Jouvenne P, Vannier E, Dinarello CA, Miossec P: Elevated levels of soluble interleukin-1 receptor type II and interleukin-1 receptor antagonist in patients with chronic arthritis: correlations with markers of inflammation and joint destruction. Arthritis and rheumatism, 41: 1083-1089, 1998.
- 23) Attur MG, Dave M, Cipolletta C, Kang P, Goldring MB, Patel IR, Abramson SB, Amin AR: Reversal of autocrine and paracrine effects of interleukin 1 (IL-1) in human arthritis by type II IL-1 decoy receptor. Potential for pharmacological intervention. The Journal of biological chemistry, 275: 40307-40315, 2000.
- 24) Kanda-Nakamura C, Izumi Y, Sueda T: Increased expression of interleukin-1 receptors on fibroblasts derived from inflamed gingiva. Journal of periodontology, 67: 1267-1273, 1996.
- 25) Chou HH, Takashiba S, Maeda H, Naruishi K, Nishimura F, Arai H, Lu H, Murayama Y: Induction of intracellular interleukin-1 beta signals via type II interleukin-1 receptor in human gingival fibroblasts. Journal of dental research, 79: 1683-1688, 2000.
- 26) Suzuki M, Ishihara Y, Kamiya Y, Koide M, Fuma D, Fujita S, Matsumura Y, Suga T, Kamei H, Noguchi T: Soluble interleukin-1 receptor type II levels in gingival crevicular fluid in aggressive and chronic periodontitis. Journal of periodontology, 79: 495-500, 2008.
- 27) Kamiya Y, Ishihara Y, Kamei H, Ozawa Y, Mizutani H, Kubo K, Maeda H, Noguchi T: IL-1 receptor type II production is upregulated by IL-4 and IL-13, and downregulated by IFN-g in mouse gingival epithelial cells. Modern research in inflammation, 3: 37-47, 2014.
- 28) Barbour SE, Ishihara Y, Fakher M, Al-Darmaki S, Caven TH, Shelburne CP, Best AM, Schenkein HA, Tew JG: Monocyte differentiation in localized juvenile periodontitis is skewed toward the dendritic cell phenotype. Infection and immunity, 70: 2780-2786, 2002.
- 29) Kikuchi T, Hahn CL, Tanaka S, Barbour SE, Schenkein HA, Tew JG: Dendritic cells stimulated with Actinobacillus actinomycetemcomitans elicit rapid gamma interferon responses by natural killer cells. Infection and immunity, 72: 5089-5096, 2004.
- 30) Kikuchi T, Willis DL, Liu M, Purkall DB, Sukumar S, Barbour SE, Schenkein HA, Tew JG: Dendritic-NK cell interactions in P. gingivalis-specific responses. Journal of dental research, 84: 858-862, 2005.
- 31) Salvi GE, Brown CE, Fujihashi K, Kiyono H, Smith FW, Beck JD, Offenbacher S: Inflammatory mediators of the terminal dentition in adult and early onset periodontitis. Journal of periodontal research, 33: 212-225, 1998.
- 32) Michalowicz BS, Aeppli DP, Kuba RK, Bereuter JE, Conry JP, Segal NL, Bouchard TJ Jr, Pihlstrom BL: A twin study of genetic variation in proportional radiographic alveolar bone height. Journal of dental research, 70: 1431-1435, 1991.
- 33) Michalowicz BS, Diehl SR, Gunsolley JC, Sparks BS, Brooks CN, Koertge TE, Califano JV, Burmeister JA, Schenkein HA: Evidence of a substantial genetic basis for risk of adult periodontitis. Journal of periodontology, 71: 1699-1707, 2000.
- 34) Hart TC: Genetic risk factors for early-onset periodontitis. Journal of periodontology, 67: 355-366, 1996.
- 35) Nikolopoulos GK, Dimou NL, Hamodrakas SJ, Bagos PG: Cytokine gene polymorphisms in periodontal disease: a meta-analysis of 53 studies including 4178 cases and 4590 controls. Journal of clinical periodontology, 35: 754-767, 2008.
- 36) Kamei H, Ishihara Y, Fuma D, Niwa T, Kamiya Y, Yokoi T, Suzuki M, Izawa A, Mizutani H, Hayashi J, Sakaki Y, Noguchi T, Kojima T: Interleukin-1 receptor gene variants are associated with aggressive periodontitis in the Japanese. Archives of oral biology, 59: 756-763, 2014.
- 37) Horai R, Saijo S, Tanioka H, Nakae S, Sudo K, Okahara A, Ikuse T, Asano M, Iwakura Y: Development of chronic inflammatory arthropathy resembling rheumatoid arthritis in interleukin 1 receptor antagonist-deficient mice. The Journal of experimental medicine, 191: 313-320, 2000.
- 38) Mizutani H, Ishihara Y, Izawa A, Fujihara Y, Kobayashi S, Gotou H, Okabe E, Takeda H, Ozawa Y, Kamiya Y, Kamei H, Kikuchi T, Yamamoto G, Mitani A, Nishihara T, Noguchi T: Lipopolysaccharide of Aggregatibacter actinomycetemcomitans up-regulates inflammatory cytokines, prostaglandin E2 synthesis and osteoclast formation in interleukin-1 receptor antagonist-deficient mice. Journal of periodontal research, 48: 748-756, 2013.
- 39) Sato A, Ohtaki H, Tsumuraya T, Song D, Ohara K, Asano M, Iwakura Y, Atsumi T, Shioda S: Interleukin-1 participates in the classical and alternative activation of microglia/macrophages after spinal cord injury. Journal of neuroinflammation, 9: 65, 2012.
- 40) Marsh CB, Moore SA, Pope HA, Wewers MD: IL-1ra suppresses endotoxin-induced IL-1 beta and TNF-alpha release from mononuclear phagocytes. The American journal of physiology, 267: L39-45, 1994.
- 41) Ishibe T, Kimura A, Ishida Y, Takayasu T, Hayashi T, Tsuneyama K, Matsushima K, Sakata I, Mukaida N, Kondo T: Reduced acetaminophen-induced liver injury in mice by genetic disruption of IL-1 receptor antagonist. Laboratory investigation; a journal of technical methods and pathology, 89: 68-79, 2009.
- 42) Ishihara Y, Zhang JB, Fakher M, Best AM, Schenkein HA, Barbour SE, Tew JG: Non-redundant roles for interleukin-1 alpha and interleukin-1 beta in regulating human IgG2. Journal of periodontology, 72: 1332-1339, 2001.
- 43) Izawa A, Ishihara Y, Mizutani H, Kobayashi S, Goto H, Okabe E, Takeda H, Ozawa Y, Kamiya Y, Sugita Y, Kubo K, Kamei H, Kikuchi T, Mitani A, Hayashi J, Nishihara T, Maeda H, Noguchi T: Inflammatory bone loss in experimental periodontitis induced by Aggregatibacter actinomycetemcomitans in interleukin-1 receptor antagonist knockout mice. Infection and immunity, 82: 1904-1913, 2014.
- 44) Goto H, Ishihara Y, Kikuchi T, Izawa A, Ozeki N, Kamiya Y, Ozawa Y, Mizutani H, Yamamoto G, Mogi M, Nakata K, Maeda H, Noguchi T, Mitani A: Interleukin-1 Receptor Antagonist Has a Novel Function in the Regulation of Matrix Metalloproteinase-13 Expression. PLoS One, 10 (10): e0140942, 2015.
- 45) Smith DE, Hanna R, Della F, Moore H, Chen H, Farese AM, MacVittie TJ, Virca GD, Sims JE: The soluble form of IL-1 receptor accessory protein enhances the ability of soluble type II IL-1 receptor to inhibit IL-1 action. Immunity, 18: 87-96, 2003.
- 46) Furst DE: Anakinra: review of recombinant human interleukin-I receptor antagonist in the treatment of rheumatoid arthritis. Clinical therapeutics, 26: 1960-1975, 2004.
- 47) Chevalier X, Giraudeau B, Conrozier T, Marliere J, Kiefer P, Goupille P: Safety study of intraarticular injection of interleukin 1 receptor antagonist in patients with painful knee osteoarthritis: a multicenter study. The Journal of rheumatology, 32: 1317-1323, 2005.
- 48) Larsen CM, Faulenbach M, Vaag A, Volund A, Ehses JA, Seifert B, Mandrup-Poulsen T, Donath MY: Interleukin-1-receptor antagonist in type 2 diabetes mellitus. The New England journal of medicine, 356: 1517-1526, 2007.
- 49) Larsen CM, Faulenbach M, Vaag A, Ehses JA, Donath MY, Mandrup-Poulsen T: Sustained effects of interleukin-1 receptor antagonist treatment in type 2 diabetes. Diabetes care, 32: 1663-1668, 2009.
- 50) Carstensen M, Herder C, Kivimaki M, Jokela M, Roden M, Shipley MJ, Witte DR, Brunner EJ, Tabak AG: Accelerated increase in serum interleukin-1 receptor antagonist starts 6 years before diagnosis of type 2 diabetes: Whitehall II prospective cohort study. Diabetes, 59: 1222-1227, 2010.
- 51) Hensen J, Howard CP, Walter V, Thuren T: Impact of interleukin-1β antibody (canakinumab) on glycaemic indicators in patients with type 2 diabetes mellitus: results of secondary endpoints from a randomized, placebo-controlled trial. Diabetes Metab, 39: 524-531, 2013.
- 52) Fearon WF, Fearon DT: Inflammation and cardiovascular disease: role of the interleukin-1 receptor antagonist. Circulation, 117: 2577-2579, 2008.