2025 Volume 145 Issue 5 Pages 365-378
2025 Volume 145 Issue 5 Pages 365-378
This review summarizes the contributions to the discovery, evaluation, and functional development of microbial and enzyme catalysts, as well as the rational design of pathways that synergistically integrate chemical and biochemical reactions. In the introduction, the author outlines his strategies and principles: 1) He avoided biosynthetic enzymes and pathways, opting instead for degradative enzymes that offer broader substrate flexibility and a wider range of applications. 2) He focused on commercially available enzymes, prioritizing their reproducibility and accessibility for widespread use. All the microorganisms he identified have been deposited in public institutions, making them available to researchers in both academic and corporate settings. 3) He developed methods to enhance reactivity and selectivity by optimizing reaction conditions and substrate structures, without altering the enzymes themselves. The main body of the review is divided into two parts. Part 1, titled “Chemo-enzymatic Synergistic Synthesis of Medicines,” covers the following topics: 1) the synthesis of dihydroxymethylepoxyquinomicin (DHMEQ); 2) the synthesis of sialic acids; 3) the utilization of epoxide hydrolase; and 4) the synthesis of (S)-azetidine-2-carboxylic acid. Part 2, titled “New Selective Reactions for Synthesis of Medicines,” includes: 1) the optimization of reaction conditions in lipase-catalyzed transesterification and aminolysis; 2) the conversion of racemates into single enantiomers using hydrolytic enzymes through novel pathways; 3) the use of carbonyl reductases in conjunction with substrate design; 4) nitrile hydratase and amidase in Rhodococcus species; 5) selective acylation and deacylation of alcohols and phenols; and 6) the use of oligosaccharides as protective groups in the synthesis of polyphenol glycosides.
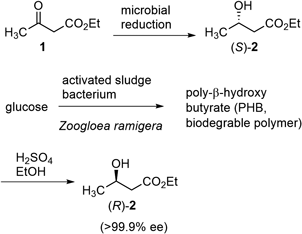
筆者は1980年に,東京大学農学部農芸化学科で森 謙治先生,北原 武先生の御指導の下,有機合成の分野で卒業研究をスタートした.微生物・酵素を用いるアミノ酸・糖質・有機酸や抗生物質などの発酵生産,物質変換は,主に第二次世界大戦後,日本のアカデミック・インダストリーの力の結集でお家芸といえるほど発展していたが,ファインケミカルズの原料合成や官能基変換などへの応用に向け,パイオニアたちが頑張っていた時代である.1)農芸化学の特色を活かすという大義名分を持って?与えられた研究テーマは,アセト酢酸エチル(1)の微生物・酵素還元によって光学活性なβ-ヒドロキシエステル(2)を調製する検討であった.なぜなら,2の両鏡像体は昆虫フェロモンなどの合成原料として有用だからである.修士課程までこのテーマを継続し,パン酵母を用いた還元の条件検討,より選択性の高い酵母の探索(Table 1),微生物が産生する生分解性ポリマーの分解などで2の両鏡像体の大量調製法を確立した(Scheme 1).2)
| Microorganism | Conversion (%) | (S)-2 | Scale (g) | |
|---|---|---|---|---|
| Isolated yield (%) | % ee | |||
| Bakers’ yeast (anaerobic) | 95 | 55 | 90 | 3 |
| Bakers’ yeast (aerobic) | — | 60 | 83 | 18 |
| Saccharomyces uvarum | 75 | 65 | 92 | 0.6 |
| Saccharomyces bailii (KI 0116) | 75 | 53 | 96 | 3 |
| Pichia terricola (KI 0116) | 78 | 45 | 82 | 0.5 |
その時点で,2のα-位に窒素原子を含む骨格を立体選択的に導入し閉環すればβ-ラクタム系抗生物質の原料になると考え,森教授に実験許可を願い出たが「ここは農学部だ」と一蹴された.その頃,当時相模中央化学研究所の柴崎正勝先生が御講演され,そのようなルートが既に実現していたことに驚いたが,3)同時に「偉大な先生と同じアイディアを着想できた」と,勝手に独りで喜んでいた.
大学院時代は,キャンパス内では最も遠い薬学研究科に出向いて講義を聴き,また実験室にお邪魔して大野雅二先生,小林 進先生や富岡 清先生に可愛がって?頂いたが,自分自身の研究と薬学との次の接点は1986年頃である.当時森研究室では海産プロスタノイドの全合成研究が盛んであった.あくまでもその基盤技術確立を目的として,筆者はcis-シクロペンテンジオールモノ酢酸エステル(1R,4S)-3の酵素合成(Scheme 2)を検討したが,黒住精二・融 健博士や寺島孜郎先生の偉大な成果4,5)が聳え立っており,寸分の隙も感じられなかった.今でこそLEDを用いた光照射で容易に一重項酸素付加が可能であるものの,6)当時は高圧水銀灯の使用もままならず,筆者は融博士らの方法に従い7)シクロペンタジエンに臭素を付加,酢酸塩で置換してジアセタート(位置・立体異性体の混合物)を調製した.豚すい臓リパーゼで部分加水分解,分別再結晶を経て(1R,4S)-3を>99.9% eeで得ることができた.8)不要な立体異性体は酵素–化学法でリサイクルし目的化合物に収束,また酵素粉末を詰めた中圧カラムを作製し,有機溶媒中エステル交換させる循環フロー合成も達成した.それらの手法は当時ほとんど注目されなかったが,今のトレンドの先取りになったと感じている.

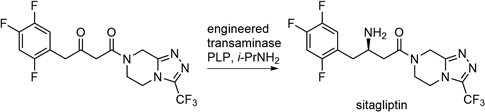
博士学位取得後,慶應義塾大学理工学部化学科(太田博道先生,鈴木啓介先生)の研究室に奉職し,更にScripps研究所に留学,Chi-Huey Wong先生の下で糖質の酵素合成を勉強した.研究室の垣根を越え,梶本哲也,池田 潔,本田 雄先生たちから糖質のイロハを教わり,幸運にも1年間で5報を公刊して意気揚々と帰国したものの,9)酵素–化学合成の師と仰ぐ,東邦大学の秋田弘幸先生から「留学時代の延長は絶対ダメ」と強く戒められた.さらに森先生の「生物活性物質合成に役立つ,汎用光学活性物質の調製」,10,11)太田先生の「美しい,ユニークな反応を実現する生体触媒の探索と解明」,12,13) Wong先生の「まるで星座・天体運行図のような,オリゴ糖の精緻かつ実用的な酵素合成」14–16)いずれとも違う,自分の方向性を目指さなければならない30歳代半ばに達していた.1990年代半ば,この研究分野で魁になろうかという三大潮流は進化工学,抗体触媒と生合成工学であった.その後三者とも大きく進歩し,例えば進化工学は目的に叶う酵素を自在に創り出す技術をもたらした.Scheme 3に示すsitagliptinは進化工学によって創製されたトランスアミナーゼで不斉合成され,これを達成したMerck社とCodexis社はアメリカ合衆国環境保護局(U.S. Environmental Protection Agency: EPA)から,Presidential Green Chemistry Challenge: 2010 Greener Reaction Conditions Awardを授与されている.
しかし1990年代末に参加したGordon会議で,後にノーベル化学賞を受賞されたArnold教授の若き日の講演を拝聴し「こういったアプローチで優れた成果を挙げるには,大きく多様な研究組織を全集中できる資金,設備やマンパワーが不可欠である.自分は違う道で生きよう」と決心し,以下に示す4つの指針に沿って研究を展開することとした.
を指針とした.筆者は「官能基・位置・立体選択的反応の開拓」特に「微生物・酵素触媒の探索,評価と機能開拓」と「化学反応・生化学反応を相乗的に活用するルートの合理的設計」に注力し,徹底的に検討・実践を繰り返し研究成果の「再現性」と説得性を目指してきた.以下,図・式を併用して概説する.
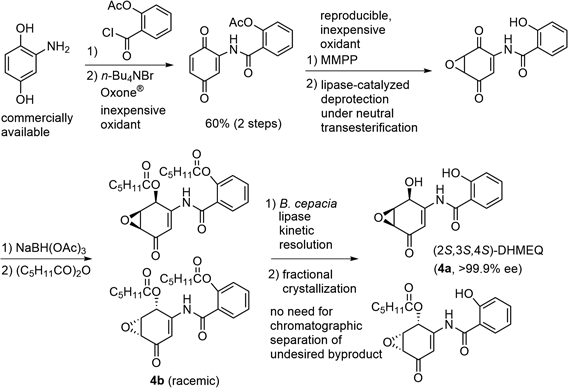
梅澤一夫先生が創製開発されたnuclear factor-kappa B(NF-κB)核内移行阻害剤dihydroxymethyl epoxyquinomicin(DHMEQ)18)は(2S,3S,4S)-4aが活性本体で,高純度・高効率で大量調製するルートが重要である.梅澤先生から電話で「須貝君は酵素を使って何でも分割するという噂だが,この化合物の分割を引き受けてくれないか?」と尋ねられた.この頃,ラセミ体基質を酵素加水分解,アシル化などによって分割し,天然生物活性物質合成の原料とする手法を,横島 聡,福山 透先生たちが大きく発展させていた中,19)筆者はScheme 4に示すルートを考案した.様々な検討を経て,安価な原料から,ラセミ体のジヘキサン酸エステル4bを調製し,酵素触媒で不要な鏡像異性体を除く「速度論的分割」を達成した.20–22)反応性・物性・合成のし易さを考慮して酵素反応の基質4bを設計しており,クロマトグラフィー精製によらず,純粋な目的物を酵素反応と分別結晶のみで大量に得た.再現性よくスケールアップ可能な経路である.
シアル酸は糖鎖生命科学の解明,インフルエンザ治療薬の両面から合成・製造が重要である.筆者はアルドラーゼ触媒下マンノサミンにピルビン酸を作用させる際,グルコ型異性体の競争阻害を世界に先駆け定量的に評価し,Scheme 5に示すN-グリコリルノイラミン酸(N-glycolylneuraminic acid: NeuGc)の合成を確立し,受託合成し和光純薬(当時)から市販・供給した.GlcNAcをManNAc(5)に異性化,放線菌培養菌体を用いた残存GlcNAcの代謝分解,アルドラーゼ作用後,ピルビン酸の酵素分解が鍵段階である.23–25)

GlcNAcの選択的分解は,放線菌Rhodococcus rhodochrousが示すニトリル水和・アミド加水分解活性(3.4節参照)を検討していた際,GlcNAcとManNAcのTLC水溶液サンプルと菌体をそれぞれ混ぜたものを,翌日展開してわかった偶然の発見だった.ところが大喜びも束の間,シアル酸やアミノ糖分野の大先達Roseman博士が,筆者が生まれる以前に同じ着想で大腸菌を用いていた26)ことを孫引きで知り肝を冷やした.しかし当該大腸菌を取り寄せ試したところ,分解の初速は大きかったもののグルコ型の完全消費は難しく,筆者らの放線菌はプロセスの堅牢性,実用性の点で圧倒した.小倉治夫・古畑公夫先生にお声がけ頂き,1996年3月に金沢で開催された日本薬学会第116年会シンポジウム(シアル酸研究会と共催)でこの成果を紹介し,またチェコのBiotrans’ 03のplenary invited lectureで講演した際には宍戸宏造先生に御激励を賜った.
Scheme 6に示す第二世代の合成では,第一三共の抗インフルエンザ薬前駆体を標的化合物とし,グルコースから,リパーゼの位置選択的反応と立体選択的閉環を組み合わせ,排他的にマンノ型基質(6)を合成するルートを実現した.27,28)アミノ糖やグリカール等単糖類の化学では,様々な学会活動を通じ,梶英輔先生に数多くの御指導を賜った.

この頃から日本プロセス化学会のシンポジウムに参加するようになり,尾野村治先生や佐治木弘尚先生始め多数の学会・産業界の方々から,真に力量ある酵素反応や合成を目指すように,と叱咤激励を受けた.そのような中,産業界と連携し,エポキシドを水和する酵素を機能開拓した.Scheme 7に示すラセミ体エポキシド7に,長瀬産業の生中雅也博士の指導の下,エポキシドヒドロラーゼ(組み換え枯草菌により生産)を作用させ速度論的分割を達成した.反応が遅い鏡像体を系内で立体反転,再結晶や母液の再利用も総合しプロセス化学レベルの調製を確立した.ジオール8から前立腺病態治療薬ビカルタミドの活性本体(R)-体の合成を達成した.29)この酵素の基質一般性や反応性を明らかにする一方,30)様々な酵素触媒と化学合成を組み合わせ,Scheme 8に示すようにDNAポリメラーゼ阻害を示すタウロスポンジンA前駆体も合成した.31)


(S)-アゼチジン-2-カルボン酸はScheme 9に示すACE阻害剤ニコチアナミン,鉄イオンキレート吸収剤デオキシムギネ酸の重要な構成成分である.ムギネ酸及び関連化合物は,難波康祐先生らの精力的研究によって,全世界のアルカリ土壌に起因する穀物の生育不良,農産製造不足を克服する大きな力になりつつあるが,32)筆者の師匠の一人北原教授も農学的見地から数多くの誘導体を合成し,33)効率よい合成法の確立が求められていた.筆者は単にラセミ体を分割するのでなく,不斉合成を相乗的に適用し,アゼチジン窒素原子にフェネチルアミンを結合させたマロンエステル10を中間体とする合成を達成した.34)不斉補助剤を分子内に導入したKrapcho脱メトキシカルボニル化は前例がなく,目的とする異性体(S)-9を優先的に生成させ,その後の酵素分割を容易にした.

体内でトリグリセリドの加水分解に与るリパーゼは,有機溶媒中でアシル–酵素複合体に対しアルコールやアミンを作用させると,様々なエステル・アミドを合成できる.35) Scheme 10に示すようにジヒドロスフィンゴシン11を脂肪酸エステル(R)-12と反応させ,抗腫瘍作用を示すシンビオラミドを合成した.36)リパーゼ触媒によるセラミド合成は世界初であり,活性アシル酵素が生成する際に脱離するメタノールが,再びアシル酵素を攻撃するのを防ぐよう,減圧下,反応性が低く揮発し難い特殊な第三級アルコールを反応溶媒として用いたのが特徴である.この経路は単一の出発原料13から化学–酵素複合法で,両合成中間体11及び(R)-12を調製した.

ラセミ体を一方の鏡像異性体に収束させる酵素的手法としては,赤井周司先生の動的速度論的光学分割やデラセミ化が名高いが,37–39)筆者は不要な鏡像異性体の再利用に関する独自の手法を,様々に開拓してきた.40)複数の不斉中心を有する化合物は,動的速度論的分割が苦手とする対象である.筆者は,抗インフルエンザ薬オセルタミビルリン酸塩の原料として有用な,シキミ酸エチルの合成を検討した.Scheme 11上段に示すように,目的とする立体化学を持つ化合物とはジアステレオマーの関係にある化合物14aを,リパーゼ触媒によるアセチル化で分割した.そしてアセチル体14b,未反応原料14aともに化学的手法で部分的に立体化学反転し,目的とするシキミ酸エチルに収束させた.41)

一般的な動的速度論的分割は反応性の高い鏡像異性体に収束するが,エステル15aを酵素加水分解・反応性が高い生成物15bが同一系内で脱炭酸し,骨格の一部が失われた化合物16が生じる.Scheme 10下段に示すように,このものを化学的手法によってラセミ体の基質15aに戻し,結果として反応性が低い鏡像異性体15bに収束させる方法(ex situ enantioconvergent approach)でラニレスタットの製造前駆体を合成した.42)
3-3. カルボニル還元酵素を用いる不斉合成の活用カルボニル還元酵素を用いる不斉合成は,医薬品や生物活性天然物合成に重要である.筆者は鎖状・環状ケトンを還元する市販の酵素43,44)を活用し,また微生物(培養全菌体)を探索,45–50)各種医薬品や合成中間体調製に応用した.探索で見い出した微生物は独占せず,すべて公的機関に供託,また乾燥菌体などとして利便性を高めた.例えば環状ケトエステル17の酵素不斉還元でヒドロキシエステル(1R,2S)-18を純粋な立体異性体として調製した.化学合成による骨格形成や不斉転写を組み合わせ,抗ウィルス作用を示すハミゲランBの形式全合成をScheme 12に示す.51,52)

さらに,Scheme 13のように分子内で中間生成物を補足できる官能基(trapping arm)を導入した基質19を分子設計,複数の反応点を制御して還元し,純粋な立体異性体20を合成した.53)このもののヘミアセタール構造をラジカルβ-開裂し,側鎖を分解してその骨格の一部はビニル基に,そして残りの部分はヒドロキシ基上のアセチル保護基に変換した.54)生成物21は2位にsp2混成炭素が直結し,第四級不斉中心を持つ.これらの特長を生かし,骨粗鬆症治療に期待されるマジンドリンAの全合成に取り組んだ.大村 智先生,砂塚敏明先生らによって報告された全合成中間体に到達した.55)

慶應義塾大学理工学部に奉職した1988年,一緒に研究した最初の卒論学生が掛谷秀昭君(現在京都大学教授,2025年度日本薬学会賞受賞)であった.彼は修士2年時に太田教授から「独自のテーマを」と任され,Scheme 14に示す,ニトリルを水和する「ニトリルヒドラターゼ」,生じたアミドをカルボン酸に変換する「アミダーゼ」の両方を有する放線菌を探索で見い出した.56,57)その後培養条件(炭素源の量,pH,誘導剤,培養時間など)を徹底的に検討し,安価な培地成分,水,種菌から48時間程度で再現性よく大量調製できるようになり,高い触媒活性・安定性を示す反応・保存条件も確立した.58,59)

Scheme 15に示すプロキラルなマロノニトリル21から,アミダーゼが示すエナンチオ場選択的加水分解によりL-methyldihydroxyphenylalanine(methylDOPA)の合成を達成した.60,61)両酵素とも中性条件で働くため分子内にボロン酸を持つ化合物22も基質として水和でき,鈴木–宮浦カップリングの後,二重結合を移動することなく,右下のジエンカルボン酸類も合成できた.62)

2008年3月に,共立薬科大学で長年ご活躍された望月正隆先生が御定年退職され,筆者はその後任として,慶應義塾大学と合併と同時に,薬学部有機薬化学講座主任教授として着任した.竹田忠紘,木内文之,杉本芳一,中村智徳,羽田紀康,菊地晴久先生を始めとする多くの方々に生薬,植物由来天然生物活性物質の重要性を教えて頂き,ポリフェノール・フラボノイドやその配糖体に,テーマを拡げることができた.しかし,これらの化合物の化学合成は100年以上の歴史があり,近年も菅 敏幸先生,忍足鉄太先生たちが達成された素晴らしい研究成果が屹立している.筆者はエステル系の保護基変換を中心課題に据えた.例えば,フラボノイドの酢酸エステルに対し,置換位置による反応性の差を使い分け,Scheme 16に示すサクラネチン,63)糖尿病合併症の治療に期待されるフィセチン64)などを単段階で合成した.その中で,これまで選択的変換が困難だった位置の脱保護に,リパーゼ触媒によるエステル交換の有効性を見い出し,セリノン63)や頭皮でメラニン産生を促進させるアカセチン65)の合成に利用した.リパーゼの反応に影響を与える基質の構造や位置選択性を明らかにし,ヒドロキノン誘導体23やナフトヒドロキノン誘導体24から,抗酸化作用を持つアルテピリンC66)やマンソノンF67)の新しい合成を達成した.本反応の温和な条件は,カテコールのように酸化され易い化合物の脱保護68)にも有効であった.

更にフェノールエステル25の脱アシル化の際,適切な塩基とケトンを添加してイサチン(26)に求核攻撃,C–C結合を生成させ,インジルビン誘導体を合成した.69)このようなenzyme-triggeredアルドール縮合の実用的応用は世界初である.
逆反応に相当するアシル化は,Scheme 17に示すようにフェノールヒドロキシ基に比べ第一級アルコールが圧倒的に優先する.チロソール(27)に対するアシル化を利用しヒドロキシチロソールの酪酸エステルを合成し,細胞死の機構解明に貢献した.70,71)また,トリオール28のアセチル化は立体障害や立体化学に大きく影響され,11-ヒドロキシステロイド脱水素酵素阻害剤,カタセラスモール類の合成に利用した.72)

フラボノイドなどポリフェノールの多くは,アグリコンより配糖体の方が天然界に豊富なことに着目し,配糖体糖鎖そのものを「保護基」として使う合成ルートを考えた.Scheme 18に示す全アセチル体29, 30をリパーゼ触媒反応の基質とすると,糖鎖部位に数多く存在する酢酸エステルは手つかずのまま,フェノール性ヒドロキシ基のみ遊離にできることを見い出し,それを手がかりに芳香環上で化学変換した.骨粗鬆症や2型糖尿病の治療に期待されるルテオリン,73)前述の活性を持つアカセチン,74)抗酸化性の高いレスベラトロール誘導体類74,75)の効率よい合成に成功した.

一方,Scheme 19に示すHIV-1侵入阻害作用を持つトリロバチン,76) breast cancer resistance protein(BCRP)トランスポーターと相互作用するmonoglycosylated 7-(β-glucosyloxy)-5-hydroxy-3′,4′-dimethoxyflavone(GOHDMF)77)の合成では,入手容易な二糖配糖体31, 32から出発し,高圧蒸気滅菌機中,酸性条件下点線で示した部分を優先的に加水分解し,単糖配糖体に変換する新しい手法を鍵段階とした.

本文や引用文献に示した多くの皆様の御指導,御鞭撻そして協働により,本学術貢献賞受賞の機会を頂くことができ,改めて心から感謝する.筆者が日本薬学会に入会したのは2007年秋で,まだ年数も少ないながら御推薦頂いた78)北里大学生命科学研究所,現・北里大学学長,砂塚敏明先生に深く御礼申し上げる.Scripps研究所留学時,近藤裕郷,青木 伸,西 剛秀,橋山富樹博士を始めとする多くの方々と交流し「薬学,医薬」の第一歩を学んだが,30年を経た授賞式で,留学当時本当にお世話になった,岩渕好治会頭から賞牌を賜り感慨を新たにした.
なお,本受賞総説寄稿先に「薬学雑誌」を選んだ理由について触れる.筆者の祖父の弟,宮坂宗麿は旧制の医学部薬学科,朝比奈泰彦先生の下で有機合成化学・天然物化学を勉強し,武田長兵衛商店にて創薬研究に従事した.年若くして他界したため,すべて親戚からの伝聞に過ぎなかったのを,研究成果が80年以上も前に薬学雑誌に公刊されていたこと79)を数年前に知った.時を超え,大叔父が目指していた薬学・化学の言葉や心・技術を知ることができる.長年にわたる日本薬学会の学会・学術誌活動に心から感謝し,更なる未来につなげるよう,自らも積極的に参加・支援いたしたい.
開示すべき利益相反はない.
本総説は,2024年度日本薬学会学術貢献賞の受賞を記念して記述したものである.