要旨
小児腎腫瘍で最も頻度が高いのはWilms腫瘍だが,生後6か月以下では先天性間葉芽腎腫(CMN)が多い.症例は2か月男児.不機嫌を主訴に来院した.腹部超音波検査により直径7 cmの右腎上極腫瘤を認めたが副腎は検出されなかった.血液検査でNSE上昇あり神経芽腫を疑ったが,MRI・CT検査により腎原発腫瘍と診断した.NSE産生Wilms腫瘍が鑑別に挙がるも,発症年齢と画像的特徴からCMNと診断した.腫瘍全摘術・右腎摘出術を行い,ETV6-NTRK3変異を伴うcellular CMNと確定診断した.切除断端は陰性でPET-CT上転移なく,追加治療は行わなかった.生後3か月以降の発症例,cellular CMNのstage III例は再発リスクが高く術後追加治療が推奨されてきたが,最近の報告でETV6-NTRK3転座陽性のcellular CMNは予後良好とされた.稀な疾患であり今後症例の蓄積が必要である.
Abstract
Wilms tumor is the most common pediatric renal mass, while congenital mesoblastic nephroma (CMN) is the most common renal tumor in neonates and infants under 6 months. We report a 2-month-old male with CMN. His chief symptom was persistent crying. Abdominal ultrasonography revealed a mass of 7 centimeters in diameter on the upper pole of the right kidney, but did not detect the right adrenal grand. Laboratory examinations revealed that his neuron-specific enolase (NSE) level was elevated, and thus neuroblastoma was tentatively diagnosed. However, MRI and CT revealed it was a renal tumor. An NSE-producing Wilms tumor was suspected, but CMN was diagnosed considering his age and radiographic characteristics. The tumor was completely resected with unilateral nephrectomy. Histological examination confirmed a diagnosis of cellular-type CMN with EVT6-NTRK3 gene fusion. Adjuvant therapy was not administered because the surgical margin was pathologically negative and no residual uptake was detected in whole-body PET-CT. An onset age ≥3 months and cellular-type CMN at stage III are risk factors for relapse; therefore, adjuvant therapy was previously recommended. However, recent reports demonstrated that patients with cellular-type CMN and ETV6-NTRK3 translocation have a good prognosis. CMN is rare and further studies are expected.
はじめに
先天性間葉芽腎腫(congenital mesoblastic nephroma; CMN)はBolandeらにより1967年に初めて報告された腎腫瘍で,新生児から乳幼児早期にみられる稀な腎腫瘍である.組織病理学的にcellular type(富細胞型),fibromatous type(線維腫型),mixed type(混合型)の3型に分類され,高い増殖能を示すcellular typeでは腫瘍内部に嚢胞性病変や壊死像および出血が認められることが多く,特徴的な遺伝子変異としてETV6-NTRK3融合遺伝子がある1–3).治療の基本は全摘術であるものの,cellular typeは遠隔転移や局所再発が報告されており,他の病型と比べ予後不良として術後化学放射線療法が推奨されていた時期もあった.しかし近年後療法を不要とする報告も発表されている.今回我々は乳児のCMNの一例を経験したので,若干の考察を交えて報告する.
症例
患者:2か月男児.
主訴:不機嫌,腹部膨満感.
出生歴:在胎37週2日,出生時体重3,282 g,仮死なく経膣分娩にて出生.
既往歴および発達歴:特記事項なし.
現病歴:妊娠経過中に羊水過多など胎児機能不全を疑う徴候や,腹部腫瘤は指摘されていなかった.来院当日夕方からの不機嫌と腹部膨満感を主訴に,当科を受診した.
初診時の身体所見:体温37.6°C,心拍数138回/分,血圧116/82 mmHg,呼吸数28回/分,SpO2(室内気)98%.
診察時には強く涕泣しており活気良好であった.右上腹部に約7 cm大の腫瘤を触知した.尿道下裂,停留精巣などの身体奇形を認めなかった.
初診時の血液検査(Table 1):血漿レニンの上昇,血清neuron specific enolase(NSE)の軽度上昇を認めたが,その他には特記すべき所見はなかった.
Table 1
血液および尿検査所見
| WBC |
15,100/μl |
BUN |
5.6 mg/dl |
Glu |
97 mg/dl |
| Neu |
40.60% |
Cre |
0.25 mg/dl |
Na |
136 mEq/L |
| Lym |
47.80% |
UA |
4.2 mg/dl |
K |
4.7 mEq/L |
| Mono |
8.50% |
AST |
3 U/L |
Cl |
105 mEq/L |
| Hb |
11.5 g/dl |
ALT |
35 U/L |
Ca |
11.0 mg/dl |
| Plt |
51×104/μl |
LDH |
471 U/L |
P |
6.7 mg/dl |
| PT-INR |
1.01 |
ALP |
619 U/L |
PRA*1 |
39 ng/ml/hr |
| aPTT |
37.0 sec |
T-Bil |
1.2 mg/dl |
PAC*2 |
4.370 pg/ml |
| Fib |
234 mg/dl |
TP |
6.0 g/dl |
cortisol |
18.9 μg/dl |
| D-dimer |
1.2 μg/ml |
Alb |
4.3 g/dl |
AFP |
583.3 ng/ml |
| FDP |
2.8 μg/ml |
CPK |
90 U/L |
s-IL2 |
1,140 U/ml |
| CRP |
0.08 mg/dl |
Amy |
15 U/L |
hCGβ |
≤0.10 ng/ml |
|
|
ferritin |
80 ng/ml |
NSE*3 |
41.8 ng/ml |
| 尿中VMA/Cre*4 |
10.0 μg/mg·Cre |
尿中HVA/Cre*5 |
17.3 μg/mg·Cre |
|
|
*1 PRA(Plasma renin activity);血漿レニン活性(正常値:0.3–2.9 ng/ml/hr)
*2 PAC(Plasma aldosterone concentration);血漿アルドステロン活性(正常値:35.7–240 pg/ml)
*3 NSE(neuron specific enolase);神経特異エノラーゼ(正常値:16.3 ng/ml以下)
*4 正常値(月齢1~3):4.5–12.7 μg/mg·Cre
*5 正常値(月齢1~3):11.9–24.3 μg/mg·Cre
腹部単純写真(Fig. 1):仰臥位にて撮影.腫瘤を触知する部位に一致して右上腹部に腸管ガス欠損を認めた.
腹部超音波検査(Fig. 2):右腎上極に接して境界明瞭な7 cm大の腫瘤を認めた.内部は不均一で,一部無エコー領域を認めた.腫瘤辺縁はring状に高エコーと低エコーの帯状構造が伸びていた.その他の腹部臓器は特記すべき異常所見なく,腹部リンパ節腫大も認めなかった.
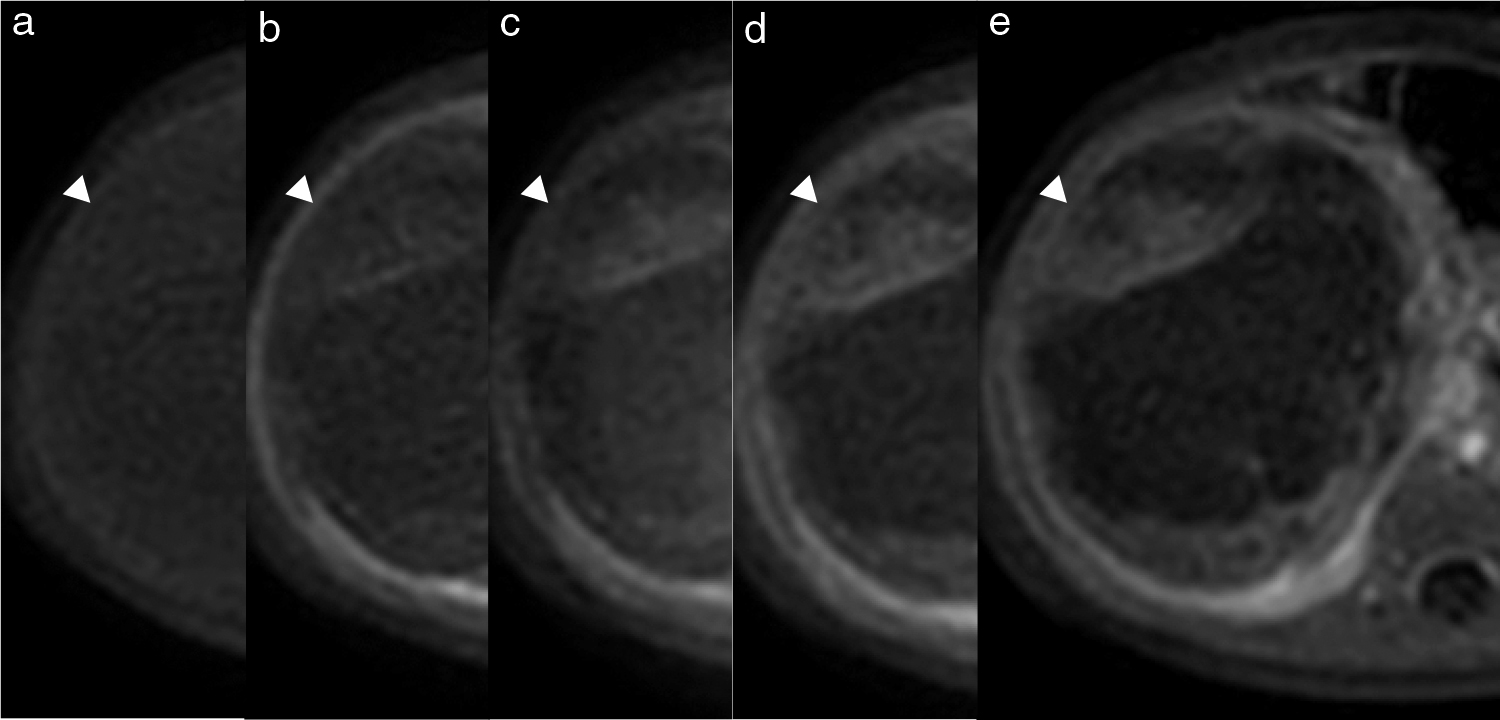
腹部MRI検査(Fig. 3, 4):右副腎の同定は困難で副腎腫瘍も鑑別に挙がったが,T2FSで腎実質との間にbeak signを認め,右腎上極由来の腫瘍と判断した.
腫瘤は辺縁の充実性部分と内部の嚢胞性部分から構成されており,辺縁の充実性部分はT1WI,T2FSにて腎皮質に対して軽度低信号を呈し,内部の液状部分はT1WIにて低信号,T2FSにて高信号を主調に一部低信号が混在する不整な信号を呈していた.液状部分には,辺縁の充実性部分より内腔へ限局性に突出する部分や,隔壁構造が認められた.DWIでは辺縁の充実性部分や内腔へ突出する部分,隔壁構造の一部に高信号(ADCは低下)を伴い,hypercellularな腫瘍が疑われた.dynamic造影(Fig. 4)では造影剤注入後65秒後までの造影効果は乏しく,120秒後から,T2FSにて腎皮質に対して軽度低信号を呈する辺縁の充実性部分や内腔へ突出する部分,および隔壁構造の一部に軽度の造影効果を認める事から,血流に乏しい腫瘍が疑われた.内部の造影効果が見られない部分は壊死性変化と考えられた.隣接臓器への直接浸潤や,病的なリンパ節腫脹を示唆する所見を認めず,転移を疑う所見も認められなかった.
腹部単純CT検査(Fig. 5):内部は不均一であり,石灰化は認められなかった.
臨床経過:右副腎が同定されずNSEが上昇している点から神経芽細胞腫が疑われたが,MRIでのbeak signにより腎腫瘍と判断した.腎原発神経芽細胞腫は非常に稀であり,尿中VMA/Cre値,HVA/Cre値が正常であった為,MIBGシンチは実施しなかった.次いで小児腎腫瘍として最も頻度が高いWilms腫瘍が疑われたが,発症年齢および画像所見からは右腎原発のCMNを第一に考え,右腎全摘術を施行した.術中所見では病的腹水や腫瘍の周囲臓器への直接浸潤や癒着は認められず,腫瘍破裂なく一塊として摘除した.右副腎は腫瘤に圧排され薄く伸びきって腫瘤に付着しており同時に摘出した.腫瘤割面は白色充実性で出血・壊死を伴っていた.術後経過は良好で血圧も89/59 mmHgと低下し,手術による合併症は無く術後7日目に退院した.自施設病理組織学的検討で紡錘形腫瘍細胞がびまん性に増殖し核分裂像が目立ち,腫瘍は被膜外および腎洞の軟部組織にも認めたものの,切除断端は陰性であり,stage IIと診断した.CD-99が弱陽性となりEwing’s sarcoma family of tumorsとの鑑別も挙がったが,小児固形腫瘍観察研究による中央組織診断にてCMNと診断された.組織標本を用いたRT-PCR法による検索でEVT6-NTRK3融合遺伝子が検出され,CMN(cellular type)と確定した.CTおよびMRIでは転移を示唆する所見を認めず,PET-CTは自施設に設備が無かったため術後に施行し転移や残存病変が無いことを確認した.術後の化学放射線治療は施行せず経過観察中であるが,術後6か月再発を認めていない.腹部超音波検査,MRI検査を用いて局所再発や遠隔転移の有無をフォローする方針である.
考察
CMNは腎由来の先天性腫瘍であり,多くは画像上境界明瞭な腫瘤として描出される.内部均一で血管浸潤を伴わないclassic typeに対して,出血・壊死・嚢胞成分により内部不均一な像を示し,血管や隣接臓器への浸潤を認める場合はcellular typeを類推させる4).超音波検査で腫瘍周囲を取り巻く同心円状のring signを認めることがclassic typeに特徴的とされるが,本症例のようにcellular typeやmixed typeでも認める事がある4).腫瘤内部に石灰化を伴うことは少ない.鑑別を要する腫瘍としてWilms腫瘍,腎明細胞肉腫,ラブドイド腫瘍,嚢胞性腎腫/嚢胞性部分的分化型腎芽腫などが挙げられる4).Wilms腫瘍は壊死や陳旧性出血を反映した内部不均一な充実性腫瘍の像を呈し,石灰化を15%に認める.血管浸潤性が高く腎静脈・下大静脈のみならず右心系に到達するような腫瘍伸展や肺転移を認める場合があるが,骨転移は稀である.腎明細胞肉腫も同様に充実性腫瘤だが嚢胞部分を伴う事が多く,石灰化は稀である.遠隔転移が5~18%の症例で認められ,特に骨転移は腎明細胞肉腫を示唆する.ラブドイド腫瘍は腎髄質から発生した多房性充実性腫瘤で,70%に石灰化を認める.出血や壊死を反映した被膜下液体貯留を認めることが多いが非特異的所見であり,疾患頻度を考慮すると被膜下液体貯留を伴う小児腎腫瘍を認めた場合はWilms腫瘍の可能性が高い.ラブドイド腫瘍の80%は進行例で発見され肺や骨への転移が多く,中でも脳腫瘍合併は特徴的とされ15%に認める.嚢胞性腎腫/嚢胞性部分的分化型腎芽腫もこの年代に鑑別すべき腫瘍の1つとされるが,隔壁以外は充実成分を伴わない多房性の腫瘍として描出されるため画像的鑑別が可能である4).
上述のように鑑別を要する疾患は多岐にわたるものの,CMNに特異的といえる画像所見は乏しく画像のみによる確定診断は困難であるが5),発症年齢は術前診断の参考となる6).CMNは生後6か月以下に認める腎腫瘍の中では最も頻度が高く,大半が生後3か月以内に発見される.小児腎腫瘍で最も多いWilms腫瘍の場合は発生ピークが2~3歳で生後3か月未満に限定すると少なく,腎明細胞肉腫も発症年齢は1~4歳で生後6か月未満の発症は稀である4).ラブドイド腫瘍は疾患自体が稀である上に,80%が2歳未満に発症するもののピークは生後11か月とされる.以上から,生後2か月に発症し周囲組織への浸潤や遠隔転移を認めない本症例は術前にCMNを第一に疑った.
治療に際しては,外科的切除がいかなる組織型のCMNにおいても第一選択となる.CMNでは腫瘍を一塊として摘出し,切除断端が陰性であれば予後良好であるが,CMNの中でcellular typeは局所再発や遠隔転移のリスクとされ,術後化学放射線療法の併用を考慮する必要がある5).しかし,Vokuhl C et al.による100例を越える最近の報告では,ETV6-NTRK3融合遺伝子変異を有するcellular type CMNはETV6-NTRK3発現を伴わないcellular type CMNと比較して5年寛解率が有意に高いことが示された6).そのためcellular typeであってもETV6-NTRK3融合遺伝子変異を有する症例では腫瘍の完全摘除が得られれば予後良好と考えられる.本症例は手術により腫瘍は破裂することなく一塊として摘除しえたCMNであり,遠隔転移や被膜を超えた浸潤を認めず,切除断端は陰性であったため,stage IIと診断した.Stage III以上のcellular type CMNでは追加化学療法が推奨されているがstage IIは手術療法のみとされており,本症例では追加療法を実施しなかった.後日ETV6-NTRK3融合遺伝子の発現が確認されたため,予後良好群と判断した.
局所再発が術後6か月以内に,遠隔転移が術後1年以内に生じることが多いとされている.CMNが脳,肺,心臓,肝臓,骨へ遠隔転移したという報告があるため,術後のフォローアップでは定期的な全身検索が必要と考えられる5).本症例では腹部超音波および全身MRI検査を用いて局所再発や遠隔転移を監視する方針とした.
結語
ETV6-NTRK3融合遺伝子の発現を認めるcellular type CMNの早期乳児例を経験した.画像検査のみでの確定診断は困難だが,腹部超音波検査,CT,MRIを組み合わせることにより腫瘍の由来臓器と性状,および隣接臓器浸潤や遠隔転移の有無を正確に把握し,発症年齢からCMNを第一に疑い外科的治療に臨むことができた.2018年の100例を超える報告6)では,ETV6-NTRK3融合遺伝子の発現を認めるcellular typeは予後良好とされ,術後化学放射線療法は不要である可能性がある.病期と組織亜型から治療法を選択し,ETV6-NTRK3融合遺伝子の発現の有無により追加治療を検討する必要がある.
日本小児放射線学会の定める利益相反に関する開示事項はありません.
謝辞
中央病理診断および遺伝子解析を迅速に実施していただいた国立成育医療研究センター病理診断部の大喜多肇先生,田中裕吉先生に深謝いたします.
文献
- 1) 櫻井 礼, 西尾 知子, 黒田 誠:先天性間葉芽腎腫,富細胞型の1例.診断病理 2004; 21(4): 333–335.
- 2) Bisceglia M, Carosi I, Vairo M, et al.: Congenital mesoblastic nephroma: Report of a case with review of the most significant literature. Pathol Res Pract 2000; 196: 199–204.
- 3) Bayindir P, Guillerman RP, Hicks MJ, et al.: Cellular mesoblastic nephroma (infantile renal fibrosarcoma): Institutional review of the clinical, diagnostic imaging, and pathologic features of a distinctive neoplasm of infancy. Pediatr Radiol 2009; 39(10): 1066–1074.
- 4) Ellen MC, Adam RG, Richard MG: Renal tumors of childhood: Radiologic-pathologic correlation part 1. The 1st decade. RadioGraphics 2016; 36(2): 499–522.
- 5) Anunobi CC, Badmos KB, Onyekwelu VI, et al.: Congenital mesoblastic nephroma in a premature neonate: A case report and review of literature. Niger J Clin Pract 2014; 17(2): 255–259.
- 6) Vokuhl C, Nourkami-Tutdibi N, Furtwängler R, et al.: ETV6-NTRK3 in congenital mesoblastic nephroma: A report of the SIOP/GPOH neproblastoma study. Pediatr Blood Cancer 2018; 65: e26925.