2021 Volume 3 Issue 5 Pages 281-290
2021 Volume 3 Issue 5 Pages 281-290
要旨:【目的】Proton pump inhibitor(以下,PPI と略)を使用した急性期脳卒中患者において,アミノ酸源が低分子ペプチドであり,食物繊維としてペクチンを含有する経腸栄養剤(以下,HE と略)とアミノ酸源がたんぱく質であり,食物繊維としてグアーガム分解物を含有する経腸栄養剤(以下,PF と略)が腸内細菌叢に及ぼす影響を検討した.【対象および方法】脳卒中後 2 週間に経腸栄養と PPI 投与を行う患者を対象とした前向き観察研究を行った.26 例を HE 群と PF 群の 2 群に分け,観察前後で T-RFLP 解析による腸内細菌叢と糞便理化学分析を比較した.【結果】観察後両群でClostridium cluster Ⅺが有意に減少した.便 pH は HE 群で PF 群よりも低下する傾向がみられた.【結論】急性期脳卒中患者において食物繊維が配合された経腸栄養剤を使用することで,PPIを併用していたとしてもClostoridioides difficile 感染症のリスクが抑制される可能性が示唆された.
Objective: The aim of this prospective observational study was to compare the effects of a formula containing pectin as dietary fibers and peptides as a source of amino acids (HINE E-GEL®: HE) and the effect of a formula containing guar gum as dietary fibers and proteins as a source of amino acids (polymeric formula: PF) on gut microbiota in patients using a proton pump inhibitors (PPI).
Subjects and Methods: We selected 26 patients who had been receiving intragastric tube feeding with a PPI for at least 2 weeks after the onset of stroke. They were divided into two groups to receive either HE (n=12) or PF (n=14). The composition of the fecal microbiota and the fecal metabolc products were evaluated using terminal restriction fragment length polymorphism(T-RFLP) analysis before and after enteral nutrition.
Results: There was a significant decrease in Clostridium cluster XI bacteria in both the HE and PF groups after observation period of 2 weeks. SCFA tended to be higher, while the fecal pH tended to be lower, in the HE group compared with the PF group.
Conclusion: These results indicate that dietary fiber-containing enteral nutrition plays a role in the suppression of Clostoridioides difficile infection in patients in the acute stage of stroke who use a PPI. The findings also suggest that HE maintains a lower pH environment beneficial for gut microbiota compared with PF.
Proton pump inhibitor(以下,PPI と略)は世界中で広く使用されている胃酸分泌抑制剤であり,逆流性食道炎をはじめ多くの疾患に対する有効性が証明されている.脳卒中急性期においても,消化管出血のリスク予防として多くの患者に使用されている.しかし,PPI の使用によって胃酸分泌が抑制されると,腸内 pH が上昇することで Clostoridioides difficile 感染症(以下,CDI と略) を起こすことがあると報告されている.この PPIと CDI の関連性は完全には証明されていないが, 2012 年には FDA から警告がでており 1),2017年に米国消化器病医学会から PPI 長期使用における適正使用ガイドラインが発表されている 2).しかし,脳卒中の急性期治療時においては,現在も一般的に消化管出血のリスク予防としてPPI が投与されている.これは急性期脳卒中患者では,消化管出血が重症となるケースが多いとの報告があるためであり,消化管出血に対するリスク予防が優先されている現状がある 3).また,脳卒中急性期には,経口からの栄養摂取が困難なケースが多く,経腸栄養剤を使用した経管栄養管理が一般的に実施されている.半消化態経腸栄養剤が広く使用されているが,重症脳卒中患者に対する PPIの胃酸分泌抑制効果による消化・吸収機能への影響は未だ不明な点が多く,経腸栄養剤の種類が腸内細菌叢に及ぼす影響に関する報告は少ない.
そこで今回我々は,急性期脳卒中患者のうち,経管栄養管理に加えて PPI 投与を実施する患者に対して,経腸栄養剤が腸内細菌叢に及ぼす影響に関する前向き観察研究を実施した.
2019年1月1 日から 2020年6月 30 日までに,社会医療法人陽明会小波瀬病院(以下,当院と略)にくも膜下出血を除く脳卒中発症で入院した 20歳以上の患者のうち,入院時に PPI を非使用かつ 2 週間以上の経鼻経管栄養管理と PPI 投与を実施することが想定される患者を対象とした.重篤な肝障害,腎障害のある患者,および大豆,ゼラチン,乳成分に対するアレルギー既往歴のある患者,重度の糖尿病患者,腸管機能が著しく低下している患者,化学療法,放射線療法を実施している患者,早期に経口摂取が期待できる患者,研究責任者が不適当と判断した患者は本試験から除外した.なお,何らかの理由により 2 週間以内に経鼻経管栄養管理から離脱した場合,および肺炎等により観察期間中に抗菌薬を使用した場合は脱落とし,解析対象外とした.
2.2 試験品本研究では,当院で使用している 2 つの経腸栄養剤,アミノ酸源が低分子ペプチドであり,食物繊維としてペクチンを含有する経腸栄養剤「ハイネイーゲル ®(株式会社大塚製薬工場)」(HINE E-GEL®;以下,HE と略),アミノ酸源がたんぱく質であり,食物繊維としてグアーガム分解物を含有する経腸栄養剤「ハイネバッグ(株式会社大塚製薬工場)」(polymeric formula;以下,PF と略)を用い,それぞれの対象者を HE 群,PF 群の 2群に分けた(表 1).その使用方法や投与方法に違いは設けておらず,選択は各担当医の判断で行われており,本研究でも意図した割付は実施しなかった.なお,当院における過去の使用実績では,脳卒中患者に対する両製品の使用量は同程度であった.PPI は,ランソプラゾール 30 mg/ 日を使用し,静脈注射または経管より投与した.
| 使用製品 | HE | PF |
|---|---|---|
| 容量(mL) | 125 | 100 |
| たんぱく質(g) | 4.0 | 5.0 |
| 脂質(g) | 2.2 | 2.3 |
| 炭水化物(g) | 16.8 | 15.7 |
| 食物繊維(g) | 1.38 | 1.42 |
| ペクチン | グアーガム分解物 ラクトスクロース | |
| 浸透圧(mOsm/L) | 約 360 | 約 370 |
観察期間は入院時より経管栄養管理を離脱するまでとした.観察期間中は,ブリストル便形状スケール(以下,BS スコアと略)を用いた便性状,経管栄養からの 1 日のエネルギー投与量,経口摂取状況,薬剤使用状況を調査した.BS スコア 6, 7 を下痢とし,観察日数から 1 日の平均回数を算出した.なお,当院の基準により,排便がない日が 3 日以上続いた際は,刺激性下剤投与あるいは浣腸,摘便を実施した.また,観察期間中は,言語聴覚士の判断による嚥下訓練食品の併用を可とした.
採便は,研究対象者より入院後初回便(以下,観察前と略)と経管栄養 2 週間投与後の便(以下,観察後と略)の 2 回実施し,腸内細菌叢および糞便理化学検査を実施した(検査:株式会社テクノスルガ・ラボ).観察前の採取は入院後 4 日までとし,観察後は経管栄養管理から離脱した日の前後 3 日以内に実施した(図 1).
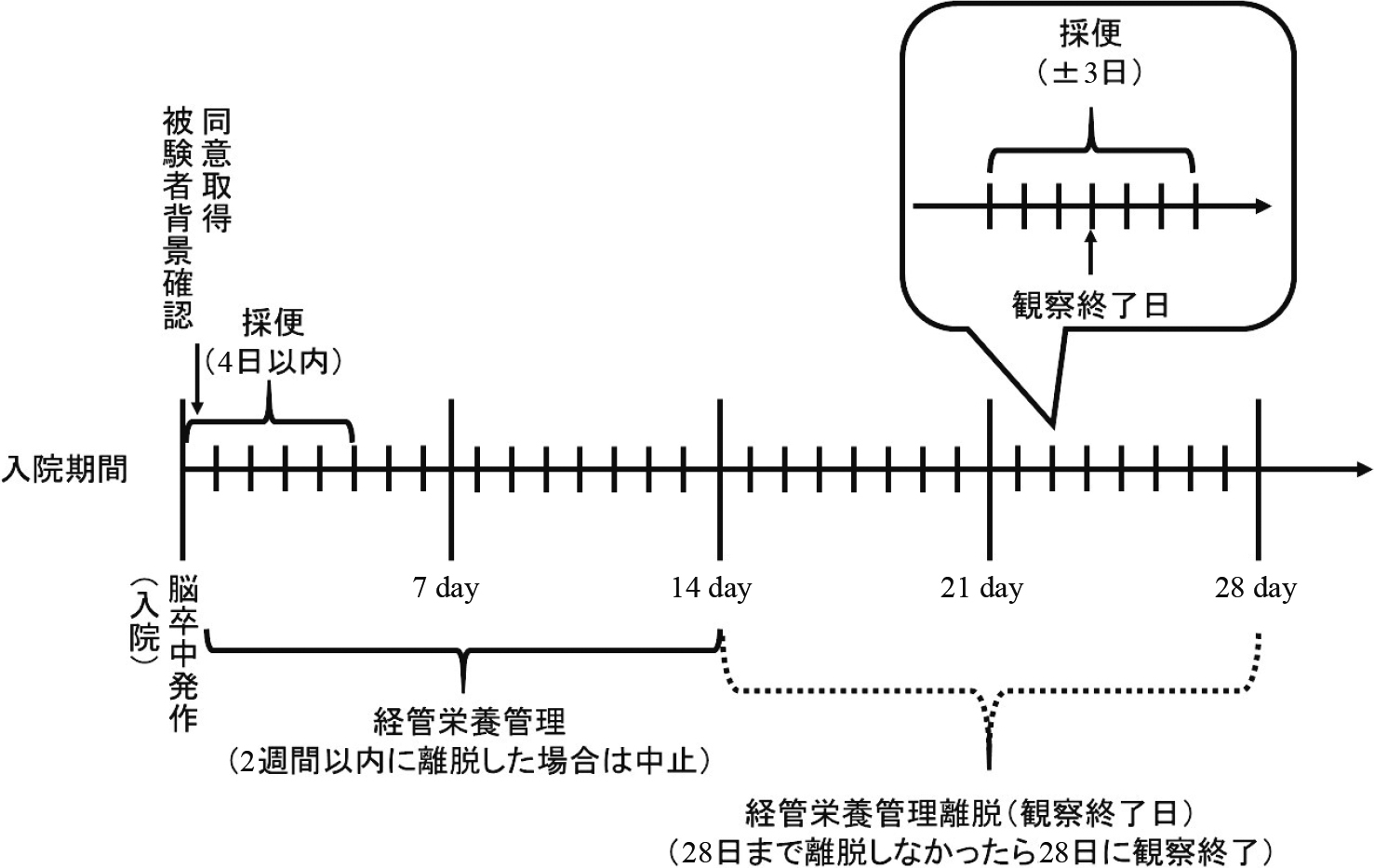
試験スケジュール
糞便細菌叢の測定は,T-RFLP(terminal restriction fragment length polymorphism)解析による Nagashima 法を用いた.主要評価項目は,腸内細菌叢における Clostoridioides difficile(以下,C. difficile と略) が属する Clostridium( 以下,C. と略)cluster Ⅺの割合とした.副次評価項目はその他の各菌類の割合,糞便中短鎖脂肪酸量(酢酸,プロピオン酸,n-酪酸,その他),糞便 pHとした.
2.5 統計解析統計解析は脱落例を除く観察期間 2 週間以上の症例を対象とした.主要評価項目と副次評価項目の解析は,観察前後,群間についてそれぞれ Wilcoxon の符号付順位検定,対応のない t 検定にて行った.なお,患者背景は Fisher の直接確率検定,対応のないt 検定にて行った.有意差は 5%以下,有意水準は両側 1%とした.解析にはIBM SPSS® Statistics(Ver.25)を使用した.
2.6 倫理的配慮被験者(被験者の同意取得が困難な場合は家族)には,研究内容について文章と口頭により十分に説明を行ったうえで,文書による同意を取得した.本研究は,「医療法人社団服部クリニック倫理審査委員会」による承認(承認番号;O1812-P17)を受け実施された.(UMIN;000035427)
観察期間中,脳卒中発症によって当院に入院した患者のうち,30 名より同意を取得した.HE 群で 2 名,PF 群で 1 名が観察期間中に抗菌薬を使用し,PF 群で 1 名が合併症のため経管栄養中止となり脱落した.観察期間中に同意の撤回はなく,最終的に HE 群 12 名,PF 群 14 名であった.患者背景を表 2 に示す. 性別, 年齢,body mass index(以下,BMI と略),疾患内訳,観察前 BSスコアに関して群間による差はなかったが,National institutes of health stroke scale( 以 下, NIHSS と略)のみ PF 群で高かった.一般的に NIHSS17 点以上は重症例であり,経口摂取は困難となることが多いため,今研究における腸内細菌叢評価の比較に対する影響は少ないと判断した.観察期間(日),経管栄養エネルギー量(kcal/日)に関しては群間に差はなく,経管栄養の中止や減量も確認されなかった.観察後 BS スコアは PF 群で低かったが,下痢頻度,下剤使用患者割合とともに有意差はなかった.糞便理化学検査において HE 群で 1 名のみ初回糞便量が少量であったために測定限界値を下回り,対象者が 11 名となった.また,HE 群の一部で嚥下訓練食品を併用したが,全エネルギー中での割合は低いため,影響は極めて小さいと判断した(表 2).
| HE群n = 12 | PF群n = 14 | p値 | |
|---|---|---|---|
| 性別M/F(人) | 6/6 | 8/6 | 1.00*1 |
| 年齢(歳) | 77.1 ± 15.5 | 77.0 ± 11.6 | 0.99*2 |
| BMI(kg/m2) | 24.1 ± 2.8 | 23.7 ± 4.4 | 0.84*2 |
| 疾患内訳 脳梗塞/脳出血(人) | 8/4 | 9/5 | 1.00*1 |
| NIHSS | 16.9 ± 9.2 | 23.3 ± 5.0 | 0.04*2 |
| 観察前ブリストルスケール | 5.3 ± 1.5 | 4.1 ± 1.3 | 0.06*2 |
| 観察期間(日) | 16.4 ± 1.5 | 16.1 ± 1.5 | 0.75*2 |
| 経管栄養エネルギー(kcal/日) | 731.9 ± 118.1 | 722.9 ± 78.6 | 0.83*2 |
| 経口摂取エネルギー(kcal/日) | 25.3 ± 46.4 | 0 | ― |
| 観察後ブリストルスケール | 5.8 ± 0.4 | 4.5 ± 2.0 | 0.05*2 |
| 下痢頻度(回/日) | 0.7 ± 0.7 | 0.7 ± 0.5 | 0.80*2 |
| 下剤使用患者割合(%) | 50.0 | 28.6 | 0.42*1 |
(平均±標準偏差) *1:Fisherの正確確率検定,*2:対応のないt検定
NIHSS:NationalInstitutesofHealthStrokeScale
両群の腸内細菌叢の占有率の変化を表 3 に示す.C. cluster Ⅺは観察後両群とも有意に減少(HE 群 3.4 ± 4.2% → 0.2 ± 0.3% , p=0.01;PF群 1.8 ± 2.5%→ 0% , p <0.01)し,多くの症例では検出限界値以下(HE 群 12 名中 9 名,PF 群 14名中 14 名)であった(図 2).観察前,観察後共に群間に有意差はなかった.
| 菌群 | HE群(n = 12) | PF群(n = 14) | p値*2 | |||||
|---|---|---|---|---|---|---|---|---|
| 観察前 | 観察後 | p値*1 | 観察前 | 観察後 | p値*1 | 観察前 | 観察後 | |
| Bifidobacterium | 12.2 ± 14.2 | 6.5 ± 8.7 | 0.04 | 12.7 ± 15.3 | 9.5 ± 13.3 | 0.88 | 0.93 | 0.52 |
| Lactobacillales目 | 8.8 ± 6.1 | 6.2 ± 4.2 | 0.24 | 6.7 ± 10.9 | 5.6 ± 8.3 | 0.51 | 0.57 | 0.82 |
| Bacteroides | 15.3 ± 12.5 | 27.8 ± 20.5 | 0.06 | 14.9 ± 10.9 | 33.8 ± 15.7 | 0.01 | 0.92 | 0.43 |
| Prevotella | 0.1 ± 0.3 | 0.7 ± 1.6 | 0.18 | 0.7 ± 1.8 | 1.0 ± 1.8 | 0.75 | 0.26 | 0.64 |
| Clostridium cluster IV(Ruminococcaceae科) | 8.2 ± 10.7 | 4.3 ± 4.1 | 0.24 | 12.3 ± 9.9 | 8.5 ± 8.1 | 0.10 | 0.34 | 0.12 |
| Clostridium cluster XIVa(Lachnospiraceae科) | 20.3 ± 6.2 | 24.8 ± 9.3 | 0.35 | 23.5 ± 6.7 | 18.1 ± 8.4 | 0.06 | 0.24 | 0.08 |
| Clostridium cluster IX(Negativicutes綱) | 4.9 ± 9.1 | 9.4 ± 13.8 | 0.40 | 6.6 ± 11.6 | 2.4 ± 5.0 | 0.42 | 0.70 | 0.13 |
| Clostridium cluster XI(Peptostreptococcaceae科) | 3.4 ± 4.2 | 0.2 ± 0.3 | 0.01 | 1.8 ± 2.5 | 0 | <0.01 | 0.32 | 0.10 |
| Clostridium cluster XVIII(Erysipelotrichaceae科) | 1.4 ± 1.5 | 1.6 ± 2.3 | 0.72 | 1.3 ± 1.5 | 1.4 ± 2.5 | 0.33 | 0.82 | 0.83 |
| others | 25.4 ± 14.6 | 18.5 ± 13.4 | 0.10 | 19.6 ± 10.4 | 19.7 ± 15.2 | 0.930 | 0.26 | 0.84 |
*1:Wilcoxonの符号付順位検定,観察前vs観察後 *2:対応のないt検定,HE vs PF

Clostridium cluster XI占有率の変化
HE 群で Bifidobacterium が観察後に低下し(p=0.04),PF 群でBacteroides が増加した(p=0.01)が,他の項目に有意差はなかった(表 3).また,観察前,観察後共にすべての項目で群間に有意差はなかった.
3.4 短鎖脂肪酸および便 pH短鎖脂肪酸は観察前,観察後共に群間で有意な差はなかったが,HE 群では増加傾向であり,PF群では減少傾向(HE 群 6.8 ± 3.9 mg/g → 8.1 ± 2.7mg/g, p=0.33;PF 群 9.3 ± 5.4 mg/g → 7.4 ± 4.4mg/g, p=0.22)であった(表 4).なお,短鎖脂肪酸の中では PF 群で n-酪酸が低下した(p=0.04).便 pH は観察前の群間において差はなかったが,観察後 HE 群は PF 群と比べて低下傾向(HE 群 7.27 ± 0.50 → 7.10 ± 0.48, PF 群 7.26 ± 0.68 → 7.39 ± 0.58, p=0.22)にあった(図 3).
| HE 群(n = 11)a | PF群(n = 14) | p値*2 | ||||||
|---|---|---|---|---|---|---|---|---|
| 観察前 | 観察後 | p値 *1 | 観察前 | 観察後 | p値*1 | 観察前 | 観察後 | |
| 酢酸 | 3.1 ± 1.8 | 4.2 ± 1.9 | 0.33 | 4.5 ± 2.7 | 3.6 ± 1.9 | 0.11 | 0.17 | 0.42 |
| プロピオン酸 | 1.2 ± 0.7 | 1.8 ± 0.6 | 0.09 | 1.7 ± 1.4 | 2.0 ± 1.9 | 0.55 | 0.32 | 0.77 |
| n-酪酸 | 1.2 ± 0.8 | 1.0 ± 0.4 | 0.93 | 1.7 ± 1.4 | 0.9 ± 0.6 | 0.04 | 0.28 | 0.64 |
| others | 1.3 ± 0.9 | 1.1 ± 0.6 | 0.72 | 1.3 ± 0.9 | 1.0 ± 0.5 | 0.07 | 1.00 | 0.73 |
| total | 6.8 ± 3.9 | 8.1 ± 2.7 | 0.33 | 9.3 ± 5.4 | 7.4 ± 4.4 | 0.22 | 0.24 | 0.69 |
*1:Wilcoxonの符号付順位検定,観察前vs観察後 *2:対応のないt検定,HE vs PF
a:1例のみ初回便が少量により測定限界値を下回ったため除外した.

便pHの変化
Wilcoxonの符号付順位検定,観察前vs観察後,対応のないt検定,HE vs PF
HE群7.27 ± 0.50→7.10 ± 0.48,PF群7.26 ± 0.68→7.39 ± 0.58
a:1例のみ初回便が少量により測定限界値を下回ったため除外した.
今回の調査では,脳卒中患者に PPI と経腸栄養剤を投与した前後で腸内細菌叢を解析し,以下の 2 つの知見を得た.第 1 に,2 種類の経腸栄養剤は C. cluster Ⅺを減少させた.第 2 に,HE 群では PF 群よりも便 pH が低下傾向にあった.
第 1 に,2 種類の経腸栄養剤は C. cluster Ⅺを減少させた.C. cluster ⅪにはC. sordellii,C.bifermentans,C.difficile などの 6 種と 1 グループが属する.前者 2 種はヒト大腸に存在するとしてよく知られているが,C.difficile は若年成人には少ないことが報告されている 4).これまでに PPI投与下では,腸内細菌叢の均等度と多様性が有意に低下する 5)6)ことや,4 週間の PPI 服用で Lactobacillus 属や Streptococcus 属が増加したとの報告があり 7),特に CDI は非 PPI 服用患者と比べて 2 倍まで増加することが報告されている 8).ところが今回の調査では,PPI 服用下にも関わらずC. cluster Ⅺが観察後にはほぼ消失しており,他の細菌叢に大きな変化がみられなかった.このことは,経腸栄養剤により腸内細菌叢の悪い乱れ(dysbiosis)が防がれた可能性があることを示唆している.
ヒトにおいては,プレバイオティクス摂取により Bifidobacterium 属などの有用細菌が増加し, Clostridium 属などの有害細菌が減少することが明らかにされている.特にプレバイオティクスのうちオリゴ糖類においては,多くの Bifidobacterium 属細菌が資化性を示す一方で,ほとんどの Clostridium 属細菌は資化性を有していないことが報告されている 9).本研究では Bifidobacterium は増加しなかったものの C. cluster Ⅺが減少したことから,両経腸栄養剤に配合されている食物繊維がプレバイオティクスとして寄与したと推測される.ただし,食物繊維の効果は報告により大きく異なっていることに注意したい.経管栄養中の要介護高齢者にビフィズス菌増殖促進物質を含有する乳清発酵物を摂取させた研究では,2 週間で Bifidobacteria が有意に増加したとの報告があり 10),健常者を対象にした多くのランダム化比較試験(randomized controlled trial; 以下, RCT と略)でも,食物繊維としてオリゴ糖や難消化性でんぷん,イヌリン等を用いて Bifidobacteria が増加したことが報告されている 11).一方で,経腸栄養剤に含まれる食物繊維が腸内細菌叢に与える影響を調査した大規模な研究は少なく,研究結果も Bifidobacteria は不変あるいは減少,短鎖脂肪酸は不変あるいは増加と一定していない.さらに食物繊維による下痢の頻度は重症患者では変わらなかったとの報告もある 12).このように食物繊維が及ぼす腸内細菌叢への影響は病態によって大きく異なることが伺える.本研究結果が,食物繊維が要因であることは推測の域を出ないが,少なくとも重症脳卒中患者の急性期において,食物繊維を含む経腸栄養剤を使用することにより,PPI 使用時でも CDI のリスク増加が抑制される可能性が示唆されたことは臨床的に大きな意義がある.近年では脳卒中患者での腸内細菌叢の変化に関する報告も増えてきている.Yamashiro らは急性期脳梗塞患者において,外来通院患者よりも Lactobacillus ruminis と Atopobium cluster が多く,Lactobacillus sakei subgroupが少なかったと報告している 13).また,Yin らは腸内細菌関連代謝物である trimethylamine N-oxide(以下,TMAO と略)が無症候性患者よりも低かったと報告している 14).一方で,高血圧症をもつ初発脳卒中患者では TMAO と正の相関があったとの報告もある 15).いずれの報告においても脳梗塞患者で dysbiosis が起こっていることを指摘している.さらにマウスを使った研究では,脳梗塞自体が粘膜層の細菌叢を大きく破綻させたと報告されている 16).脳卒中と腸内細菌叢との関係は単純ではないものの,代謝や炎症に関連があることは想像に難くない.また,脳卒中後亜急性期に経管栄養から経口摂取へ切り替えた症例では,口腔内と腸内の細菌叢に変化がみられ,特に口腔内細菌叢が劇的に改善したとの報告もある17).脳卒中後の肺炎合併の多くはこのような bacterial translocation が影響していることが推測される.そのため本研究結果によると,脳卒中患者において急性期のみならず管理期間中は,食物繊維を含む経腸栄養剤を投与することにより bacterial translocation を予防し,肺炎の合併率を下げることができる可能性がある.
第 2 に,観察後に HE 群では PF 群よりも便pH が低下傾向であった.HE はアミノ酸源が大豆ペプチドとコラーゲンペプチドである栄養剤であり,食物繊維としてペクチンを含有し,対して PF はアミノ酸源がタンパク質である半消化態タイプであり,食物繊維としてグアーガム分解物を含有している.ペクチンは植物の細胞壁に含まれる複合多糖体であり,増粘安定剤としても使われる水溶性食物繊維である.水溶性食物繊維は腸内細菌により発酵し,短鎖脂肪酸を産生する.ペクチンからは酢酸が最も多く産生され,ついでプロピオン酸,酪酸が産生される 18).これらの短鎖脂肪酸が腸内 pH を低下させ,有害細菌である C.difficile等の抑制に影響すると考えられている.今回の結果では,有意差はないものの HE 群では観察後に短鎖脂肪酸が増加する傾向にあり,便 pH は PF 群と比べて低下傾向にあった.また, PF 群において n-酪酸が有意に低下していた.この点において,HE は PF よりも腸内細菌叢のバランスを保つことに有利に働くのではないかと考えられる.今回,HE 群で Bifidobacterium が減少したことや PF 群で Bacteroides が増加したことから,HE と PF では腸内細菌叢への影響に違いがあることが示唆される.便性状に関して,本研究では下痢の頻度に有意差はなかったが,HEが PF よりも下痢等の排便トラブルが少なかったという報告がある 19).アミノ酸源の違いがどのように影響したかは調査できなかったが,使用する経腸栄養剤の種類,含有する食物繊維によって腸内細菌叢に及ぼす影響が異なる可能性があることが示された.
PPI は強力に胃酸分泌を抑制することで逆流性食道炎や消化性潰瘍に対する治療薬として高い有効性を示す.欧米では急性期脳卒中の 1.5~3%が消化管出血を起こすのに対し,台湾では 7.8%とアジア人に頻度が多いことが示されている 3)20).日本人の低用量アスピリン服用者のうち,6.5%に十二指腸潰瘍,29.2%にびらんが発生することも報告されている 21).そのため,特に高齢や重症の脳卒中患者では,上部消化管出血予防として抗潰瘍剤が使用される.脳卒中ガイドライン 2015 では,H2 受容体拮抗薬の予防的投与を考慮しても良いとされている 22)が,実臨床ではその効果と使いやすさからPPI が頻用される.しかし, PPI により胃酸の殺菌作用が減弱することで,口腔内細菌が胃を通過して小腸に侵入,最終的に腸内細菌叢に変化を及ぼす.前述の Lactobacillus属や Streptococcus 属は口腔内に多くみられる菌種である.このように強酸の胃酸バリアは外部からの病原菌の侵入を防ぐ重要な役割を持っている.したがってハイリスクな患者においては,消化管出血を予防しながらも腸内細菌叢のバランスを保つ必要がある.今回,食物繊維,特にペクチンが配合された経腸栄養剤が投与された HE 群において,PPI 投与下でも便 pH の低下傾向を示し,C. cluster Ⅺの増加を抑えたことは,経腸栄養剤が dysbiosis を防ぐプレバイオティクスの役割を担う可能性を示唆した意義深いものである.
なお,本研究には 3 つの限界がある.第 1 に RCT ではなく観察研究であること.精度の高い結論を得るためには RCT において再検証する必要がある.第 2 に腸内環境分析に Nagashima 法を用いたため,正確な C.difficile の評価ができなかったこと.次回はアンプリコンシーケンス解析を用いて評価することを検討している.第 3 に観察期間が 2 週間程度と短く,先行研究で多い 4 週間以上の長期間 PPI 服用下と同条件での比較ができないこと.これについては,腸内細菌叢は極端な食事内容の違いがあれば短期間でも細菌叢が変化することが報告されているため 23),本研究結果は十分に参考になると考える.
本研究では,経腸栄養剤の種類によって腸内細菌叢への影響が異なることが示された.特にペクチンが配合された経腸栄養剤は PPI 投与下でも便 pH を低下させ CDI の増加を防ぐ可能性が示唆された.経口摂取困難な急性期から経腸栄養剤を用いて dysbiosis を防ぐことによって,その後の合併症の頻度を減らすことができると期待する.今後症例を増やし,高リスクな PPI 投与患者においても更なる検討をしたいと考えている.
急性期脳卒中患者の栄養管理において,食物繊維が配合された経腸栄養剤を使用することで, PPI を併用していたとしても CDI の増加が抑制される可能性が示唆された.
本研究は,株式会社大塚製薬工場と研究契約を締結して行われた研究である.本研究で用いた経腸栄養剤は,以前より当院で使用している製品であり,研究実施による使用製品の制限はなかった.また,研究に参加することによる患者の費用負担はなく,研究対象者に対して謝礼などの直接的な金銭等の授受はなかった.