Abstract
【はじめに】「亜鉛欠乏症の治療指針」により亜鉛測定や補充機会が増えている.亜鉛投与は腸管での銅吸収低下をきたすため両者の測定が推奨されている.亜鉛・銅欠乏時,本邦では銅製剤はなく,治療法は確立していない.亜鉛欠乏は創傷治癒遅延,銅欠乏は好中球減少等を引き起こすため治療が必要である.今回,亜鉛・銅欠乏を合併した難治性創傷に対し高カロリー輸液用複合微量元素製剤(以下,複合微量元素製剤と略)を用い,両者欠乏を補い奏功した症例を経験した.
【症例】パーキンソン病と幽門側胃切除術後の70代女性.大腿骨頸部骨折で入院し,人工骨頭置換術後,創部離開した.亜鉛銅含有経腸栄養剤,酢酸亜鉛で推奨量を補ったが,亜鉛・銅欠乏を認めた.複合微量元素製剤を末梢静脈投与後,両者の値は上昇し,その後創傷は改善・閉鎖術で治癒した.
【考察/結語】吸収不全や排泄増加による亜鉛・銅欠乏例では,複合微量元素製剤の静注が有効な可能性がある.
はじめに
亜鉛は核酸やタンパク合成に必須の微量元素であり,「亜鉛欠乏症の治療指針」1)では,創傷など様々な疾患で亜鉛測定や補充が推奨されている.一方,亜鉛投与により腸管壁で誘導されたメタロチオネインが親和性の高い銅と結合し腸上皮細胞に蓄積され,腸管ターンオーバー時に脱落するため銅排泄が亢進し,銅欠乏にも注意が必要である2).そのため,亜鉛投与の際は銅測定も推奨されている1).亜鉛・銅両者の欠乏は稀であり,その治療法は確立していない.本邦では経口や経腸での銅製剤やサプリメントはなく,高カロリー輸液用以外で亜鉛と銅を補充する製剤は存在しない.今回,キレート剤による排泄増加と腸管での吸収不良による亜鉛・銅欠乏を合併した難治性創傷に対し高カロリー輸液用複合微量元素製剤(以下,微量元素製剤と略)を末梢静脈投与し両者欠乏を補い奏功したと考えられる症例を経験した.
症例
患者:70代女性
現病歴:入院2週間前に転倒したが,普段通り杖歩行で過ごしていた.来院当日,立ち上がる際に,右股関節痛と体動困難を訴え,救急搬送となった.
既往歴:2年前,胃がんに対して幽門側胃切除術(Roux-en-Y法再建),10年前発症のパーキンソン病(Yahr 3度)レボドパ600 mg/日,カルビドパ60 mg/日,ロチゴチン13.5 mg/日の内服加療中であった.
入院時身体所見:身長144 cm,体重44 kg,BMI 21.2 kg/m2,呼吸音清,心雑音なし,腹部:上腹部に手術痕あり,平坦・軟,右股関節の圧痛,可動時痛あり.
骨盤X線写真:右大腿骨頸部に骨折線と転位あり(図1).
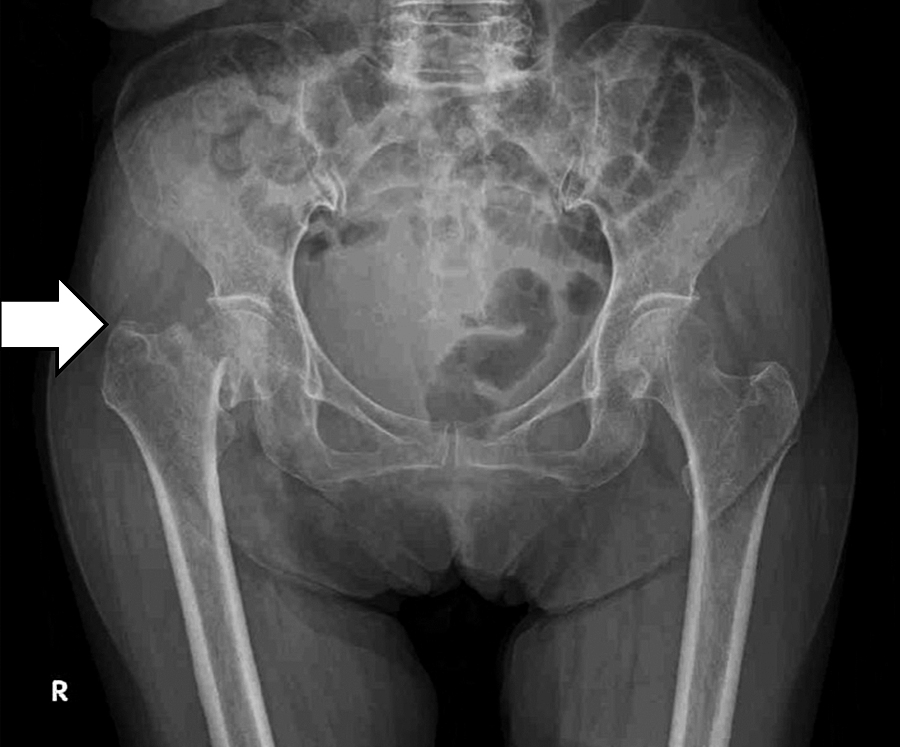
図1.入院時の骨盤X線写真 右大腿骨頸部に骨折線と転位を認める.
血液検査所見:表1
表1.
入院時の採血所見
| 血算 |
血液生化学 |
| WBC |
4,600/μL |
TP |
6.5 g/dL |
| Neut |
88% |
Alb |
3.8 g/dL |
| Lymph |
9% |
T-Bil |
1.2 mg/dL |
| Baso |
0% |
AST |
19 IU/L |
| Eosino |
0% |
ALT |
19 IU/L |
| Mono |
3% |
CK |
25 IU/L |
| RBC |
460 × 104/μL |
LDH |
220 IU/L |
| Hb |
13.5 g/dL |
γ-GTP |
9 IU/L |
| Hct |
41% |
BUN |
10.4 mg/dL |
| Plt |
26 × 104/μL |
Cr |
0.7 mg/dL |
|
|
UA |
3.2 mg/dL |
|
|
T-Cho |
214 mg/dL |
|
|
Na |
138 mEq/L |
|
|
K |
4.1 mEq/L |
|
|
Cl |
99 mEq/L |
|
|
CRP |
1.0 mg/dL |
入院後経過
第2病日,人工骨頭置換術を施行した.第15病日,創部に問題なく,抜鉤した.第19病日,創部離開とポケット形成を認め(図2),創部感染も合併したため抗菌薬を開始した.第24病日,ポケットの開放と壊死組織に対してデブリードマン・陰圧閉鎖療法を行った.第38病日,2週間の陰圧閉鎖療法にも関わらず,肉芽形成不良,深部に骨露出と膿性分泌物を認めデバイス感染と診断した(図3).第54病日,膿性浸出液持続したため,intra-medullary antibiotics perfusion(以下,iMAPと略)と局所陰圧閉鎖療法を併用した.約4週間のiMAPにより膿性分泌物等の感染兆候は消失した.入院時から約10 kgの体重減少もあり,栄養評価と治療目的にnutrition support team(以下,NSTと略)に依頼があった.NST介入後の経過を以下に示す.また,介入時の血液検査所見を表2に示す.
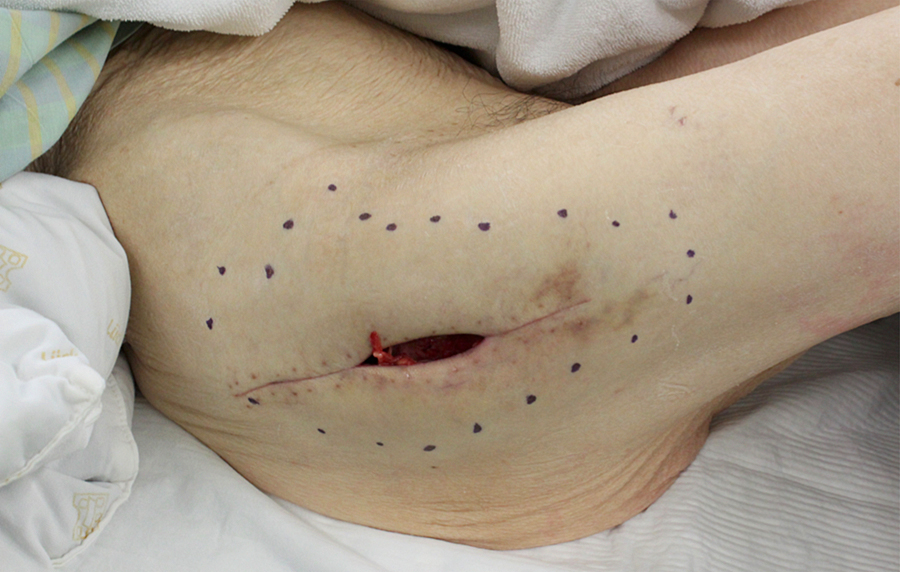
図2.第19病日の創部 創部離開とポケット形成を認める.
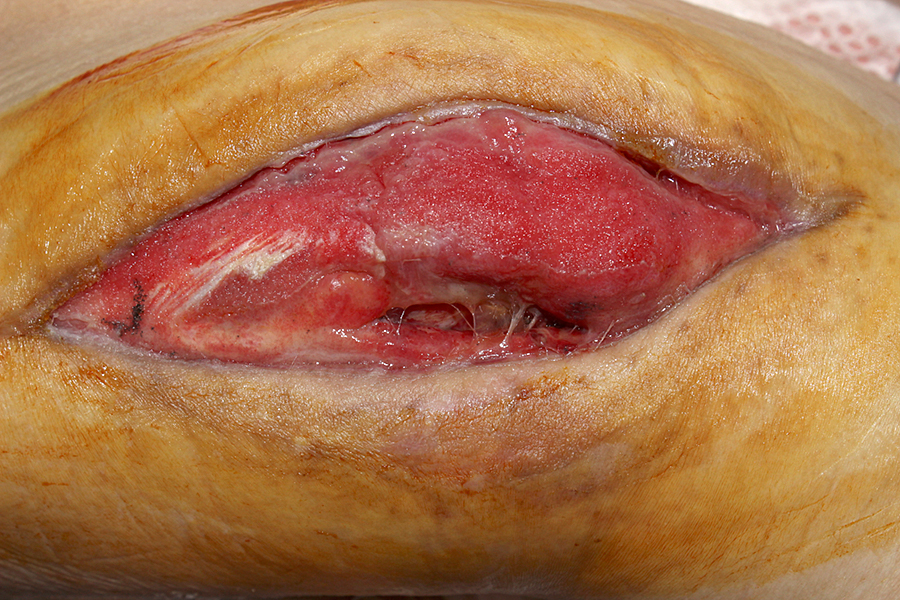
図3.第52病日の創部 肉芽形成不良を認める.
表2.
NST・褥瘡チーム介入時の採血所見
| 血算 |
血液生化学 |
| WBC |
4,000/μL |
TP |
5.0 g/dL |
| Neut |
62% |
Alb |
1.9 g/dL |
| Lymph |
27% |
Pre-Alb |
8.9 mg/dL |
| Baso |
5% |
T-Bil |
1.1 mg/dL |
| Eosino |
0% |
AST |
22 IU/L |
| Mono |
6% |
ALT |
5 IU/L |
| RBC |
364 × 104/μL |
CK |
20 IU/L |
| Hb |
10.6 g/dL |
LDH |
187 IU/L |
| Hct |
33% |
γ-GTP |
70 IU/L |
| Ret |
2% |
BUN |
6.8 mg/dL |
| Plt |
26 × 104/μL |
Cr |
0.5 mg/dL |
|
|
UA |
3.7 mg/dL |
|
|
Na |
137 mEq/L |
|
|
K |
3.0 mEq/L |
|
|
Cl |
95 mEq/L |
|
|
Fe |
41 μg/dL |
|
|
TIBC |
174 μg/dL |
|
|
フェリチン |
98 ng/mL |
|
|
Zn |
46 μg/dL |
|
|
ビタミンB12 |
1,028 pg/mL |
|
|
葉酸 |
4.1 ng/mL |
|
|
CRP |
1.8 mg/dL |
エネルギーとタンパク摂取量を図4に示す.肉芽形成不良であり創傷治癒遅延に対して,エネルギー35 kcal/kg/日以上,たんぱく質1.5 g/kg/日以上の摂取を目標とした.第69病日から亜鉛・銅含有経腸栄養剤(イノラス®)3包を,一時的な経口摂取不良もあり第118病日から経管栄養とし,アイソカルサポート®を経口摂取に併用した.
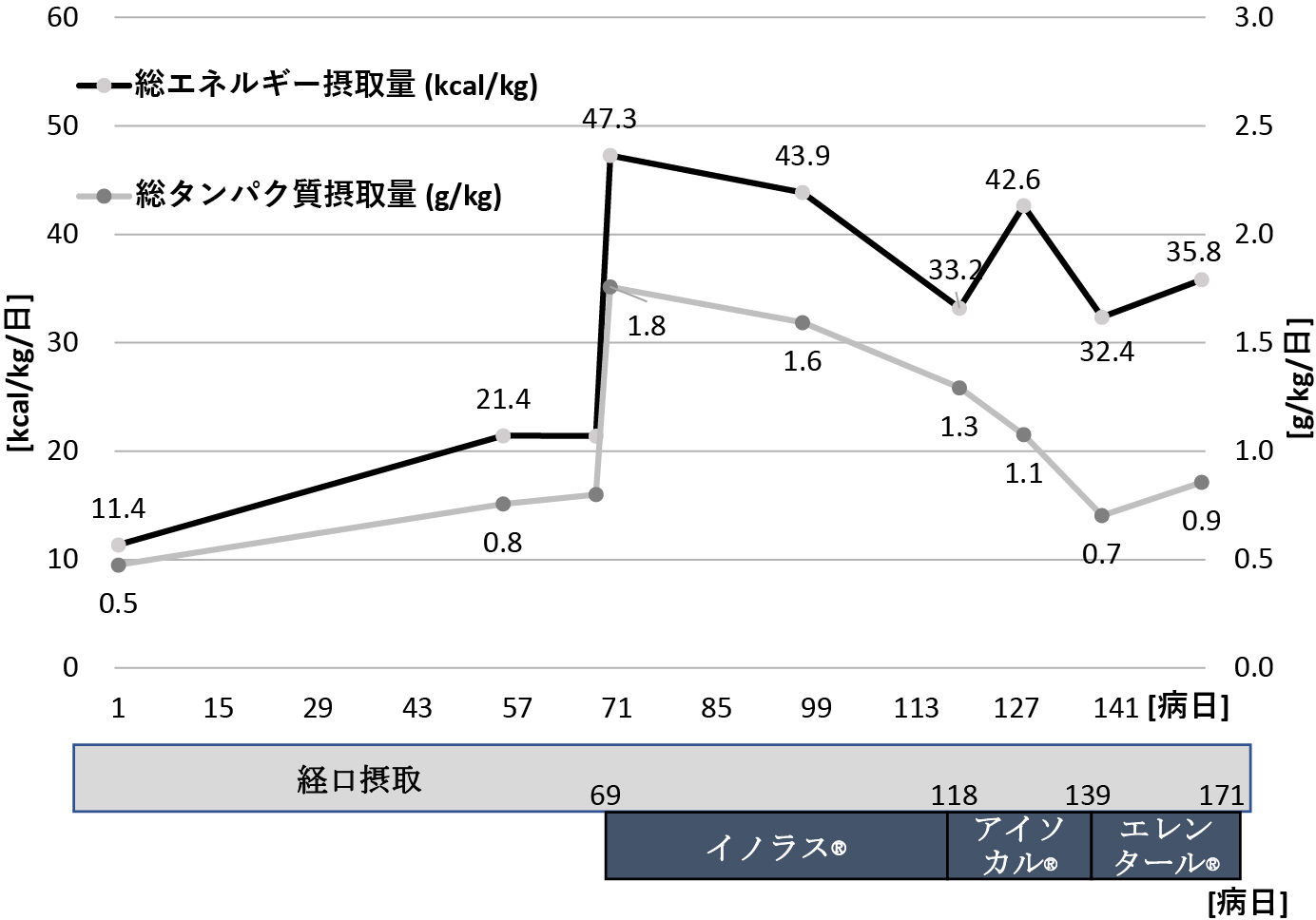
図4.エネルギーとタンパク質摂取量の推移
血清亜鉛が基準値80~130 μg/dLに対して49 μg/dLと欠乏していたため,第74病日から酢酸亜鉛(ノベルジン®)50 mg/日を追加し,亜鉛の摂取量を67.5 mg/日とした(銅摂取量:1.6 mg/日).以後の亜鉛・銅それぞれの血清値と総摂取量を図5,図6に示す.第119病日の時点で,血清亜鉛は77 μg/dL,血清銅は基準値68~128 μg/dLに対して24 μg/dLと「日本人の食事摂取基準(2020年版)」3)の推奨量を十分満たすにも関わらず,いずれも基準値に到達せず,第123病日時点では創傷治癒遅延だけでなく,中等度の好中球減少(570 cells/μL)も認めた.これ以上腸管からの亜鉛・銅の吸収は期待できないと考え,第123病日微量元素製剤(ミネラミック®)1アンプル(亜鉛3.9 mg/日,銅0.3 mg/日含有)を生理食塩水100 mLに溶解し末梢静脈投与した.適応外使用のため多職種で必要性を議論し,倫理委員会で使用に関し承認を得た.また,患者本人にも適応外使用であることを説明し同意を得た.ミネラミック®はpH 4.5~6.0,生理食塩水との浸透圧比0.5であり,末梢静脈投与であっても静脈炎リスクは高くないと判断した.第137病日2アンプルに増量し(総摂取量:亜鉛64.2 mg/日,銅1.4 mg/日),第139病日の採血で血清亜鉛(93 μg/dL),血清銅(63 μg/dL),好中球(2,952 cells/μL)の改善を得たため,減量し中止した.第123病日微量元素製剤投与後から創部の肉芽は良好に形成され(図7),第158病日閉鎖術を施行し,第174病日独歩で退院となった.
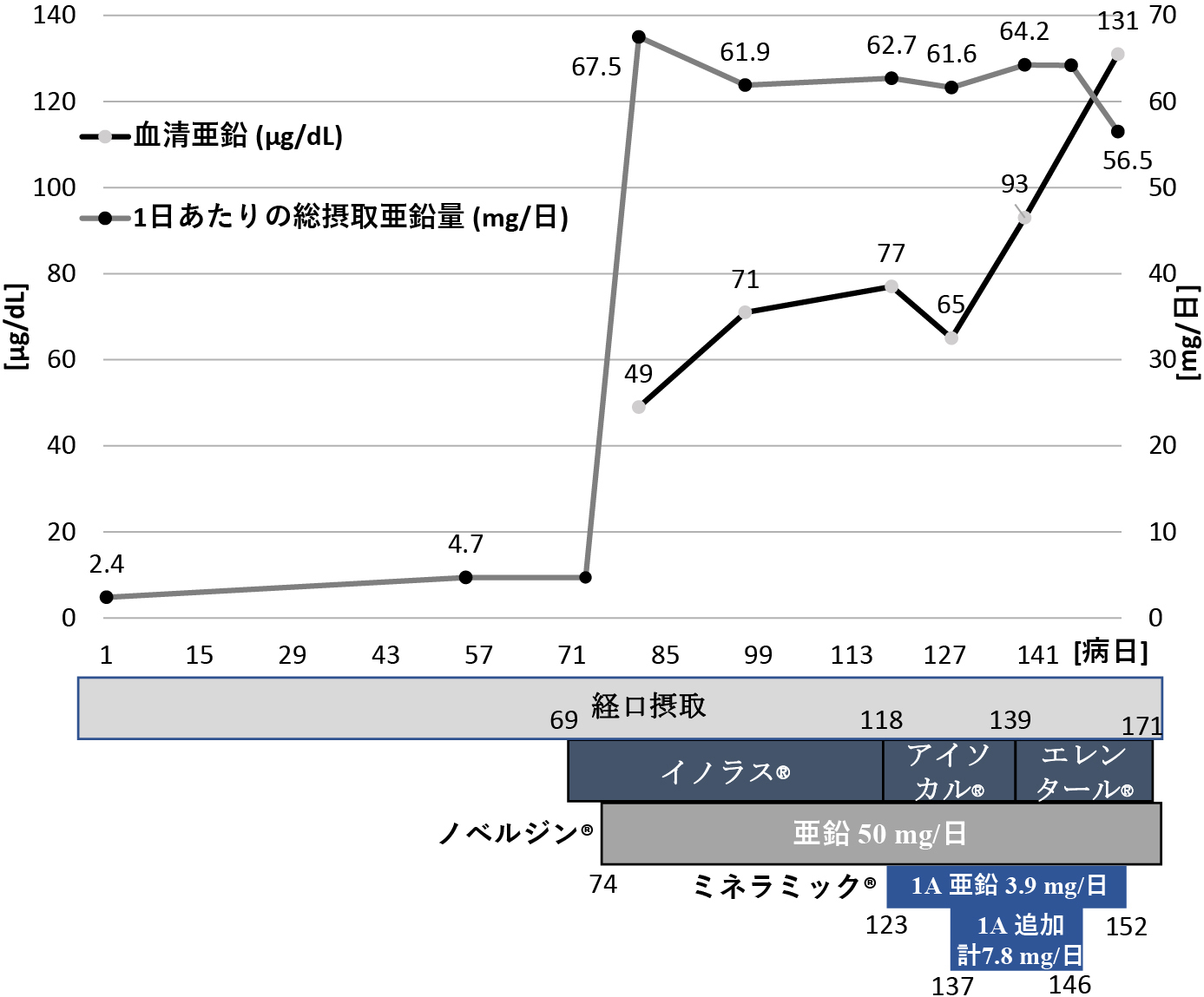
図5.血清亜鉛値と亜鉛摂取量の推移
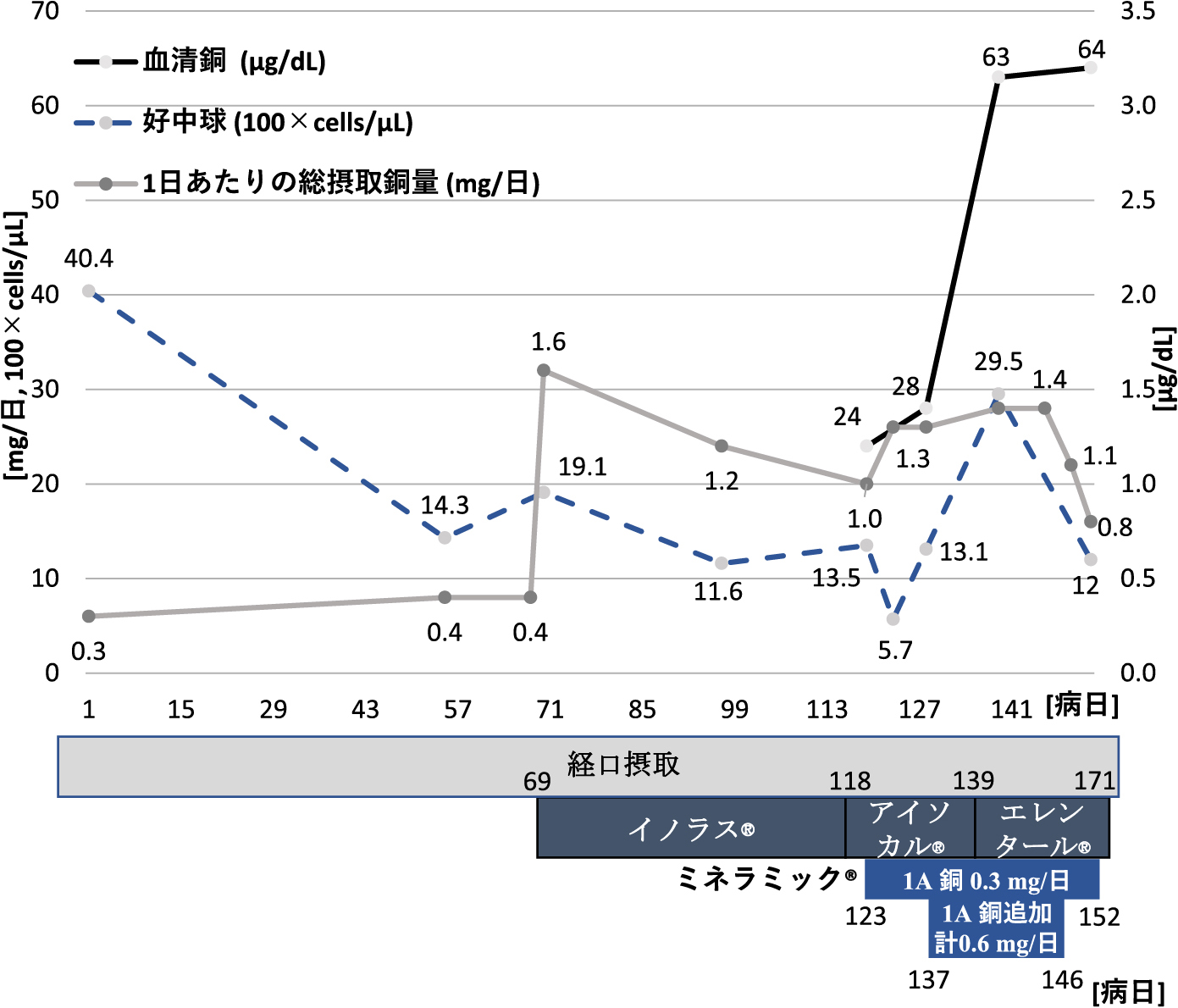
図6.血清銅値,好中球数,銅摂取量の推移
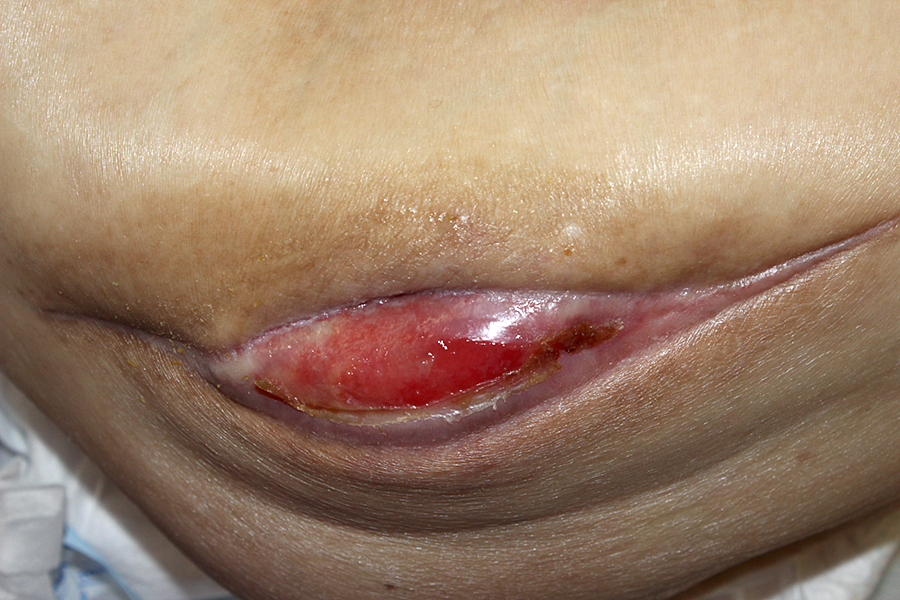
図7.第153病日の創部 閉鎖術前,良好な肉芽形成を認める.
考察
亜鉛・銅両者欠乏を合併した難治性創傷と好中球減少例を経験した.複合微量元素製剤を末梢静脈投与し血清亜鉛・銅値と好中球数改善,創傷治癒を得た.経腸栄養剤と酢酸亜鉛内服を用いて亜鉛・銅の推奨量を投与したが吸収不良とレボドパ・亜鉛投与による銅排泄増加が合併し,亜鉛・銅の欠乏に至ったと考えられた.
第74病日から約3週間は経腸栄養剤と酢酸亜鉛内服を用いて亜鉛67.5 mg/日,銅1.6 mg/日を摂取していた.これは「日本人の食事摂取基準(2020年版)」3)の推奨量(亜鉛8 mg/日,銅0.7 mg/日)を上回っていたが,消化管での吸収不良と排泄増加の併存によると考えられる亜鉛・銅欠乏を認めた.亜鉛欠乏の要因は,摂取不足,慢性肝障害や短腸症候群による吸収不全,キレート作用のある薬剤の長期服用や腎疾患による排泄増加等が挙げられる1).一方で,銅欠乏の要因は,摂取不足,胃切除(Roux-en-Y法での再建)により摂取物がcopper transporter 1が多く発現している主な吸収部位の十二指腸4,5)を通過しないことによる吸収不全,亜鉛過剰摂取による排泄増加等が挙げられる6).
本症例において経腸投与だけでは亜鉛欠乏と銅欠乏を補正できないと判断した理由として,パーキンソン病の治療薬レボドパのキレート作用による亜鉛排泄増加,幽門側胃切除後Roux-en-Y法再建による銅吸収障害,亜鉛摂取による腸管壁からの銅排泄増加が考えられた.これらの原因による好中球減少を伴う銅欠乏と難治性創傷を伴う亜鉛欠乏があり,適応外使用であるが複合微量元素製剤を末梢静脈投与し,血清亜鉛・銅と好中球改善,十分な栄養投与により創傷治癒も得られた.
現在,本邦では亜鉛・銅両者欠乏に対する定まった治療法はなく,投与量が不足した症例を除くと症例報告はほとんどない7–10).亜鉛欠乏単独には,2017年から酢酸亜鉛製剤が適応承認され,「亜鉛欠乏症の診療指針」1)が作成された.一方,本邦には銅製剤はなく,銅欠乏の治療指針もない.そのため,各施設が外国製サプリメント7,11),純ココア7,8,12),独自の硫酸銅製剤7,10),微量元素製剤9,10)等を用いて治療している.「亜鉛欠乏の診療指針」1)では,慢性腎不全等様々な疾患で亜鉛欠乏を疑い,亜鉛補充が推奨されている.一方,亜鉛過剰摂取は銅欠乏を引き起こすため,亜鉛摂取量45 mg/日以下を推奨する報告もあり2),近年,銅の評価も推奨されている1).そのため,今まで認知されなかった亜鉛・銅両者欠乏が新たに診断される症例の増加が予想される.本邦では,微量元素製剤は中心静脈投与用しかなく,末梢静脈投与は適応外使用だが,経口・経腸的にエネルギー・たんぱく質の目標量を摂取可能な症例では自験例のように有用な可能性がある.亜鉛・銅だけでなくその他の微量元素(鉄,マンガン,ヨウ素)も含まれているため,長期投与の際は過剰症にも注意が必要である.今後,亜鉛や銅静注製剤の販売や微量元素製剤の末梢静脈投与の承認を期待する.
結論
我々は,吸収不良・排泄亢進により亜鉛・銅両者の欠乏を合併した難治性創傷と好中球減少例を経験した.それに対して,複合微量元素製剤を末梢静脈投与し血清亜鉛・銅値と好中球改善,創傷治癒を得た.吸収不良や排泄亢進を伴う亜鉛・銅両者欠乏例は,吸収相互作用もあり,経口・経腸のみでの両者補正は難しく,複合微量元素製剤の静注が有効な可能性がある.
当症例の報告に関して,患者本人に書面を用いて説明し同意を得た.
微量元素製剤の末梢静脈投与に関し,自施設倫理委員会で承認を得た(No. 2021005).
本論文に関する著者の利益相反なし
引用文献
- 1) 日本臨床栄養学会ミネラル栄養部会.亜鉛欠乏症の診療指針2018.日臨栄会誌 40:120–167,2018.
- 2) Duncan A, Yacoubian C, Watson N, et al. The risk of copper deficiency in patients prescribed zinc supplements. J Clin Pathol 68: 723–725, 2015.
- 3) 日本人の食事摂取基準(2020年版).2019年12月更新.https://www.mhlw.go.jp/content/10904750/000586553.pdf.(2022年4月28日参照)
- 4) Prohaska JR. Role of copper transporters in copper homeostasis. Am J Clin Nutr 88: 826S–829S, 2008.
- 5) Herman S, Lipiński P, Ogórek M, et al. Molecular regulation of copper homeostasis in the male gonad during the process of spermatogenesis. Int J Mol Sci 21: 9053, 2020. doi: 10.3390/ijms21239053.
- 6) Prohaska JR. Impact of copper deficiency in humans. Ann N Y Acad Sci 1314: 1–5, 2014.
- 7) 池田 弘, 櫻間 教文, 黒住 順子ほか.銅欠乏症による種々の血球減少症を併発した透析患者の5例.日透析医学会誌 52:115–122,2019.
- 8) 稲葉 明子, 鳥居 孝子, 篠田 紘司ほか.胃全摘術後23年後に末梢神経障害,脊髄症,小脳失調,潜在的視神経症を呈した銅欠乏の1例.臨神経 51:412–416,2011.
- 9) 菊池 正夫, 里見 良輔, 村上 博ほか.亜鉛含有薬服用が誘因となった銅欠乏性貧血,白血球減少の一例.共済医報 57:20–25,2008.
- 10) 南 ゆかり, 松原 康博, 佐々木 晃ほか.銅0.3 mg/日の経静脈投与にも拘わらず,銅欠乏症となった熱傷の2症例.ICUとCCU 24:63–67,2000.
- 11) 渡邉 崇.不可逆的な脊髄変性を残した銅欠乏症の1例.日内会誌 107:2310–2315,2018.
- 12) 湧上 聖, 末永 英文, 江頭 有朋ほか.長期経腸栄養患者の銅欠乏に対する,ココアによる銅補充及び維持療法の検討.日老医誌 37:304–308,2000.







