2024 Volume 159 Issue 3 Pages 150-155
2024 Volume 159 Issue 3 Pages 150-155
クローン病は消化管全体に発症する可能性のある慢性再発性炎症性腸疾患であり,日本人における有病率は増加している.クローン病の最も頻度の高い合併症の1つは肛門周囲病変であるが,なかでも肛門周囲の複雑痔瘻は激しい痛み,出血,腫脹,感染,排膿が生じることがある.内科的及び外科的治療法の進歩にもかかわらず,クローン病における複雑痔瘻の治療は依然として困難であると共に,痔瘻を有するクローン病患者のQOLは低い.ダルバドストロセルは,同種異系の脂肪組織由来間葉系幹細胞の懸濁液を含む細胞治療製品である.欧州及び日本では,非活動期又は軽症の活動期クローン病における複雑痔瘻に対し,少なくとも1つの既存治療薬による治療を行っても効果が不十分な場合の治療薬として承認されている.局所炎症部位において免疫調節作用及び抗炎症作用を示すことにより,クローン病患者における複雑痔瘻の新たな治療選択肢として期待されている.当該報告では,クローン病に伴う複雑痔瘻の概略,ダルバドストロセルの特徴,欧州及び日本で実施された主要な第Ⅲ相試験成績の概要,並びに日本での開発戦略について紹介する.
Crohn’s disease (CD) is a chronic and relapsing inflammatory bowel disease affecting the entire gastrointestinal tract. The prevalence of CD among Japanese people is increasing. One of the most frequent complications of CD is perianal fistulas. People living with CD may experience complex perianal fistulas, which can cause intense pain, bleeding, swelling, infection, and anal discharge. Despite medical and surgical advancements, complex perianal fistulas in CD remain challenging for clinicians to treat. CD patients living with perianal fistulas reported a negative impact on many aspects of their quality of life. Darvadstrocel is a cell therapy product containing a suspension of allogeneic expanded adipose-derived mesenchymal stem cells. It has been approved in Europe and Japan for the treatment of complex perianal fistulas that have shown an inadequate response to at least one conventional or biologic therapy in adult patients with non-active/mildly active luminal CD. By exhibiting immunomodulatory and local anti-inflammatory effects at the site of inflammation, it offers a new treatment option for complex perianal fistulas in CD patients. In this manuscript, the characteristic of darvadstrocel, the summary of results from the pivotal phase 3 studies in Europe and Japan, and the development strategy in Japan were introduced.
非活動期又は軽症の活動期クローン病における複雑痔瘻に対し,2021年9月に本邦でダルバドストロセルが承認された.本製品は,同種異系の脂肪組織由来間葉系幹細胞の懸濁液を含む細胞治療製品であり,局所炎症部位において免疫調節作用及び抗炎症作用を示すことにより,クローン病患者における複雑痔瘻の新たな治療選択肢として期待されている.当該報告では,対象となるクローン病に伴う複雑痔瘻の概略,ダルバドストロセルの特徴,欧州及び日本で実施された第Ⅲ相試験成績の概要,並びに本製品の日本での開発戦略について紹介する.
クローン病は,小腸・大腸を中心に浮腫や潰瘍を認め,腸管狭窄や瘻孔等の特徴的な病態を形成する原因不明の肉芽腫性炎症性疾患である.病変は口腔から肛門までの消化管のあらゆる部位で発生する可能性があり,消化管以外にも,血液,関節,皮膚,眼,栄養代謝等に関連した種々の合併症を伴う.本邦ではクローン病は難病指定されており,クローン病の特定疾患医療受給者証所持者数は令和元年度で44,245人,令和2年度で47,633人,令和3年度で48,320人であった1–3).
クローン病に特徴的な合併症の一つとして,肛門周囲病変が挙げられ,疼痛,出血,膿汁排出,発熱,隆起物(突起物)触知等の症状が認められる4).肛門周囲病変は診断後10年の累積発症率が74%~80%と報告されており,日本では,痔瘻(肛門周囲瘻孔)及び肛門周囲膿瘍の頻度が特に高い5).痔瘻は直腸又は肛門と肛門周囲の皮膚との間に交通(瘻孔,瘻管)をきたした状態であり,主な症状として肛門周囲の腫脹,膿瘍形成による熱感,及び開口部からの持続的な排膿,排便や下血だけでなく,慢性活動期の肛門周囲疾患が長期に持続することで肛門括約筋を侵襲し,便失禁を引き起こし得る6,7).他にも,疾患の治療に対する不安,悪臭を伴う排液による身体像障害8)及び性機能障害などの心理的な障害9,10)や,一般的ではないが,慢性的な肛門周囲複雑痔瘻のさらなる長期化による肛門がん(扁平上皮がん又は腺がん)11)など,クローン病に伴う痔瘻はさまざまな面から患者のQOLを著しく低下させ,社会的,性的及び労働的な制約となる8).
一般的に,痔瘻は瘻管の数や瘻管の走行によって単純痔瘻又は複雑痔瘻に分類される12).痔瘻の原因となる小孔を原発口又は一次口,感染を遷延させる原因となる部位を原発巣,一次口から原発巣までの瘻管を一次瘻管,原発巣以後の瘻管を二次瘻管,二次瘻管の皮膚開口部を二次口と呼ぶが,一次口が歯状線より下側にあり,かつ二次口が1つのみで,肛門周囲膿瘍の存在を示唆する疼痛や変動がなく,直腸膣瘻や肛門直腸狭窄がみられない場合は単純痔瘻に分類される.一方,一次口が歯状線よりも上側にある場合,複数の二次口が存在する場合,肛門周囲膿瘍の存在を示唆する疼痛や変動を伴う場合,直腸膣瘻がみられる場合,肛門直腸狭窄がみられる場合,又は内視鏡で活動性の直腸疾患がみられる場合は複雑痔瘻に分類される.単純痔瘻は既存治療で改善することが多いが,複雑痔瘻は治癒率が低く13),外科治療の繰り返しにより便失禁に至るリスクがある.
海外ではクローン病に伴う痔瘻のうち,約75%が複雑痔瘻であったと報告されている14–17).本邦におけるクローン病に伴う肛門周囲複雑痔瘻の疫学の詳細は不明であるが,二見らは,クローン病患者577例中,367例に痔瘻・膿瘍がみられ,うち166例が複数の二次口をもつ複雑痔瘻であったと報告している18).なお,クローン病においては約30%の患者が腹部症状に先行して肛門部症状がみられることがあり4),クローン病と診断される前に肛門部病変の診断がなされる場合がある.
2) 標準治療クローン病に伴う複雑痔瘻の治療には,薬物治療(抗菌薬,免疫調節薬,生物学的製剤)及び外科治療がある.本邦におけるクローン病肛門部病変に対する治療指針では,痔瘻・膿瘍に対する治療は病態別に行うこととされており,軽症(日常生活に支障のない程度の自覚症状)の場合では痔瘻の切開排膿とともに抗菌薬が投与される.中等症(持続性の疼痛,排膿)以上の場合ではまずシートンドレナージと呼ばれるドレナージ術が推奨される.単純痔瘻の場合には痔瘻根治術も選択肢の1つになるが,痔瘻根治術は複雑痔瘻や再発を繰り返す場合には適応を控えることとされている.また,薬物治療(免疫調節薬,生物学的製剤)を導入する場合は,ドレナージ術によって局所の感染巣を制御した後に開始することとされている.上記の治療で日常生活を制限するほどの高度症状(重症例)が制御できない場合には人工肛門造設術が考慮される19).
3) 日常生活の負担・既存治療の課題クローン病に伴う肛門周囲複雑痔瘻はQOLを著しく低下させ,患者にとって多大な負担となる.国内外のガイドラインでは,患者のQOL改善に向け,症状に応じた治療法を推奨しているが,既存治療では無効及び/又は不耐の患者もおり,適切な治療とならない場合がある.また,シートンドレナージの場合は,1年以上のドレナージを要することも多く,患者のQOLが低くなるという問題点もある.以上から,クローン病に伴う肛門周囲複雑痔瘻の治療には有効性及び安全性上の課題が残されており,それを克服する新たな治療選択肢が必要とされている.
前述の医療環境の中,本邦では2021年9月に「非活動期又は軽症の活動期クローン病患者における複雑痔瘻の治療」を目的としてダルバドストロセル(一般名)が承認を取得した.ダルバドストロセルは同種異系の脂肪組織由来間葉系幹細胞の懸濁液を含む細胞治療製品であり,再生医療等製品に区分されている.
間葉系幹細胞は強力な免疫調節作用を有することから,損傷組織,移植及び自己免疫疾患などへの応用が期待されている20,21).骨髄移植後の移植片対宿主病に対する間葉系幹細胞の免疫抑制効果が臨床試験や実臨床で確認され20),また,脱髄性神経障害(多発性硬化症),全身性エリテマトーデス,クローン病などの各種免疫性炎症性疾患に対する臨床研究も進められている20).その中でも脂肪組織由来幹細胞は,脂肪吸引術等により細胞の採取が簡便であり,骨髄組織等の他の組織よりも細胞数が多く,また,骨髄由来幹細胞よりも増殖スピードが速いといった利点があり,容易に必要量を確保可能な間葉系幹細胞として注目されている.
ダルバドストロセルは健康成人の脂肪組織から抽出し,培養・増殖させた間葉系幹細胞であり,講習を受けた医師により,クローン病患者の痔瘻に対して一次口の周囲及び瘻管壁に沿って投与される.これにより間葉系幹細胞が局所の炎症部位において免疫調節作用及び抗炎症作用を示す.通常,痔瘻の内部では細菌感染や自身の排泄物等の付着により局所の炎症反応が悪化していき,活性化リンパ球が浸潤し,炎症性サイトカインが放出されている.間葉系幹細胞は炎症部位において,炎症性サイトカインであるIFN-γによるインドールアミン-2,3-ジオキシゲナーゼの発現誘導により活性化され,リンパ球の増殖を阻害することで炎症性サイトカインの放出を抑制する.さらに,過剰な免疫反応を抑制する制御性T細胞を誘導する.ダルバドストロセルはこのような免疫調節作用や局所での炎症反応を抑制することで,瘻孔周囲の組織を治癒させると考えられる.なお,本品は同種異系の由来ではあるものの間葉系幹細胞であることから免疫反応は起こりにくいと考えられている.
2) 臨床試験結果と開発計画ダルバドストロセルは,欧州で先行してクローン病に伴う肛門周囲複雑瘻孔の治療を目的とした臨床開発が行われた.本品は,最初の臨床試験として,2009年にスペインでクローン病に伴う肛門周囲複雑瘻孔を有する患者を対象とした海外第Ⅰ/Ⅱa相非盲検非対照試験を開始し,その後,2012年からは欧州においてクローン病に伴う肛門周囲複雑痔瘻を有する患者を対象とした第Ⅲ相プラセボ対照試験(ADMIRE-CD試験)を実施した.これらの試験の結果,本品の良好な成績が得られたことから,2016年3月に欧州医薬品庁に申請を行い,2018年3月に非活動期又は軽症の活動期クローン病を有する患者におけるクローン病に伴う肛門周囲複雑痔瘻(既存治療又は生物学的製剤による治療にもかかわらず効果不十分な場合)の治療製品として承認が得られた.
(1) 欧州臨床試験(ADMIRE-CD試験)海外第Ⅲ相臨床試験であるADMIRE-CD試験は,クローン病に伴う肛門周囲複雑痔瘻を有する患者におけるダルバドストロセルの有効性及び安全性を検討する,第Ⅲ相,多施設共同,二重盲検,プラセボ対照,並行群間比較試験である.本試験は,欧州(オーストリア,ベルギー,フランス,ドイツ,イタリア,オランダ及びスペイン)及びイスラエルの47施設で実施された22,23).本試験の対象は,肛門周囲複雑痔瘻を有する非活動期又は軽度のクローン病(CDAIが220以下と定義)患者で,かつ抗菌薬,免疫調節薬又は抗TNF製剤のいずれか少なくとも1剤で抵抗性を示した者とした.本試験は,クローン病に対する基礎治療(免疫調節薬,抗TNF製剤等)を一定条件下で許容する上乗せ試験として実施した.本試験では,治験製品投与前の5週間をスクリーニング期として被験者の適格性を判定し,さらにすべての被験者に対し,治験製品投与の2週間前までに前処置として,麻酔下での診察及び瘻孔掻爬を行い,臨床的に必要とされた場合にはシートン留置を行い,治験製品投与直前にシートンは抜去した.適格と判定された被験者をダルバドストロセル群又はコントロール群に1:1の比で無作為割付し,治験製品を病変内に単回投与した.治験製品は全量24 mLであり,半量を原発口近傍に投与し,半量を二次口側から瘻管に沿って瘻管壁内に数個の微小水疱を形成しながら投与した.原発口が2つある場合は各原発口近傍に6 mLずつ投与した.また,二次口が2つ又は3つある場合は,各瘻管で投与量が均等になるように投与した.なお,この用法及び用量は市販製品と同様である.
治験製品投与24週後の複合寛解(スクリーニング時に排膿があり,すべての二次口が軽い指押しを行っても排膿がみられず閉鎖したと臨床的に確認され,かつ,瘻孔内に2 cmを超える膿瘍がないことがMRI画像の中央判定で確認された場合と定義)を主要評価項目として24週後の評価を完了し,52週後までの延長追跡調査に同意した被験者については,52週後までの延長追跡調査期で有効性及び安全性の評価を行った.同様に,52週後の評価を完了し,104週後までの延長追跡調査に同意した被験者については,104週後までの延長追跡調査で有効性及び安全性の評価を行った.
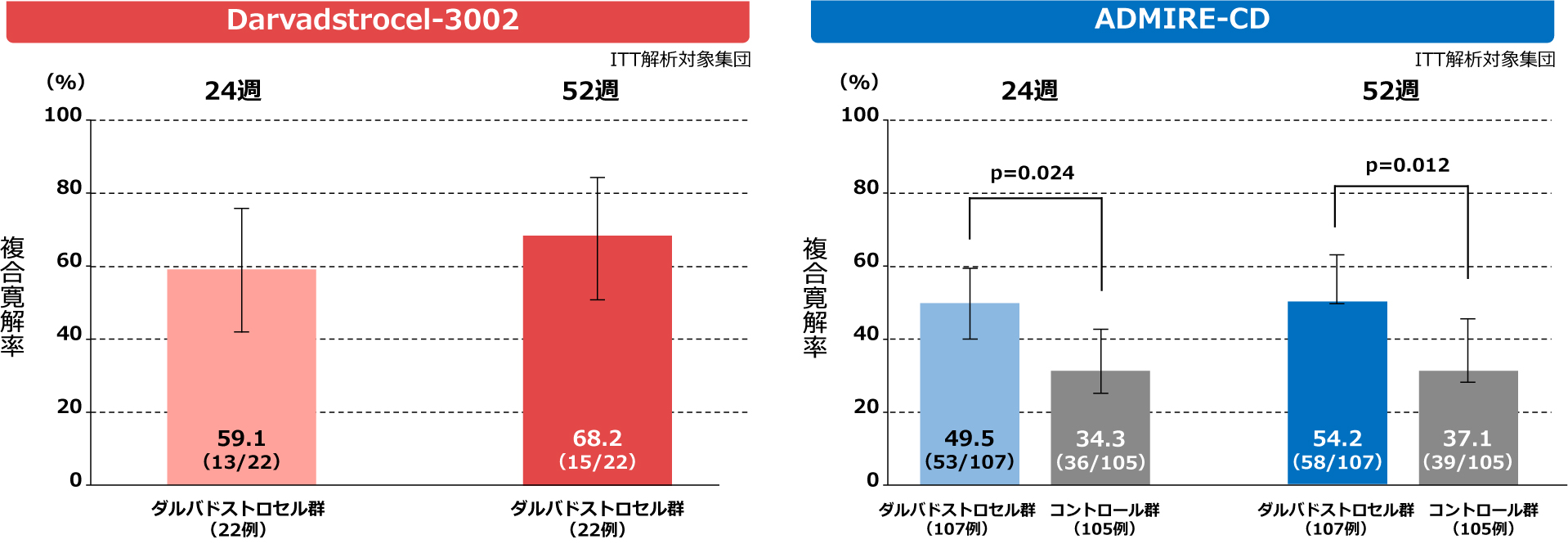
ADMIRE-CD試験ではスクリーニングを実施した被験者289例のうち,212例(ダルバドストロセル群107例,コントロール群105例)が無作為化され,「ITT解析対象集団」に採用された.「ITT解析対象集団」における24週後時点の複合寛解率(95%CI)は,ダルバドストロセル群で49.5%([40.1, 59.0]%),コントロール群で34.3%([25.2, 43.4]%)であった.投与群間差(97.5%CI)は15.2%([0.2, 30.3]%)であり,ダルバドストロセル群はコントロール群を統計学的に有意に上回っていた(P=0.024).さらに,52週後時点の複合寛解率(95%CI)は,ダルバドストロセル群で54.2%([44.8, 63.6]%),コントロール群で37.1%([27.9, 46.4]%)であった.投与群間差(95%CI)は17.1%([3.9, 30.3]%)であり,52週後時点においてもダルバドストロセル群はコントロール群を統計学的に有意に上回っていた(P=0.012)(図1).

複合寛解:スクリーニング時に排膿があり,すべての二次口が軽い指押しを行っても排膿がみられず閉鎖したと臨床的に確認され,かつ,瘻孔内に2 cmを超える膿瘍がないことがMRI画像の中央判定で確認された場合.
ITT解析対象集団,52週時の臨床評価が不能の場合は,ベースライン以降の直近の来院時(該当する場合,Week 52より前の早期中止来院を含む)のLOCFを適用.
P値:無作為化時の層別因子(抗TNFα抗体製剤又は免疫調節薬の併用の有無)で調整したCochran-Mantel-Haenszel検定により算出.
ADMIRE-CD試験の投与52週後までに有害事象はダルバドストロセル群79例(76.7%)及びコントロール群74例(72.5%)にみられた.ダルバドストロセル群で発現頻度が10%以上であった有害事象は肛門膿瘍(ダルバドストロセル群19.4%及びコントロール群13.7%,以下同順),肛門周囲痛(14.6%及び11.8%),上咽頭炎(10.7%及び4.9%)及び痔瘻(10.7%及び7.8%)であり,これらの発現頻度は全体的には投与群間で大きな違いはみられなかった.重篤な有害事象は投与52週後までにダルバドストロセル群25例(24.3%)及びコントロール群21例(20.6%)でみられた.ダルバドストロセル群で2例以上にみられた重篤な有害事象は,肛門膿瘍〔ダルバドストロセル群14例(13.6%)及びコントロール群8例(7.8%),以下同順〕及び痔瘻〔4例(3.9%)及び1例(1.0%)〕であった.重篤な有害事象のうち,治験製品との因果関係が否定できない有害事象は,肛門膿瘍〔ダルバドストロセル群7例(6.8%)及びコントロール群5例(4.9%)〕のみであった
(2) 国内開発計画国内におけるダルバドストロセルの承認申請を検討するにあたり,クローン病に伴う肛門周囲複雑痔瘻を有する日本人患者を対象とした国内第Ⅲ相非盲検非対照試験(Darvadstrocel-3002試験)に加え,海外で実施したADMIRE-CD試験及び第Ⅰ/Ⅱa相非盲検非対照試験(Cx601-0101試験)の計3試験を評価資料として用いる計画を立てた(図2).Darvadstrocel-3002試験にてダルバドストロセルの治療対象となる日本人患者はごく少数であったため,実施可能性を勘案して計画被験者数20例の小規模な国内試験を計画し,本国内試験では統計学的な検証は行わないものの,本試験とADMIRE-CD試験成績の比較を目的とした臨床試験を計画することとした.主要評価項目である投与24週後時点の複合寛解率がADMIRE-CD試験の結果と類似しており,かつ投与24週後及び52週後までのその他の有効性評価項目及び安全性に大きな差異がないことが確認できれば,これまでの海外臨床試験成績を外挿した合計3試験の結果を評価資料とした臨床データパッケージによる国内承認申請が可能になると考えた.

これら臨床データパッケージの妥当性ならびに国内臨床試験のデザインについて開発の助言を受けるべく,再生医療等製品探索的試験終了後相談の枠にて医薬品医療機器総合機構との治験相談を行い,前述の臨床データパッケージの構築が可能であるとの総合機構の助言を得た.なお,当該治験相談資料においては,本品の海外臨床試験データを評価資料として利用する妥当性について,①ダルバドストロセルは病変部に直接投与することにより瘻孔周辺組織の治癒促進を期待するものであることから内因性民族的要因の影響を受けることは考えにくいこと,②クローン病に伴う肛門周囲複雑痔瘻の診断及び治療法は国内外で大きな違いはないことを述べ,この2点により内因性及び外因性民族的要因の影響を受ける可能性が低いことを説明した.
(3) 国内臨床試験Darvadstrocel-3002試験は,クローン病に伴う肛門周囲複雑痔瘻を有する日本人患者における本品の有効性及び安全性を検討する,第Ⅲ相,多施設共同,非盲検,非対照試験である.本試験は前述の通り,ダルバドストロセルの治療対象となる日本人患者がごく少数であったため実施可能性を勘案して計画被験者数20例の小規模な試験とし,日本国内の9施設で実施した.また,ADMIRE-CD試験のダルバドストロセル群の結果との類似性を確認することを目的としていたため,試験デザイン,患者の適格性基準,評価項目等はADMIRE-CD試験をほぼ踏襲して実施した.
本治験に組み入れられた被験者22例全例がダルバドストロセルを投与され,「ITT解析対象集団」に採用された.「ITT解析対象集団」における24週後時点の複合寛解率(95%CI)は,59.1%([38.5, 79.6]%)であった.また,52週後時点の複合寛解率(95%CI)は,68.2%([48.7, 87.6]%)であった.Darvadstrocel-3002試験の24週後時点及び52週後時点の有効性成績は,ADMIRE-CD試験の有効性成績と大きな違いはみられず,両試験のCIは重なっており,これらの試験間の有効性の結果は類似していた(図3).さらに,副次評価項目である臨床寛解率及び改善率,並びにその他の評価項目についても,試験間で大きな違いはなく,有効性の結果の類似性を支持するものであった24).
複合寛解:スクリーニング時に排膿があり,すべての二次口が軽い指押しを行っても排膿がみられず閉鎖したと臨床的に確認され,かつ,瘻孔内に2 cmを超える膿瘍がないことがMRI画像の中央判定で確認された場合.
ITT解析対象集団,52週時の臨床評価が不能の場合は,ベースライン以降の直近の来院時(該当する場合,Week 52より前の早期中止来院を含む)のLOCFを適用.
P値:無作為化時の層別因子(抗TNFα抗体製剤又は免疫調節薬の併用の有無)で調整したCochran-Mantel-Haenszel検定により算出.
Darvadstrocel-3002試験の投与52週後までに有害事象は20例(90.9%)にみられた.発現頻度が10%以上であった有害事象は,肛門周囲痛(27.3%),上咽頭炎(22.7%),及び痔瘻(18.2%)であった.投与52週後までに重篤な有害事象は4例(18.2%)にみられた.内訳は,クローン病,腸閉塞,腸管吻合合併症,尿路結石及び尿細管間質性腎炎が各1例(4.5%)であり,このうち,治験製品との因果関係が否定できない有害事象は,クローン病のみであった24).
投与52週後までの安全性成績は,Darvadstrocel-3002試験における日本人患者データとADMRIE-CD試験における外国人患者のダルバドストロセル群のデータの間で有害事象の傾向は全体的に類似しており,これらの試験成績から総合的に,クローン病に伴う肛門周囲複雑痔瘻を有する日本人患者におけるダルバドストロセルの安全性が示されたと考えた(表1).
| Darvadstrocel-3002 | ADMIRE-CD | ||
|---|---|---|---|
| ダルバドストロセル群 (22例) |
ダルバドストロセル群 (103例) |
コントロール群 (102例) |
|
| 被験者数(%) | 被験者数(%) | 被験者数(%) | |
| 試験治療下で発現した有害事象 | 20(90.9) | 79(76.7) | 74(72.5) |
| 関連なし | 18(81.8) | 71(68.9) | 69(67.6) |
| 関連あり | 2(9.1) | 21(20.4) | 27(26.5) |
| 軽度 | 12(54.5) | 57(55.3) | 59(57.8) |
| 中等度 | 6(27.3) | 54(52.4) | 52(51.0) |
| 高度 | 2(9.1) | 10(9.7) | 12(11.8) |
| 治験の中止に至る場合 | 0(0.0) | 9(8.7) | 9(8.8) |
| 試験治療下で発現した重篤な有害事象 | 4(18.2) | 25(24.3) | 21(20.6) |
| 関連なし | 3(13.6) | 19(18.4) | 16(15.7) |
| 関連あり | 1(4.5) | 7(6.8) | 7(6.9) |
| 治験の中止に至る場合 | 0(0.0) | 6(5.8) | 7(6.9) |
| 死亡 | 0(0.0) | 0(0.0) | 0(0.0) |
以上の国内臨床試験の良好な結果より,海外で実施した2つの臨床試験の結果を加えた計3試験を評価資料とした臨床データパッケージを用いて2021年2月に承認申請を行い,2021年9月にダルバドストロセルの承認を得た.
再生医療等製品は医療用医薬品に比べてまだまだ承認品目は少なく,現状として製品開発に対するナレッジが十分に集積されていない.今回紹介していないが,再生医療等製品の開発においては開発ストラテジーや臨床データパッケージに対する総合機構との面談に加えて,品質面に関わるRS(レギュラトリーサイエンス)戦略相談も必要性が高まること,また,治験製品が生きた細胞である側面から,治験実施施設への治験製品の輸送やそのルートの確保などにおいても,製品に厳密な温度管理や使用期限がある点を踏まえた対応が必要となり,医療用医薬品とは異なった臨床開発の準備が要求されることに注意が必要である.
今回の報告が,再生医療等製品の開発に関する業界全体としてナレッジ共有の一助となることを期待する.
山口 貴義(武田薬品工業株式会社).