2024 Volume 159 Issue 5 Pages 305-310
2024 Volume 159 Issue 5 Pages 305-310
昨今隆盛を極めるボトムアップテクノロジーとの関連から,機能性高分子の自己組織化を利用し溶液中においてナノ構造体を形成し,医療を中心とする幅広い分野での応用が検討されている.これらの研究の目標の一つに,生理活性物質を生体内の標的とする箇所へ送り届け,狙った機能を発揮することで活躍する薬剤送達システム(drug delivery system:DDS)の創製がある.著者らはこれまでに生体内での安全性が担保された高分子をビルディングブロックとした高分子集合体をDDSとして,主にがんに薬剤を送達するナノマシンを開発してきた.本稿では,これまでに培ってきたナノマシン設計技術を活用し,既存技術では通過が困難な血液脳関門(blood-brain barrier:BBB)を効率的に通過し,脳内へ侵入する『ナノマシン』と呼ばれる最先端ナノテクノロジーの開発について紹介する.さらにこの『ナノマシン』技術を活用,さらにブラッシュアップし,脳内外の物質輸送と種々の生体内プロセスの相関を解明し,「脳分子を非侵襲的に回収・検出し,脳機能・疾患を理解」する『はやぶさ型ナノマシン』の開発を進めている.本稿では,『脳分子探査』という既存技術では着想もしない,まさに既存の学術体系や方法論を大きく転換する『はやぶさ型ナノマシン』のコンセプトや取り組みについても紹介する.
Recently, bottom-up technologies, in particular the utilization of self-assembly of functional polymers to form nanostructures in solutions have been collecting attention. These technologies are being explored for various applications, especially for usage in therapeutics. One of the goals of such studies is to develop a drug delivery system (DDS) that delivers bioactive substances to specific targets within our body, eliciting the desired functionality. The authors have been developing “nanomachines” using biocompatible polymers to safely and efficiently deliver drugs mainly to tumors. The aim of this study is to utilize our expertise in designing a nanomachine to develop a cutting-edge nanomachine that can efficiently penetrate the blood-brain barrier (BBB) and deliver drugs to the brain parenchyma. Furthermore, leveraging this “nanomachine” technology, the authors are advancing the “Hayabusa Nanomachine,” which can non-invasively collect and detect brain molecules, correlating them with various biological processes, ultimately leading to a better understanding of brain function and diseases. This paper also introduces the concept and ongoing efforts to the development of “Hayabusa Nanomachines,” which have the potential to revolutionize existing approaches in this field.
これまでに我々は,生体への安全性が担保され,かつ高度にデザインされた人工高分子(ブロック共重合体)を用いて,生体内で即時に活躍可能な薬剤送達システム(drug delivery system:DDS)を合目的的に開発し,薬剤送達システム技術に新しい方法論を持ち込むことを目指し研究を行ってきた1).特に血管壁の透過性が亢進している固形がん治療を対象とした一部の高分子ミセルシステムについては,既に臨床試験にまで進んでいる2).一方,このような透過性亢進が望めないバリア性の高い血管壁を通過して組織の実質部に生理活性物質を効率良く送り込むDDSの設計は依然としてチャレンジングな課題である.とりわけ,脳は血液脳関門(blood-brain-barrier:BBB)3)と呼ばれる主に脳毛細血管内皮細胞(brain capillary endothelial cells:BCECs)と脳実質のグリア細胞により形成され,循環血液と脳神経系の物質輸送を制御する機能を担っており,脳の活動に必須な栄養素を選択的に取り込む反面,薬剤の脳への送達を著しく制限している.世界中でBBBを効率的に通過するシステム開発が検討されているが,その多くは脳への集積量が投与量の1.0%未満であり4),近年注目を集めている抗体医薬については0.04%ほどと著しく低いのが現状である5).このようにBBBの存在は多くの薬剤の脳への到達を困難にしており,様々な中枢神経系疾患が難治性である原因の一つとなっていることからも,DDSを用いてBBBを効率よく通過し神経系細胞へ薬剤をデリバリーする方法論の開発は急務である.ここで,BBBを構築するBCECsには,脳のエネルギー源であるグルコース(ブドウ糖)を輸送するためのグルコーストランスポーター1(GLUT1)が他のトランスポーターと比べ桁違いに多く存在していることが報告されている6).これまでに薬剤またはDDSにグルコースを結合させて脳へ送達させようという試みが世界中でなされてきたが,脳実質への高い移行について成功した報告例は無く,GLUT1認識を目的としたDDS設計に新しい視点を導入することが不可欠と考えられる.そこで我々は,GLUT1のBCECsにおける細胞内の局在部位が血糖値の変化に伴って変わるといった生理学的な特徴に着目した.BCECs中でGLUT1は血管側と脳実質側の双方に局在し7),また細胞内にも多くプールされていることが示唆されているとともに,クラスリン非依存性エンドサイトーシスにより細胞内と膜表面との間でリサイクリングされていることが報告されている8).また興味深いことにSimpsonらは,血糖値の低い状態においてBCECs中の血管側で局在量が増加して,血糖値が高くなることで減少することも報告されている9).そこで著者らのグループは,GLUT1を標的としてグルコースをリガンド分子として表層に導入した高分子ミセルをDDSとして,さらにGLUT1の生理学的な特徴を巧みに組み合わせることで,既存技術と比較して著しく高い効率でBBBを通過し脳内に到達する「BBB通過型ナノマシン」を開発した10).加えて,「BBB通過型ナノマシン」をプラットフォームとして,核酸医薬11,12)や抗体医薬13)を脳内に送達することに成功したので紹介する.
GLUT1はグルコースのC1,C3,C4位のヒドロキシル基を選択的に認識し,グルコースを能動輸送することが知られている12).またグルコース分子とGLUT1とのミカエリスメンテン定数は1.5 mMとあまり高くない13).そこで,GLUT1一分子のサイズ(約3 nm)14)より十分に大きいサイズのナノマシン表層に,最適な立体配置で複数のグルコース分子を導入し,ナノマシンがBCEC上に存在する複数のGLUT1分子と同時に結合出来るような状態を作り出すことによって,結合力を上昇させる戦略(多価効果15))が有力であると考えた.そこで我々は,親水性セグメントに生体適合性の高いポリエチレングリコール(PEG)を有し,荷電性セグメントに反対電荷を有するポリアミノ酸(および誘導体)からなる荷電性のブロック共重合体が,水溶液中で静電相互作用を形成駆動力として多分子会合することで構築されるナノマシン表層に,GLUT1への結合能を保持するようにC6位のOH基を介して複数のグルコース分子をその密度を制御した形で導入したナノマシンを設計・構築した(図1).C6位のOH基を介してグルコースをPEGセグメントのα末端に結合したGluc(6)-PEG-ポリアニオンとグルコースを結合していないPEG-ポリアニオンを任意の割合で混合した水溶液を調整し,これを反対荷電を有するPEG-ポリカチオンの水溶液と混合することで,荷電セグメント間の静電相互作用により形成される内核を親水性かつ非荷電性であるPEG外殻が覆う,サイズが一定で,表面のグルコース密度のみを系統的に変化させた(10,25,50%)一連のナノマシン(Gluc(6)/NM)を調製した.GLUT1への結合能を有さないナノマシンとして,表層にグルコースを持たないNull/NMの他に,GLUT1による認識に必須とされるC3位のOH基を使ってグルコースを結合したブロック共重合体(Gluc(3)-PEG-ポリアニオン)から調製したGluc(3)/NMを用いた.動的光散乱測定と透過型電子顕微鏡観察により,調製したナノマシンのサイズは,表層のグルコース密度(0,10,25,50%),結合様式(Gluc(6),Gluc(3))に関わらず直径が30 nmで単分散であることを確認した(図1).さらに,全てのナノマシンが優れた血中循環性を示し,投与後90分において投与量の80%以上が血中に留まっていることも確認した.

生体への安全性が担保された反対電荷を有するブロック共重合体が水溶液中で多分子会合することで構築する.表層にはGLUT1を認識するためにグルコース分子を複数個搭載しており,大きさは直径30 nmほどである.
ナノマシン表層に結合したグルコース分子のGLUT1認識能について,細胞表層に局在するGLUT1とナノマシンとの相互作用を評価した.GLUT1を強発現した細胞を調製し,蛍光標識したGluc(6)/NM,Gluc(3)/NM,Null/NMを播種し,細胞に取り込まれたナノマシン量を定量した.その結果,GLUT1の発現量の低い細胞に対してはいずれのナノマシンも取り込み量が低いのに対し,GLUT1を強発現した細胞に対してGluc(6)/NMがGluc(3)/NMおよびNull/NMと比較して優位に取り込まれることが明らかとなった.またGLUT1の阻害薬であるフロレチンを種々の濃度で添加したところ,Gluc(6)/NMの細胞取り込み量が阻害薬濃度に依存して抑制された.これはナノマシン表層のグルコース分子が細胞表層のGLUT1を認識して細胞へ取り込まれていることを強く支持する結果である.
2) ナノマシンの脳集積性評価細胞実験の結果から構築したナノマシンがGLUT1を適確に認識することが明らかになったので,続いてマウスを用いてナノマシンの脳への集積性について検討した.上述したように,GLUT1は血糖値によって局在箇所が変化する9).そこで,①餌を自由に食べられる『給餌制御なし』群,②24時間餌を抜き,さらにグルコース溶液を腹腔内投与(ip)する『給餌制御+外部刺激』群のマウスに蛍光標識したナノマシン(Null/NM,25%Gluc(6)/NM,25%Gluc(3)/NM)を尾静脈投与(iv)し,投与から90分後の脳への集積量を評価した.ここで具体的に②は24時間餌を抜いたマウスにナノマシンをiv投与し,30分後に20 wt%のグルコース溶液をip投与した.まず①『給餌制御なし』に関しては,Null/NMと比べ25%Gluc(6)/NMは脳への集積量の増加が確認されたが,その集積量は高々0.3%dose/g-brain(Null/NMは0.04%dose/g-brain)であった(図2(a)).一方で,②『給餌制御+外部刺激』については,驚くべきことにNull/NMと比べて25%Gluc(6)/NMにおいて,外部刺激後に脳への集積が急激かつ有意に上昇し,その集積量は最大で6%dose/g-brainに達した(図2(a)).(重要な点として『給餌制御』のみでは25%Gluc(6)/NMも脳への集積が確認されなかったことである.)これまで脳集積性を示すと報告されているDDSと比較すると,グルコースを表層に導入した直径100 nmのPEG化リポソームのiv投与による脳集積を評価しているが,この場合には,血糖値制御は行っておらず,集積量は投与量の約0.4%に留まっている16).また,グルコースリガンド以外の系においては,金ナノ粒子表面にトランスフェリンを修飾し,BCECs上のトランスフェリン受容体を介して約1%と高い脳への集積性を報告しているが17),今回の結果はそれら過去の報告を遥かにしのぐ6%もの集積量を達成していることは注目に値する.このような増大は他の臓器では認められず,脳特異的であることが示された.特にGLUTファミリーを発現していることが知られている肝臓(GLUT2),筋肉(GLUT4)における25%Gluc(6)/NMの集積がグルコース投与の影響を受けなかったのは特筆に値する.これは,肝臓のGLUT2発現量が血糖変化に伴い変化するという報告がないことや,筋肉のGLUT4はGLUT1とは逆に血糖値が低い状態で血管側での発現が減少するといった過去の報告を考えると妥当である18).興味深いことに,GLUT1への認識部位であるグルコースの3位のOH基を介してナノマシン表層に導入した25%Gluc(3)/NMを上記と同様の②で投与した場合は,脳への集積はNull/NMと同等の低い値に留まった(0.2%dose/g-brain,図2(a)).同じグルコースをリガンドとし,さらに投与スケジュールも同じであるにも関わらず,25%Gluc(6)/NMと25%Gluc(3)/NMで脳への集積量に顕著な差が確認されたということは,GLUT1がグルコースのC1,C3,C4位のOH基を認識するといった過去の報告12)を考えても妥当である.すなわち,Gluc(3)/NMの場合は,BCECs上に発現するGLUT1へ結合出来ないために脳への集積量が上昇しないものと考えられる.

(a)『給餌制御なし』群および『給餌制御あり+外部刺激』群に対するNull/NM,25%Gluc(6)/NM,25%Gluc(3)/NMの脳集積量.(b)GLUT1阻害薬であるフロレチンを添加した際の25%Gluc(6)/NMの脳集積量.
続いて,25%Gluc(6)/NMの脳への集積がGLUT1を介していることを証明するために,ナノマシンのin vitroにおけるGLUT1認識能評価で使用したGLUT1の阻害薬であるフロレチンをiv投与して,②『給餌制御+外部刺激群』の条件で25%Gluc(6)/NMの脳集積量を評価した.その結果,フロレチン濃度が上昇するに伴って,25%Gluc(6)/NMの脳集積量が減少する(図2(b)),すなわちGluc(6)/NMはGLUT1を介して脳へ集積することが強く示唆された.
3) ナノマシンのBBB通過性,脳内分布および脳内細胞への取り込み評価25%Gluc(6)/NMが脳へ有意に集積していることが明らかになったので,実際にBBBを通過しているかin vivo共焦点顕微鏡(IVRTCLSM)を用いて評価した19).IVRTCLSMは,生体内におけるDDSの組織浸透性などの挙動を時空間的および定量的に分析可能である20).開頭処置後に顕微鏡ステージに麻酔下で固定したマウスに,蛍光標識した25%Gluc(6)/NMをiv投与およびグルコース溶液をip投与(iv投与から30分後)するためのカテーテルを通し,上記の②『給餌制御+外部刺激』と同様のタイムスケジュールでそれぞれ投与し,脳内の25%Gluc(6)/NM由来の蛍光観察を行った.その結果,iv投与後は血流中のみで蛍光が観察され,グルコース溶液をip投与後に脳実質内において拡散する25%Gluc(6)/NM由来の蛍光が確認された(図3(a)).さらに得られた画像について詳細な解析を行い,脳実質部(図3(a)の点線四角内ROI)における平均蛍光強度および血糖値の時間変化に伴う推移を図3(b)に示す.グルコース溶液をip投与後に血糖値が上昇し,それにシンクロナイズして25%Gluc(6)/NMがBBBを通過していることが明らかとなった.GLUTの一回の細胞内リサイクリングに要する時間に関しては,GLUT4で約12~35分と報告があり20),同じGLUTファミリーであるGLUT1についてもほぼ同等の時間と仮定することは合理的である.一方,図3(b)で,脳実質部における25%Gluc(6)/NM由来の蛍光強度はおよそ40分間にわたって上昇を続けており,GLUT1の血管側から脳実質側への一回の移行に要する時間よりも長いことから,GLUT1の複数回の細胞内リサイクリングが関与しているのではないかと推察される.また,BBBを通過するのに必要な血糖値の推移は正常な血糖範囲内(約100~160 mg/dL)であり,生体の恒常性を崩さない程度の介入であることは特筆に値する.
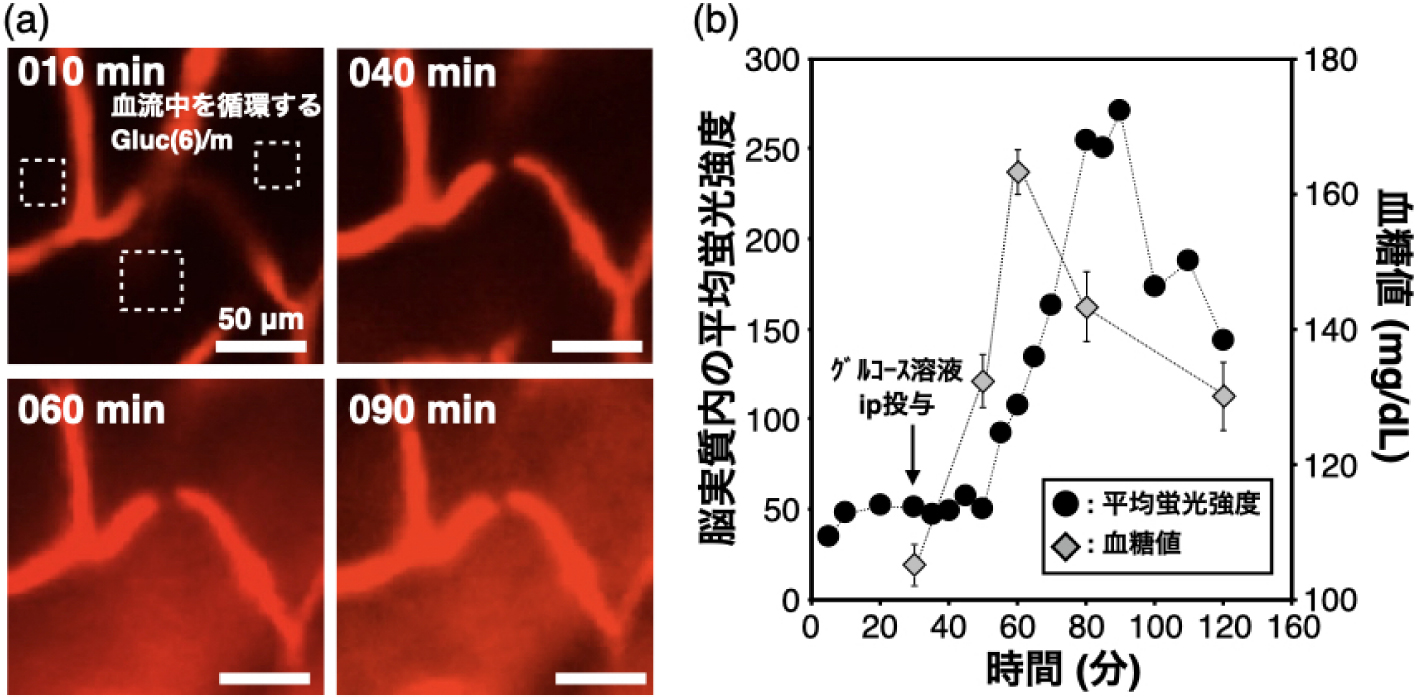
(a)IVRTCLSMによる脳内観察.(b)脳実質内((a)の点線四角内)における平均蛍光強度および血糖値の時間変化に伴う推移.
2光子レーザーを搭載したIVRTCLSMで,25%Gluc(6)/NM投与から48時間後に脳表層から深さ800 μmまでのミセルの分布について観察した.その結果,BBBを通過した25%Gluc(6)/NMが脳の血管外の深部に至るまでスポットとして分布していることが確認された.詳細には,脳表層から比較的浅い「分子層」と呼ばれる細胞体の少ない領域では分布が少なく,より深い脳内細胞が豊富であると報告のある「顆粒細胞層」や「大型錐体細胞層」において,多くの25%Gluc(6)/NMの分布が観察された.
続いてBBBを通過した25%Gluc(6)/NMが,脳実質を構成するどの細胞へ集積しているか,脳切片を作成し蛍光免疫染色を行い共焦点顕微鏡で観察を行なった.その結果,25%Gluc(6)/NMは,主にニューロンやミクログリアに対する集積が顕著に確認された.とりわけ,ニューロンへの薬剤送達は,多くの脳神経系疾患の治療を実現するうえで重要な課題である.一方,BCECsやアストロサイトに対する集積は確認されなかった.アストロサイトは,脳の表層に多く存在することが知られており21),この結果は,脳表層に近い部分で25%Gluc(6)/NMの局在が観察されなかったこととも符合している.
4) ナノマシン表層のグルコース密度による脳集積性への影響評価ここまで25%Gluc(6)/NMについて紹介してきたが,表層に結合しているGluc(6)密度の異なる10%および50%Gluc(6)/NMの脳集積性および脳内分布について紹介する.2-1.で記述したように,全てのナノマシンは表層のグルコース密度以外同じ物性を有している(粒径30 nm,血中循環性など).上述した②『給餌制御+外部刺激』と同様のタイムスケジュールで各種ナノマシンをiv投与し,投与90分後の脳への集積量を評価した.同じ結合様式で(Gluc(6)をリガンド),投与スケジュールも同じであるにも関わらず脳への集積量は顕著に差があり,かつ表層に多くグルコースを結合すれば多量に集積するのではなく(10%:3.7%dose/g-brain,25%:6.0%dose/g-brain,50%:2.9%dose/g-brain),脳へ集積するナノマシン表層のグルコース密度には最適値があることが明らかになった.ここで50%Gluc(6)/NMの脳内分布を,蛍光免疫染色した脳切片を共焦点顕微鏡で観察したところ,ニューロンやミクログリアといった25%Gluc(6)/NMでも集積が確認された細胞に加え,興味深いことに多くがBCECsへ集積しているところが観察された(全ての蛍光免疫染色画像より血管の形状に則した蛍光が確認された).10%Gluc(6)/NMと25%Gluc(6)/NMにおいては,50%Gluc(6)/NMとは対照的にBCECsにおける集積は観察されなかった.このことは,50%Gluc(6)/NMはBCECsに留まるフラクションが多いことを示唆している.高リガンド密度のナノマシンにおいて(50%Gluc(6)/NM),BCECs近傍における集積が多く観察されたのは,Gluc密度が高くなるとGLUT1との解離定数(Kd)が低くなり(結合力が高くなり),脳実質側でGLUT1とGluc(6)/NMが解離できずに,BCECs近傍に集積していると考えると矛盾が無い.また50%Gluc(6)/NMの脳への集積量は25%Gluc(6)/NMより低いが,これは50%Gluc(6)/NMはBCECs中のGLUT1に結合し解離できないためリサイクリングを阻害し(上述したようにBBB通過に関してGLUT1の複数回の細胞内リサイクリングが関与),そのために効率が低くなっていると推測される.これらの結果は,ナノマシン表層のグルコース密度を精密制御することで,脳内細胞やBBBを構築するBCECsへ薬剤を送り分けることが可能であることを支持している.
上記のように,脳内に効率的にナノマシンを送達する方法論を確立した.そこで本システムを要素技術として,高分子化学,材料科学,分子生物学的観点からさらに洗練し,薬剤を疾患部位に送り届ける従来のDDS研究ではなく,既存技術では着想もしない「BBBを効率的に通過」し,「脳分子を回収」,さらには「血液中に帰還」することで,脳分子情報を知らせるナノマシンを構築し,CNS疾患の革新的診断法へと展開し,脳内外の物質移動研究に新たな学術的視点をもたらす『脳分子探査』領域を創成することを着想した.約10年ほど前に小惑星探査機「はやぶさ」は,地球から惑星に到達し,小惑星「イトカワ」の物質を回収し,地球に持ち帰り小惑星の物質情報を分析することに成功した.我々の開発するナノマシンは,血流中からBBBを通過して脳内に到達し,脳内の分子を回収し,血液中に持ち帰り分子解析を行うことを目的とすることから「はやぶさ型ナノマシン」と命名した(図4).「はやぶさ型ナノマシン」計画を実現するために,第96回日本薬理学会年会シンポジウムで紹介させて頂いたように,生体内で活躍するナノマシン設計を行う安楽(東工大)に加えて,抗体を中心としたタンパク質工学を専門とする中木戸 誠(東京大 工),認知情動機能を制御する分子神経機構に関する基礎医学研究を展開している竹本 さやか(名古屋大 環境医学研),うつ病や不安障害といった精神疾患に関する研究を専門とする宮田 茂雄(日薬大),独自の質量分析やプローブ技術によりmiRNA,タンパク質,ペプチド,低分子など多様な分子を超高感度検出する技術を有している川井 隆之(九州大 理),太田 誠一(東京大 工)といった工・医薬・化学の異なる分野・専門性をバックグラウンドとする若手研究者で取り組んでいる.ここで得られる成果は様々な分野への展開が期待される.例えば,脳分子探査により得られる分子情報を解読すること,すなわち,脳分子情報のデコーディングにより,個々の脳機能状態の理解へとつながることが期待される.心理学,情報科学へも波及し,性格や感情の違い,疲れやすさやストレス脆弱性など,いわゆる個性についてアプローチする全く新たな学術創出が期待される.現時点で研究の進む,ゲノム研究や脳画像研究との間を繋ぐ異なる階層で脳機能動態を反映する可能性を有しており,その時々で脳内環境がどのように変化し,それがどのようにヒトの個性と結びつくのか,ゲノムや脳内神経回路といった,比較的長期的な時間軸の観点からの研究を補完する新たな視点をもたらすことが強く期待される.

脳への薬剤の送達を妨げる「血液脳関門(BBB)」を,既存の技術と比較して桁違いに高い効率で通過し,脳内の神経細胞への薬剤送達を可能にする「BBB通過型ナノマシン」の開発に成功した.BBB通過型ナノマシンは,外部刺激(グルコース濃度変化)に応答して能動的にBBBを通過するスマートな機能を有している.食事などによる血糖値変化に伴うBBBの生理的な反応を利用した点が特徴であり,体内投与後に食事をするという簡単な方法だけで脳内に薬剤を効率良く運ぶことが出来る.ナノマシンは,様々なモダリティの医薬品を脳内に運ぶことが出来る.特に従来神経疾患には適応困難であった抗体医薬や核酸医薬といったバイオ医薬品を脳へ送達可能にする画期的な基盤技術であり,根本治療法が確立されていないアルツハイマー病などの難治性脳神経系疾患の治療薬開発を大幅に推進することが期待される.
開示すべき利益相反はない.