2025 Volume 160 Issue 2 Pages 127-140
2025 Volume 160 Issue 2 Pages 127-140
透析そう痒症は,透析手法,透析膜,透析液の改良といった医療技術が向上した現在においても,血液透析患者のQOLを著しく低下させる症状のひとつである.透析そう痒症の要因には,皮膚の乾燥,尿毒症性物質の蓄積,ケミカルメディエーターの過剰産生や免疫機能の変化,そしてオピオイドバランスの崩壊などが考えられている.ジフェリケファリン酢酸塩(製品名:コルスバ®静注透析用シリンジ17.5 μg,同25.0 μg,同35.0 μg.以下,ジフェリケファリン)は新規κオピオイド受容体(KOR)作動薬であり,血液透析患者において末梢のKORを介したかゆみの抑制作用を発揮する.非臨床試験において,ジフェリケファリンはKORに高い選択性を示し,ヒスタミンやサブスタンスPによるそう痒モデル動物で抗そう痒効果を示した.また,ヒト単球由来マクロファージにおけるサイトカイン放出抑制やマウスでリポ多糖投与により誘発されたTNFαやIL-1βなどのサイトカイン放出抑制による抗炎症作用を示した.既治療のそう痒症を有する血液透析患者を対象とした国内第Ⅲ相臨床試験において,ジフェリケファリンは主要評価項目である投与4週時の平均かゆみNRSスコアのベースラインからの変化量でプラセボに対する有意な改善を示した.また,かゆみによる睡眠障害やかゆみに関するQOLの改善効果を示し,かゆみの改善効果は投与58週時まで持続した.さらに,長期投与に伴う副作用の増加傾向はなく,遅発性の有害事象及び副作用も認められなかった.これらの結果に基づき,ジフェリケファリンは血液透析患者におけるそう痒症の改善(既存治療で効果不十分な場合に限る)を効能又は効果として2023年9月に製造販売承認を取得した.透析回路を介した静注製剤であり服薬負担のないジフェリケファリンは,透析そう痒症の新たな治療選択肢になると期待される.
Difelikefalin (KORSUVA® IV Injection Syringe for Dialysis) is a novel kappa opioid receptor (KOR) agonist. In September 2023, difelikefalin was approved for the treatment of pruritus in hemodialysis patients. Pruritus is a major symptom that significantly reduces the quality of life of hemodialysis patients, even with improved dialysis techniques, dialysis membranes, and dialysate solutions. The factors that contribute to pruritus include dry skin, accumulation of uremic toxins, overproduction of chemical mediators and altered immune function, and disruption of the opioid balance. In nonclinical studies, difelikefalin showed highly selective for KOR and antipruritic effects in animal models of histamine- and substance P-induced itching. It also showed anti-inflammatory effects by suppressing cytokine release in human monocyte-derived macrophages and TNFα and IL-1β induced by lipopolysaccharide administration in mice. In the phase 3 clinical trial in Japanese hemodialysis patients, difelikefalin showed significant improvement compared to placebo in the primary endpoint of the change from baseline in the weekly mean NRS score at week 4. It also improved sleep disturbance and itch-related quality of life, and the improvement in itch was sustained up to 58 weeks. Furthermore, there was no increase in adverse drug reactions with long-term treatment, and no delayed adverse events were observed. In conclusion, the novel KOR agonist difelikefalin is expected to be a new treatment option for pruritus on dialysis.
本邦における慢性透析療法を受けている患者総数は2022年末で347,474人であり,そのうち約97%の患者に血液透析が実施されている1).透析そう痒症は透析治療を受ける慢性腎不全患者に認められる疾患であり,血液透析患者の約35%が中等度以上のそう痒症に悩まされている2).中等度から重度のそう痒症を合併する患者では,その他の患者に比べ,睡眠の質の低下及び疲労感を有する割合がそれぞれ1.9~3.7倍及び2.2~5.8倍高く,死亡リスクが22%高い3).さらに,重度のそう痒症では生命予後が約1.6倍悪化することから,そう痒症は独立した死亡の予測因子である4).
血液透析患者におけるそう痒症の原因は十分に解明されておらず,難治性である.透析そう痒症は複数の因子が関与しており,皮膚の乾燥による感受性の亢進,血中のカルシウム,リン,β2ミクログロブリンや尿毒症性物質の蓄積,ヒスタミンやサブスタンスPなどのケミカルメディエーターやサイトカイン類の過剰産生,オピオイドバランスの異常などの要因が挙げられる5–8).透析治療において,活性型ビタミンDや高リン血症治療薬による骨ミネラル代謝異常の管理,High-flux dialyzerやオンライン血液濾過透析による低~中分子量の尿毒症性物質の効率的な除去が可能になったものの,そう痒症は依然として血液透析患者で多く認められる.
オピオイド受容体にはμオピオイド受容体(MOR),κオピオイド受容体(KOR)及びδオピオイド受容体(DOR)のサブタイプが存在し,中枢神経系,皮膚,内臓などの末梢組織及び免疫系に分布する9–11).これら受容体の活性化は鎮痛作用が共通して認められる一方,MORは内因性のβエンドルフィンと結合しかゆみを誘発し,KORは内因性のダイノルフィンと結合しかゆみを抑制するなど,相反した作用も報告されている12).そう痒症を有する血液透析患者では,かゆみを誘発するμオピオイド系がかゆみを抑制するκオピオイド系より優位になっていると考えられている13).KORは表皮から一次求心性ニューロンの末梢神経終末まで広く発現しており14,15),皮膚内のマクロファージ,ケラチノサイト,肥満細胞及びT細胞から発生するそう痒シグナルを末梢で遮断する16,17).また,炎症反応はかゆみを増悪させる因子の一つであることが知られており18,19),KORアゴニストはTLR4/NF-κBシグナル阻害によるTNF-αの減少やIL-4,IL-13,IL-31,IL-33などのサイトカイン及びサイトカイン受容体の発現をダウンレギュレーションして抗炎症作用を示す7,20).KORの活性化は抗そう痒作用及び抗炎症作用を引き起こすこと,末梢のKORは中枢のKORで認められる不快感,嫌悪感,鎮静,不眠,乱用などの回避・軽減が期待されることから21),末梢のKORは透析そう痒症を改善するための重要なターゲットである22,23).
血液透析患者におけるそう痒症の治療は,乾燥肌に対して保湿剤,炎症などの皮膚症状に対して外用ステロイド剤,さらに病態に応じて抗ヒスタミン薬や抗アレルギー薬などの内服薬が使用されている7,8).これらの治療で十分に奏功しない場合,海外ではガバペンチンやプレガバリンが,本邦ではKOR作動薬であるナルフラフィンが使用されている2,24).透析そう痒症には様々な治療アプローチが試みられるも,中等度以上のそう痒症を合併する血液透析患者の割合は2009年以降ほぼ横ばいであり25),医療ニーズは十分に満たされていない.また,ポリファーマシーは血液透析患者においても問題視されており,血液透析患者の1日の平均総処方錠数は17.8錠,平均処方種類数は8.6種類と報告されている26).1日6種類以上の薬剤を併用することで薬物有害事象の発生が増加すると報告されている27)ことからも,中等度以上のそう痒症に有効かつ患者の服薬負担を軽減する治療方法は重要である.
ジフェリケファリン酢酸塩(以下,ジフェリケファリン)は,米国Cara Therapeutics社が開発したKOR作動薬であり,D-アミノ酸とピペリジンからなるテトラペプチドである(図1).ジフェリケファリンは透析回路より注入する静注製剤であることから,血液透析患者において服薬の負担がない.米国では2021年8月,欧州では2022年4月に血液透析患者におけるそう痒症を適応症として承認されている.本邦では2013年4月に丸石製薬株式会社がCara Therapeutics社から導入して開発を開始し,2017年3月より,キッセイ薬品工業株式会社と共同開発を行った.血液透析患者を対象としたジフェリケファリンの有効性及び安全性を検証する国内第Ⅲ相臨床試験の成績をもって,2023年9月に「血液透析患者におけるそう痒症の改善(既存治療で効果不十分な場合に限る)」を効能又は効果として医薬品製造販売承認を取得した.2024年2月現在,40の国又は地域で承認されている.

化学名:4-Amino-1-(d-phenylalanyl-d-phenylalanyl-d-leucyl-d-lysyl)piperidine-4-carboxylic acid acetate 分子式:C36H53N7O6·xC2H4O2 平均分子量:679.85.
本稿ではジフェリケファリンの薬理学及び薬物動態学的特徴と臨床試験成績を紹介する.
ヒトκオピオイド受容体(hKOR),μオピオイド受容体(hMOR)及びδオピオイド受容体(hDOR)に対してバインディングアッセイを行い,ジフェリケファリンの受容体選択性について検討した.ジフェリケファリン(10 μmol/L)のhKOR,hMOR及びhDORに対するリガンド結合の阻害率はそれぞれ95,14及び<10%であった.また,hKORに対するKiは,0.32 nmol/Lであったことから,ジフェリケファリンは,hKORに高い親和性を示すことが明らかとなった(表1).
| 受容体 | リガンド結合に対する阻害率(%) (ジフェリケファリン10 μmol/L) |
Ki (nmol/L) |
|---|---|---|
| hKOR | 95 | 0.32 |
| hMOR | 14 | ― |
| hDOR | <10 | ― |
数値は平均値(n=2)を示す.―:実施していない.
マウスκオピオイド受容体(mKOR)の受容体機能活性を,cAMPアッセイを用いて評価した.マウスR1G1細胞を用い,フォルスコリン共存下でジフェリケファリンによるcAMPの産生に及ぼす影響を測定した.また,hKOR,hMOR及びhDORの受容体機能活性は,各受容体を発現させたHEK293細胞を用いて,ルシフェラーゼレポーター遺伝子アッセイで評価した.cAMPアッセイ及びレポーターアッセイから得られた値より,50%効果濃度(EC50)及び最大可能効果に対する割合(percent of maximum possible effect:%MPE)を%Efficacyとして算出した.mKORに対するジフェリケファリンの%Efficacyは96%,EC50は0.048 nmol/Lであった.また,hKORに対するジフェリケファリンの%Efficacyは99%,EC50は0.16 nmol/Lであり,hMOR及びhDORに対しては10,000 nmol/Lまで作用活性を示さなかった(表2).
| 受容体 (アッセイ法) |
EC50 (nmol/L) |
%Efficacy |
|---|---|---|
| mKOR(cAMP) | 0.048 | 96 |
| hKOR(RGA) | 0.16 | 99 |
| hMOR(RGA) | >10,000 | 0 |
| hDOR(RGA) | >10,000 | 0 |
数値は平均値を示す(n=1~4).
さらに,ジフェリケファリン(10 μmol/L)の濃度では,オピオイド受容体以外の受容体,トランスポーター及びイオンチャネルへのリガンド結合並びに酵素活性に対する作用を評価したが,30%以上の阻害は示さなかった.以上のことからジフェリケファリンはKORに特異的な完全作動薬であることが示された.
2) そう痒モデル動物に対する抗そう痒作用31)マウス頸背部にヒスタミン(2 nmol/μL,50 μL/site)を皮内投与し,投与直後から30分間の引っ掻き行動を計測した.ジフェリケファリン(0.03~1 mg/kg)の静脈内投与及びジフェンヒドラミン塩酸塩(20 mg/kg)の腹腔内投与はそれぞれヒスタミン投与の15分前及び30分前に行った.溶媒群はジフェリケファリン及びヒスタミンに代えて生理食塩液を投与し,対照群はジフェリケファリンに代えて生理食塩液を投与した.引っ掻き行動回数は,ジフェリケファリンの静脈内投与により用量依存的に減少し,0.03~1 mg/kgの用量で有意な減少を示した.ジフェリケファリンの50%有効量(ED50)は,0.018 mg/kgであった.また,陽性対照であるジフェンヒドラミン塩酸塩(20 mg/kg)の腹腔内投与も有意な減少を示した(図2A).

A:ヒスタミン誘発そう痒行動に対するジフェリケファリンの抗そう痒作用.マウス頸背部にヒスタミン(2 nmol/μL,50 μL/site)を皮内投与し,投与直後から30分間の引っ掻き行動を計測した.ジフェリケファリン(0.03~1 mg/kg)の静脈内投与及びジフェンヒドラミン塩酸塩(20 mg/kg)の腹腔内投与はそれぞれヒスタミン投与の15分前及び30分前に行った.溶媒群はジフェリケファリン及びヒスタミンに代えて生理食塩液を投与し,対照群はジフェリケファリンに代えて生理食塩液を投与した.データは平均値+標準誤差(n=10)を示す.**P<0.01 vs. 溶媒(Student t検定).#P<0.05,##P<0.01 vs. 対照(Shirley-Williams検定).$$P<0.01 vs. 対照(Student t検定).
B:サブスタンスP誘発そう痒行動に対するジフェリケファリンの抗そう痒作用.マウス頸背部にサブスタンスP(2 nmol/μL,50 μL/site)を皮内投与し,投与直後から30分間の引っ掻き行動を計測した.ジフェリケファリン(0.03~1 mg/kg)の静脈内投与及びナルトレキソン塩酸塩(10 mg/kg)の皮下投与はそれぞれサブスタンスP投与の15分前及び30分前に行った.溶媒群はジフェリケファリン及びサブスタンスPに代えて生理食塩液を投与し,対照群はジフェリケファリンに代えて生理食塩液を投与した.データは平均値+標準誤差(n=10)を示す.**P<0.01 vs. 溶媒(Student t検定).#P<0.05,##P<0.01 vs. 対照(Shirley-Williams検定).$$P<0.01 vs. 対照(Student t検定).
マウス頸背部にサブスタンスP(2 nmol/μL,50 μL/site)を皮内投与し,投与直後から30分間の引っ掻き行動を計測した.ジフェリケファリン(0.03~1 mg/kg)の静脈内投与及びナルトレキソン塩酸塩(10 mg/kg)の皮下投与はそれぞれサブスタンスP投与の15分前及び30分前に行った.溶媒群はジフェリケファリン及びサブスタンスPに代えて生理食塩液を投与し,対照群はジフェリケファリンに代えて生理食塩液を投与した.引っ掻き行動回数は,ジフェリケファリンの静脈内投与により,0.3~1 mg/kgの用量で有意な減少を示した.ジフェリケファリンのED50は,0.32 mg/kgであった.また,陽性対照であるナルトレキソン塩酸塩(10 mg/kg)の皮下投与も有意な減少を示した(図2B).
ジフェリケファリン(0.3 mg/kg)の静脈内投与0.5,6,12,18及び24時間後にサブスタンスP(5 nmol/μL,50 μL/site)をマウス頸背部に投与して引っ掻き行動を惹起した.ジフェリケファリンは投与後0.5,6及び12時間時点におけるサブスタンスP誘発引っ掻き回数を有意に抑制した.このことからジフェリケファリンの抗そう痒作用は,少なくとも12時間持続することが示された.サブスタンスP誘発そう痒モデルマウスに対するジフェリケファリン(0.3 mg/kg)の抗そう痒作用は,KOR拮抗薬のノルビナルトルフィミン(nor-BNI)(3,10及び30 mg/kg)の皮下投与により用量依存的に拮抗された.なお,nor-BNI 30 mg/kgの単独投与は,サブスタンスP誘発引っ掻き回数に影響しなかった.以上より,ジフェリケファリンの抗そう痒作用はKORを介することが示された.
3) 抗炎症作用 (1) マウスを用いたリポ多糖(LPS)により誘発されたサイトカインの放出に対するジフェリケファリンの作用32)マウスにジフェリケファリンを皮下投与し,その30分後にLPS(1 mg/kg)を腹腔内投与した.LPS投与2時間後に心臓採血し,血清を回収し,GM-CSF,IL-1α,IL-1β,IL-2,IL-4,IL-6,IL-10,IL-12(p40/p70),MCP-1,MIP-1α,MIP-1β及びTNFαの濃度をLuminexシステムを用いて測定した.ジフェリケファリン(10 mg/kg)は,TNFα,IL-1β,IL-2,MIP-1β及びIL-12(p40/p70)の放出を有意に減少させた(表3).以上のことからジフェリケファリンは抗炎症作用を示すことが確認された.
| サイトカイン | ジフェリケファリン (10 mg/kg)阻害率(%) |
|---|---|
| TNFα | 47* |
| IL-1β | 26* |
| IL-2 | 23* |
| MIP-1β | 19* |
| IL-12(p40/p70) | 23* |
| MIP-1α | 19 |
| IL-1α | -37 |
| IL-4 | 21 |
| IL-10 | 26 |
| IL-6 | -10 |
| MCP-1 | -11 |
| GM-CSF | 7 |
数値は平均値(n=8)を示す.*P<0.05 vs. 溶媒(対応のないt検定).
ヒト末梢静脈血から単球を単離し,顆粒球マクロファージコロニー刺激因子によりマクロファージに分化させた細胞にジフェリケファリン(2,10及び50 nmol/L)又はIL-10(10 ng/mL)を4時間処置後,LPS(1 μg/mL)及びIFNγ(10 ng/mL)を18時間処置し,IL-1β,IL-6,IL-8,TNFα及びG-CSFの濃度をLuminex 100システムを用いて測定した.ジフェリケファリンはヒトマクロファージをLPS及びIFNγで刺激した際のIL-1β,IL-6,IL-8,TNFα及びG-CSFの放出を有意に抑制した(表4).この作用はnor-BNIにより阻害されたことから,ジフェリケファリンの抗炎症作用は免疫細胞上のKOR活性を介することが示唆された.
| サイトカイン | 無処置 | ジフェリケファリン (2 nmol/L) |
ジフェリケファリン (10 nmol/L) |
ジフェリケファリン (50 nmol/L) |
ジフェリケファリン (50 nmol/L)+ nor-BNI (10 nmol/L) |
IL-10 (10 ng/mL) |
nor-BNI (10 nmol/L) |
|
|---|---|---|---|---|---|---|---|---|
| LPS/IFNγ 刺激なし |
LPS/IFNγ 刺激あり |
|||||||
| IL-1β | 1.6 (0.0) |
75.4 (7.6) |
30.8** (2.2) |
45.3** (1.1) |
21.5** (2.4) |
66.7## (2.3) |
2.1¶¶ (1.1) |
39.9 (1.1) |
| IL-6 | 63.8 (1.2) |
677.7 (96.4) |
461.7* (25.5) |
398.0 (108.4) |
563.7 (53.9) |
812.2## (23.7) |
138.6¶ (3.3) |
803.9 (0.6) |
| IL-8 | 255.3 (99.6) |
1457.1 (111.7) |
1045.4* (64.2) |
644.6** (107.8) |
1211.3 (56.7) |
1405.9§∫∫ (36.1) |
371.7¶¶ (5.8) |
1595.1 (13.3) |
| TNFα | 628.2 (182.6) |
7928.9 (108.0) |
5558.1*** (243.1) |
4044.2*** (350.6) |
6603.4** (235.6) |
9599.9## (128.4) |
3241.4¶¶ (280.6) |
7185.6 (174.8) |
| G-CSF | 730.0 (21.1) |
5230.4 (109.5) |
1304.2*** (296.2) |
2210.6*** (24.9) |
1047.0*** (121.9) |
3881.7## (82.2) |
1032.3¶¶ (21.4) |
1214.3 (29.9) |
数値は平均値(標準誤差)(pg/mL,n=3)を示す.*P<0.05,**P<0.01,***P<0.001 vs. LPS/IFNγ刺激のみ.##P<0.001 vs. LPS/IFNγ刺激+ジフェリケファリン2 nmol/L,10 nmol/L,50 nmol/L.§P<0.05 vs. LPS/IFNγ刺激+ジフェリケファリン50 nmol/L.∫∫P<0.01 vs. LPS/IFNγ刺激+ジフェリケファリン2 nmol/L or 10 nmol/L.¶P<0.005,¶¶P<0.001 vs. LPS/IFNγ刺激のみ.(ANOVAと両側t検定)
ラットに,ジブチルスズジクロライド(DBTC)の静脈内投与により慢性膵炎を誘発させた.膵炎の痛みは,4 gのvon Frey filamentで腹部を刺激(10秒に1回合計10回)し,腹部を激しく引っ込める,腹部を舐める又は全身を引っ込める行動を腹部痛覚過敏として評価した.DBTC投与6日後に痛覚過敏が認められたモデル動物に,ジフェリケファリン(0.1,0.3及び1 mg/kg)又は溶媒として生理食塩液を腹腔内投与し,薬物投与後,疼痛測定を30分ごとに投与120分後まで行い,ED50を%MPE((各測定時点における疼痛反応の回数-DBTC投与後(各薬物投与前)の疼痛反応を示した回数)/(DBTC投与前の疼痛反応を示した回数-DBTC投与後(各薬物投与前)の疼痛反応を示した回数)×100より算出)を用いて,直線回帰分析により算出した.ジフェリケファリンは,DBTC誘発慢性膵炎の腹部痛覚過敏を用量依存的に有意に抑制し(図3A),ジフェリケファリン投与後30分時点におけるED50は0.03 mg/kgであった.陽性対照であるナプロキセン(30 mg/kg)の経口投与により,DBTC誘発慢性膵炎による腹部痛覚過敏を有意に抑制した.ジフェリケファリン(1 mg/kg)を腹腔内投与し,さらにnor-BNI(1 mg/kg)及び非選択的な末梢性オピオイド受容体拮抗薬のナロキソンメチオジド(NM,10 mg/kg)をジフェリケファリン投与30分前に腹腔内投与した.nor-BNI及びNMはジフェリケファリンの鎮痛作用に対して拮抗作用を示したことから(図3B,3C),ジフェリケファリンの鎮痛作用は,末梢性KORを介していることが示唆された.
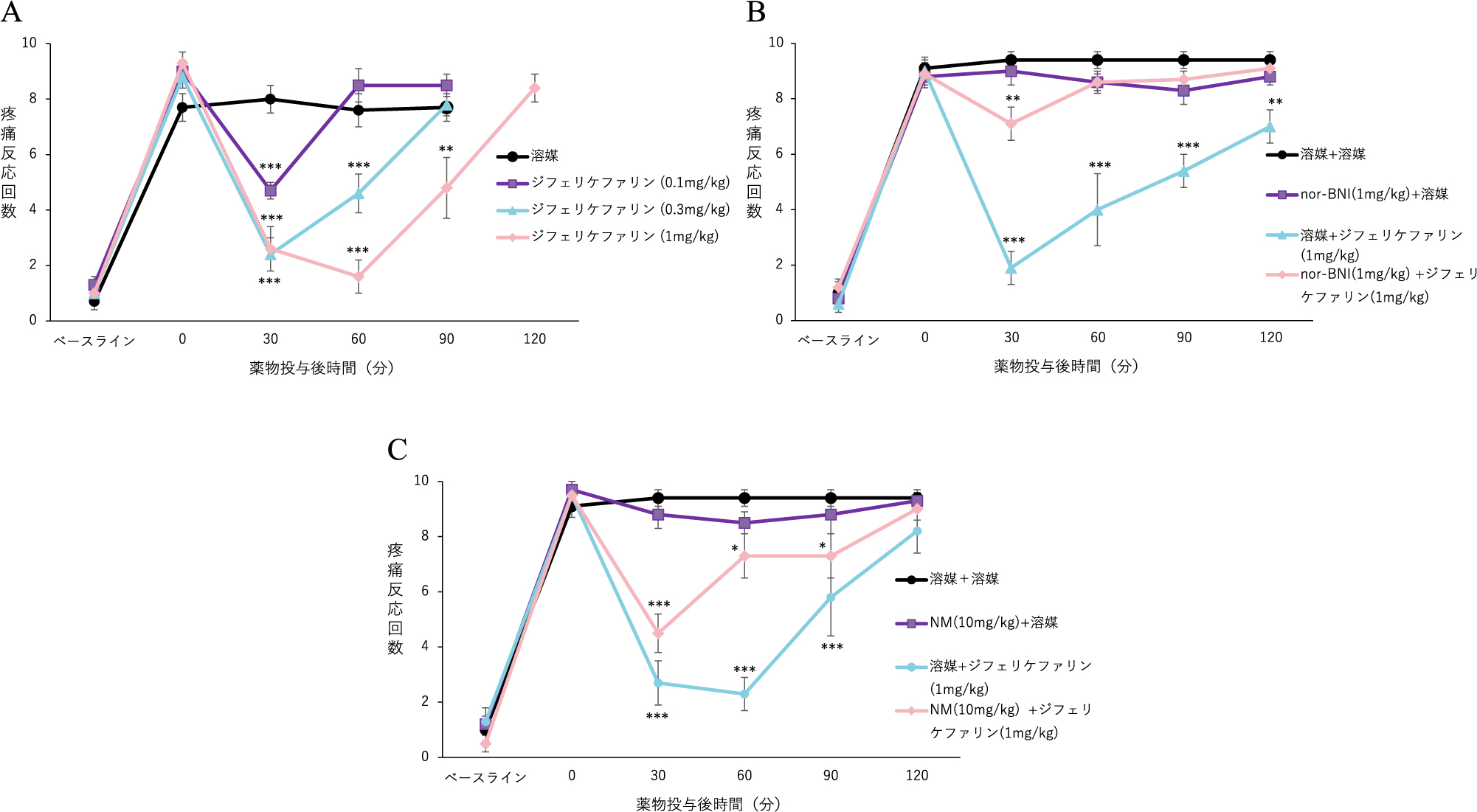
A:ラット慢性膵炎モデルに対するジフェリケファリンの鎮痛作用.ジフェリケファリン(0.1,0.3及び1 mg/kg)又は溶媒として生理食塩液を腹腔内投与し,薬物投与後,疼痛測定を30分ごとに投与120分後まで行った.データは平均値±標準誤差(n=6~9)を示す.**P<0.01,***P<0.001 vs. 溶媒(two-way ANOVA+Bonferroni検定).
B:ラット慢性膵炎モデルを用いたジフェリケファリンの鎮痛作用に対するノルビナルトルフィミン(nor-BNI)による拮抗作用.ジフェリケファリン(1 mg/kg)及び溶媒(生理食塩液)を腹腔内投与し,nor-BNI(1 mg/kg)はジフェリケファリンあるいは溶媒の投与30 分前に腹腔内投与した.薬物投与後,疼痛測定を30分ごとに投与120分後まで行った.データは平均値±標準誤差(n=8~9)を示す.**P<0.01,***P<0.001 vs. 溶媒+溶媒(two-way ANOVA+Bonferroni検定).
C:ラット慢性膵炎モデルを用いたジフェリケファリンの鎮痛作用に対するナロキソンメチオジド(NM)による拮抗作用.ジフェリケファリン(1 mg/kg)及び溶媒(生理食塩液)を腹腔内投与し,NM(10 mg/kg)はジフェリケファリンあるいは溶媒の投与30 分前に腹腔内投与した.薬物投与後,疼痛測定を30分ごとに投与120分後まで行った.データは平均値±標準誤差(n=6~8)を示す.*P<0.05,***P<0.001 vs. 溶媒+溶媒(two-way ANOVA+Bonferroni検定).
場所嗜好性/嫌悪性試験の装置には,白及び黒のボックスが灰色の通路で連結された3コンパートメントボックスを使用した.白の区画はステンレスの網目床,黒の区画はステンレスの格子床で構成されており,視覚に加え触覚の違いを条件刺激とした.条件付け前に動物を中央の区画に置き,白及び黒それぞれの区画の滞在時間を測定してベースラインの嗜好性を求め,カウンターバランス法により群分けした.条件付けは,ラットに,ジフェリケファリン(0.32,1及び3.2 mg/kg),モルヒネ(陽性嗜好対照群,3.2 mg/kg),U50,488H(陽性嫌悪対照群,3.2 mg/kg)又は溶媒(生理食塩液)を静脈内投与し,白あるいは黒のボックス(仮想的な条件付け区画)に30分間置き,その後,薬物及び溶媒の投与とボックスの組み合わせを入れ替え,再度ボックスに置くことで行った.これらの操作を1セッションとし,この条件付けを2日間繰り返し,その翌日,試験を行った(試験1).その翌日に条件付けセッションをもう一度繰り返し,その後,同様に試験を行った(試験2).試験試行では,動物に薬物及び溶媒は投与せず,白・黒ボックスの滞在時間を測定し,薬物投与側の滞在時間が溶媒投与側の滞在時間より長い場合は薬物の報酬効果の発現,短い場合は嫌悪効果の発現と評価した.試験1では,各薬物投与群は,溶媒群と比べて有意な差は認められなかった(図4A).試験2では,モルヒネの投与により有意な場所嗜好性が認められたが,他の薬物投与群では場所嗜好性は認められなかった(図4A).以上の結果,ジフェリケファリンは溶媒群と比べて有意な場所嗜好性及び嫌悪性を示さなかった.

A:各薬物処置後の場所嗜好性/嫌悪性.ジフェリケファリン(0.32,1及び3.2 mg/kg),モルヒネ(陽性嗜好対照群,3.2 mg/kg),U50,488H(陽性嫌悪対照群,3.2 mg/kg)又は溶媒(生理食塩液)を静脈内投与した.データは平均値±標準誤差(n=10~14)を示す.*P<0.05 vs. 溶媒(Tukey-Kramer検定).
B:ラットにおける薬物自己投与試験.ジフェリケファリン(0.001,0.005,0.025及び0.125 mg/kg),ヘロイン(陽性対照群,0.015 mg/kg)又は溶媒(対照群,生理食塩液)を静脈内投与した.データは平均値±標準誤差(n=5~8)を示す.†††P<0.001 vs. 溶媒(多重t検定).***P<0.001 vs. ヘロイン(Dunnett’s検定).
最初に,ラットに餌を報酬として自己投与のためのレバー押しの訓練を行った.次に,薬物投与のためラットの頸静脈にカテーテルを埋植し,レバーを5回押すごとにジアモルヒネ塩酸塩(ヘロイン,0.015 mg/kg)が1回投与される条件の自己投与の訓練を行った.この訓練を行ったラットを用い,ジフェリケファリン(0.001,0.005,0.025及び0.125 mg/kg)群,溶媒(対照群,生理食塩液)群,ヘロイン(陽性対照群,0.015 mg/kg)群及びペンタゾシン(比較対照群,0.03,0.1,0.245 mg/kg)群を設定し,各薬物の自己投与回数を測定した.投与はヘロイン(1)→生理食塩液(1)→ジフェリケファリン→生理食塩液(2)→ヘロイン(2),又はヘロイン→生理食塩液→ペンタゾシンの順で行った.自己投与回数測定の結果,ジフェリケファリン群は溶媒群と同等であった(図4B).以上の結果,ヘロイン維持ラットにおいてジフェリケファリンの強化効果は認められなかった.
(3) ラットにおける薬物弁別試験本試験はラットを用いて実施した.2つのレバーが備え付けられたオペラント実験箱を用いて,ペンタゾシン(腹腔内投与,5 mg/kg)の投与では一方のレバーを,溶媒(腹腔内投与,0.25%メチルセルロース/生理食塩液)を投与した場合はもう一方のレバーを押すと報酬(餌)が貰えるように訓練を行い,レバーを正しく選択(弁別)できるようになった動物を使用して,般化試験を行った.
ペンタゾシン(0,0.017,0.05,0.17及び0.5 mg/kg),ジフェリケファリン(0,0.05,0.125,0.25及び0.5 mg/kg)及びブトルファノール(比較対照群,0,0.001,0.01,0.05及び0.25 mg/kg)を静脈内投与し,投与15分後にオペラント実験箱に10分間入れ,ペンタゾシンあるいは溶媒に割り当てた,それぞれのレバー押しの回数を測定し,ペンタゾシンへの般化を検討したところ,ペンタゾシン及びブトルファノールは用量依存的にペンタゾシンへの般化を示した.一方,ジフェリケファリンのペンタゾシンへの部分般化の作用は弱く,用量相関性も認められなかった(表5).
| 試験方法 | 般化試験 | |||
|---|---|---|---|---|
| 被験物質 | 用量 (mg/kg) |
N | ペンタゾシンへの般化率(%)a) (Mean±SD) |
結果b) |
| ペンタゾシン (iv) |
0(溶媒) | 10 | 16.6±4.8 | Vehicle |
| ペンタゾシン(ip) | 10 | 85.5±4.8 | Pentazocine | |
| 0.017 | 6 | 17.7±8.9 | Vehicle | |
| 0.05 | 7 | 29.9±16.0 | Partial | |
| 0.17 | 6 | 36.4±23.6 | Partial | |
| 0.5 | 6 | 75.8±8.2 | Pentazocine | |
| ジフェリケファリン (iv) |
0(溶媒) | 15 | 19.1±4.4 | Vehicle |
| ペンタゾシン(ip) | 15 | 82.2±4.7 | Pentazocine | |
| 0.05 | 7 | 23.6±10.5 | Vehicle | |
| 0.125 | 7 | 35.4±20.2 | Partial | |
| 0.25 | 7 | 31.0±17.9 | Partial | |
| 0.5 | 7 | 34.5±10.1 | Partial | |
| ブトルファノール (iv) |
0(溶媒) | 10 | 19.7±4.6 | Vehicle |
| ペンタゾシン(ip) | 10 | 83.9±6.5 | Pentazocine | |
| 0.001 | 6 | 17.1±11.7 | Vehicle | |
| 0.01 | 6 | 52.9±30.9 | Partial | |
| 0.05 | 6 | 60.8±22.4 | Partial | |
| 0.25 | 7 | 76.6±17.5 | Pentazocine | |
iv:静脈内投与,ip:腹腔内投与
a):ペンタゾシンへの般化率(%)=ペンタゾシンのレバー押し回数/総レバー押し回数×100
b):Vehicle:≤25% Generalization to Pentazocine,Partial:26~74% Generalization to Pentazocine,Pentazocine:≥75% Generalization to Pentazocine
ラットにジフェリケファリン(5 mg/kg/day)又は溶媒(対照群,生理食塩液)を各群15又は11例に1日1回28日間反復静脈内投与した.陽性対照としてモルヒネ(30 mg/kg/回)とその溶媒(水)を各10例に1日2回28日間反復経口投与した.各群,28日間の投与終了後,7日間の退薬期間を設けた.投与から退薬期間中,一般症状観察,体重,摂餌量,摂水量及び直腸温の測定を行い,身体依存性を評価した.また,サテライト動物を用いて血漿中ジフェリケファリン濃度を測定した.投与期間及び退薬期間中,いずれの群においても死亡例はみられなかった.投与期間中,ジフェリケファリン群では,症状観察において全例でよろめき歩行,猫背姿勢,不活発,立毛,眼球突出が投与2~3週までみられた.また,対照群と比較して体重減少が投与翌日~16日及び摂餌量減少が投与翌日~5日において一過性にみられた.摂水量及び直腸温ではジフェリケファリンに関連したと考えられる変化はみられなかった.退薬期間中の一般状態,体重,摂餌量,摂水量及び直腸温の変化は対照群と同程度であった.一方,モルヒネ投与群では,投与期間中,全例で猫背姿勢,不活発,挙尾,頭振り,立毛,眼球突出,被毛の汚れなどの症状がみられ,体重(投与4~28日),摂餌量(投与1~28日)び摂水量(投与2~28日)の減少及び直腸温(投与5~28日)の低下がみられた.また,投与初日に体調(筋緊張度も含む体姿勢,探索行動や身づくろい等の行動変化)の低下及び自発運動減少がみられたが,投与3日以降には体調改善,自発運動亢進,音への反応性増加の症状がみられ,投与初期に認められた症状が消失した.退薬期間では,よろめき歩行,猫背姿勢,挙尾,立毛,興奮増大やライジングや尾振りなどの新たな行動及び身体徴候が認められ,体重,摂餌量及び摂水量の減少及び直腸温の低下あるいは代償性の体重及び摂餌量増加がみられた.したがって,ジフェリケファリンにはモルヒネで認められるような明らかな退薬症状や身体依存性は認められなかった.また,血漿中ジフェリケファリン濃度のCmax及びAUClastは投与初日で22,250 ng/mL及び9,987 ng·h/mL,投与28日で25,550 ng/mL及び11,310 ng·h/mLであり,蓄積性は軽微であった.なお,ジフェリケファリン5 mg/kg 投与時のCmaxは臨床用量である0.5 μg/kg投与時のCmaxの約5,000倍に相当する.
以上の結果,ジフェリケファリンにおいて精神依存及び身体依存を発現する可能性は極めて低いと考えられる.
日本人血液透析患者9例を対象にジフェリケファリン0.5 μg/kg(5例)及び1.0 μg/kg(4例)の用量で1週間に3回(1日目,3日目,5日目),透析終了時の返血時に透析回路静脈側から投与したところ,0.5及び1.0 μg/kg群で,初回投与後のCmaxはそれぞれ4.38及び8.95 ng/mL,AUCinfはそれぞれ97.38及び240.05 ng·h/mLであった.3回目投与後のCmaxはそれぞれ5.38及び8.69 ng/mL,AUCinfはそれぞれ151.34及び316.85 ng·h/mLであり,用量依存的な増加がみられた.T1/2は初回投与後では34.1及び39.0時間,3回目投与後では40.0及び49.3時間であった(図5).透析後の血漿中ジフェリケファリン濃度は透析前の値から76%低下し,ジフェリケファリンは透析により効率的に血漿から除去された.

日本人血液透析患者9例を対象にジフェリケファリン0.5 μg/kg又は1.0 μg/kgの用量で1週間に3回(1日目,3日目,5日目),透析終了時の返血時に透析回路静脈側から投与した.データは平均値±標準偏差を示す.
日本人既治療のそう痒症を有する血液透析患者184例を対象に,ドライウェイトに基づく体重区分に応じてジフェリケファリン0.25,0.5又は1.0 μg/kgの用量で週3回透析終了時の返血時に透析回路静脈側から8週間投与したときの血中濃度推移を図6に示す.1週目,4週目及び7週目の投与後5分,2回目透析前及び週はじめの透析前のいずれの時点においても用量依存的な薬物濃度の増加が認められた.また,平均血漿中ジフェリケファリン濃度は投与早期よりほぼ一定の濃度で推移したことから,投与早期より定常状態に到達したと考えられた.血漿中ジフェリケファリン濃度は,1週目,4週目及び7週目のいずれの時点においても,同一投与群における各体重区分の間で大きな差は認められなかった.

日本人既治療のそう痒症を有する血液透析患者184例を対象に,ジフェリケファリン0.25,0.5,1.0 μg/kg又はプラセボを8週間,週3回の透析終了時の返血時に透析回路静脈側から投与した.ジフェリケファリン0.25,0.5及び1.0 μg/kg群の投与量は,投与日のドライウェイトに基づき決定した.データは平均値+標準偏差を示す.
ラットにジフェリケファリン3 mg/kgを単回静脈内投与したとき,脳中ジフェリケファリン濃度は投与後0.5時間で最も高く,その後は経時的に低下したが,血漿中ジフェリケファリン濃度よりも緩慢で,投与後3時間で約1/10に低下した.投与後0.5及び1時間の脳/血漿中濃度比は非常に小さかった(約0.02)ことから単回投与において脳組織への移行性は低いことが示唆された.
ジフェリケファリンを6日間さらに14C-ジフェリケファリンを1日間1 mg/kgの用量で1日1回計7日間,ラットに反復静脈内投与したとき,組織内放射能は最終投与後0.0833時間(5分)ではすべての組織で最高濃度となり,血漿,腎臓,腎臓皮質及び腎臓髄質には高濃度の放射能(3,803~22,959 ng eq./mL or g)が認められた.腎臓,腎臓皮質及び腎臓髄質には投与後168時間(7日)においても高濃度放射能(479~1,890 ng eq./g)が認められたが,中枢神経系の放射能濃度は2.56~3.24 ng ne eq./gであったことから反復投与においても脳組織への移行性は低いことが示唆された.
雄性サルに14C-ジフェリケファリン1 mg/kgを単回静脈内投与したときの投与後0.5時間の頭部ARGM(autoradiogram)の結果から,組織内放射能は大脳への分布はほとんど認められず,灰白質を含むその他の脳組織にもほとんど分布は認められなかった.また,投与後0.5及び24時間の全身ARGMの結果から,組織内放射能は投与後0.5時間では腎臓,膀胱内尿,胃内容物,肝臓,皮膚,血液及び肺に多く分布したが,大脳,小脳,眼球及び脊髄などの組織にはほとんど分布しなかった.投与後24時間では,腎臓及び膀胱内尿中の放射能の分布は投与後0.5時間と同程度であり,組織内放射能分布も同様であった.以上の結果から,ジフェリケファリンは血液脳関門を透過して脳内へ移行しにくいことが示唆された.
妊娠ラットにジフェリケファリンを0.6,2.5及び10 mg/kgの用量で,妊娠7日から20日までの期間,1日1回反復静脈内投与したときの妊娠20日における母動物及び胎児血漿中ジフェリケファリン濃度から胎盤通過性を評価した.母動物及び胎児血漿中ジフェリケファリン濃度はおおむね用量依存的な増加を示し,胎児/母動物血漿中濃度比は0.6,2.5及び10 mg/kgでそれぞれ0.025,0.027及び0.025とほぼ一定であり,ジフェリケファリンは胎盤を通過することが示唆された.
3) 代謝・排泄42,43)ラット,イヌ,サル及びヒト凍結肝細胞を用いて,ジフェリケファリン(10 μmol/L)を37°Cで120分間反応させたところ,いずれの種においても未変化体のみが検出され,ジフェリケファリンの酸化体,抱合体(硫酸抱合体及びグルクロン酸抱合体)及び水酸化体は認められず,ジフェリケファリンは肝代謝を受けにくいことが示唆された.
健康成人(6例)並びに血液透析患者(6例)に14C-ジフェリケファリン(100 μCi,ジフェリケファリンの総投与量として1.7~3.0 μg/kg)を投与した際,放射能の総回収率(平均値±SD)は健康成人では投与放射能量の91.8±2.3%であり,そのうち尿中及び糞中排泄率は,それぞれ投与放射能量の80.5±3.9%及び11.3±2.9%であり,健康成人における主な排泄経路は尿中であった.また,血液透析患者における放射能の総回収率は,投与放射能量の83.8±1.8%であり,そのうち糞中排泄率,透析液への回収率及び尿中排泄率は,それぞれ58.8±6.1,19.5±7.5及び11.2±3.4%であり,血液透析患者における主な排泄経路は糞中であった.血漿中には未変化体が最も多く存在し,全身循環放射能の99%超を占めていた.なお,健康成人及び血液透析患者の血漿中に最も多く存在した代謝物は,血漿における総曝露量の0.48%及び0.10%と極わずかであった.以上のことからジフェリケファリンは生体内でほとんど代謝されず,血液透析患者では主に糞中に未変化体として排泄されることが示唆された.
4) 薬物相互作用44,45)リコンビナントヒトCYP酵素発現系を用いてヒトCYP分子種(CYP1A2,CYP2C8,CYP2C9,CYP2C19,CYP2D6,CYP3A4)について,ジフェリケファリンを45分間反応させたところ,ジフェリケファリンはいずれのCYP分子種に対しても残存率が低下せず,いずれのCYP分子種に対しても基質とならないことが示唆された.また,ヒト肝ミクロソーム,ジフェリケファリン及び7種のCYP分子種(CYP1A2,CYP2B6,CYP2C8,CYP2C9,CYP2C19,CYP2D6及びCYP3A)の特異的基質を用いて,各CYP分子種へのジフェリケファリンの影響を検討したところ,各CYP分子種における阻害率はプレインキュベーション無しで18%以下,プレインキュベーション有りで36%以下であり,プレインキュベーションの有無に関わらず明らかな阻害作用(可逆的及び時間依存的な阻害作用)は認められなかったことから,ジフェリケファリンは各CYP分子種における基質代謝を阻害せず,CYP1A2,CYP2B6,CYP2C8,CYP2C9,CYP2C19,CYP2D6及びCYP3Aで代謝される薬物との相互作用の可能性が低いことが考えられた.また,ヒト新鮮肝細胞を用いたジフェリケファリンの酵素誘導試験では,CYP1A2,CYP2B6及びCYP3A4のmRNA発現量及び特異的基質の代謝物生成量に明らかな増加が認められなかったことから,ジフェリケファリンは各種CYP(CYP1A2,CYP2B6及びCYP3A4)を誘導する可能性は低いことが示唆された.
MDCKII及びMDR1-MDCKII細胞(ヒトP-gp発現細胞)を用いた細胞膜透過性試験では,ジフェリケファリンはいずれの細胞に対しても透過方向に関わらず膜透過性は低く(透過係数は0.7×10-6 cm/s以下),かつベラパミル(P-gp阻害薬)による影響を受けなかったことから,ジフェリケファリンはP-gp(MDR1)の基質とならないことが示唆された.また,BCRP輸送能を示すCaco-2細胞,OAT1,OAT3及びOCT2を発現させたMDCKII細胞やASBT,OAT2,OATP1B1,OATP1B3,OATP2B1,OCT1,OCTN1,OCTN2,OSTαβ,PEPT1,PEPT2,OATP1A2,OCT3又はLAT1を発現させたMDCKII細胞,BSEP又はMRP2を発現させたSf9細胞膜ベシクル,MATE1又はMATE2-Kを発現したHEK293細胞などを用いて,ジフェリケファリンの基質認識性について評価した結果,これらの基質とならないことが示唆された.
P-gp(MDR1)を発現するTC7細胞やBCRP輸送能を示すCaco-2細胞,OAT1,OAT3,OATP1B1,OATP1B3,OCT1又はOCT2を発現させたMDCKII細胞,MRP2又はBSEPを発現させたSf9細胞膜ベシクル,PEPT1及びPEPT2を発現させたCHO細胞,OATP1A2,OCT3又はLAT1を発現させたMDCKII細胞,MATE1又はMATE2-Kを発現させたHEK293細胞などを用いてジフェリケファリンの阻害作用について評価した結果,ジフェリケファリンはこれらの阻害薬とならないことが示唆された.以上のことからジフェリケファリンは薬物相互作用を引き起こす可能性は低いことが示唆された.
保湿剤,抗ヒスタミン薬,抗アレルギー薬などの既存治療で効果不十分なそう痒症を有する血液透析患者に対するジフェリケファリンの有効性を検証するため,二重盲検,無作為化,プラセボ対照,並行群間比較による第Ⅲ相臨床試験(MR13A9-5)が実施された.前観察期間後,二重盲検期開始時に対象患者を1:1でジフェリケファリン群(89例)又はプラセボ群(89例)に割り付け,6週間の二重盲検期を完了した被験者は,52週間ジフェリケファリンを投与する非盲検継続投与期に移行した.二重盲検期は,既存治療に加え,ジフェリケファリン0.5 μg/kg又はプラセボを週3回,透析終了時の返血時に透析回路静脈側より投与し,継続投与期はジフェリケファリン0.5 μg/kgを週3回,透析終了時の返血時に透析回路静脈側より投与した.投与量は,前観察期開始日,6週時,34週時の透析前のドライウェイトに基づき決定した.なお,ナルフラフィンは前観察期開始日の2週間前から後観察期終了時まで併用禁止とした(図7).

二重盲検期:ジフェリケファリン0.5 μg/kg又はプラセボを週3回,透析終了時の返血時に透析回路静脈側より投与した.継続投与期:ジフェリケファリン0.5 μg/kgを週3回,透析終了時の返血時に透析回路静脈側より投与した.ジフェリケファリン 0.5 μg/kg群の投与量は,ドライウェイトに基づく体重区分ごとの投与量(45.0 kg未満:17.5 μg,45.0 kg以上65.0 kg未満:25.0 μg,65.0 kg以上85.0 kg未満:35.0 μg,85.0 kg以上:42.5 μg)とした.*ナルフラフィンを使用している患者は観察期開始前に2週間ウォッシュアウト.
主要評価項目はかゆみに対するNumerical Rating Scale(NRS)スコア(1日の中で最も強く感じたかゆみの程度を評価)とし,主要評価変数は二重盲検期4週時の平均NRSスコアのベースラインからの変化量を設定した.その他の評価変数として,平均NRSスコア,平均NRSスコアのベースラインからの変化量,平均NRSスコア改善率を評価した.また,副次評価項目は白取の重症度基準に基づくかゆみスコア,Skindex-16スコア,5-D Itch Scaleスコア,Patient Global Impression of Change(PGIC)を設定した.
二重盲検期の有効性の解析対象集団は173例(プラセボ群88例,ジフェリケファリン群85例)であった.主要評価項目である4週時の平均NRSスコアのベースラインからの変化量(調整済み平均値±標準誤差)は,プラセボ群-1.09±0.20,ジフェリケファリン群-2.06±0.20であり,ジフェリケファリンのプラセボに対する優越性が示された(P<0.001,Mixed effects model for repeated measures(MMRM))(図8).平均NRSスコアはジフェリケファリン群で治験薬投与開始後1週時より低下し,2週時から,プラセボ群に対する有意な改善を示した(図8).また,平均NRSスコアのベースラインからの変化量が-3以下の被験者を3点改善例,-4以下の被験者を4点改善例として,それぞれの例数及び割合を算出した.4週時の3点改善例はプラセボ群11.6%,ジフェリケファリン群30.5%,4点改善例はプラセボ群4.7%,ジフェリケファリン群22.0%であり,いずれもジフェリケファリン群はプラセボ群に対し有意に高かった(3点改善例:P=0.003,4点改善例:P=0.001,Fisherの正確検定)(図9).

ジフェリケファリン0.5 μg/kg又はプラセボを週3回,透析終了時の返血時に透析回路静脈側より投与した.データは調整済み平均値±標準誤差及び95%信頼区間を示す.反復測定混合効果モデル(MMRM).

ジフェリケファリン0.5 μg/kg又はプラセボを週3回,透析終了時の返血時に透析回路静脈側より投与した.左:3点改善例,右:4点改善例の割合を示す.Fisherの正確検定.
副次評価項目である白取の重症度基準に基づく平均かゆみスコアのベースラインからの変化量(日中,夜間いずれか大きい方のスコア)(調整済み平均値±標準誤差)は,4週時にはプラセボ群-0.42±0.07,ジフェリケファリン群-0.78±0.07であり,ジフェリケファリン群はプラセボ群に対する有意な改善を示した(P<0.001,MMRM)(図10).また,事後解析で評価した白取の重症度基準に基づく夜間の平均かゆみスコア改善率は,夜間の平均かゆみスコアのベースラインが3点(痒くて目がさめる.ひと掻きすると一応眠るが,無意識のうちに眠りながら掻く.)以上の被験者を対象に,夜間の平均かゆみスコアが2点(多少痒みはあるが,掻けばおさまる.痒みのために目がさめることはない.)以下となった被験者を改善例として,例数及び割合を算出した.4週時の夜間の平均かゆみスコア改善率は,プラセボ群17.9%,ジフェリケファリン群55.3%であり,ジフェリケファリン群はプラセボ群に対し有意に高かった(P<0.001,Fisherの正確検定).

ジフェリケファリン0.5 μg/kg又はプラセボを週3回,透析終了時の返血時に透析回路静脈側より投与した.日中・夜間いずれか大きい方の平均スコア.データは調整済み平均値±標準誤差を示す.反復測定混合効果モデル(MMRM).
かゆみに関するQOLは,プラセボ群と比較してジフェリケファリン群でより改善した.二重盲検期最終評価時のSkindex-16スコアのベースラインからの変化量において,ジフェリケファリン群はプラセボ群に対する有意な改善を示し(P=0.010,analysis of covariance(ANCOVA)),症状及び感情サブスコアにおいても有意な改善を示した(P=0.021及びP=0.012).また,5-D Itch Scaleスコアのベースラインからの変化量において,ジフェリケファリン群はプラセボ群に対する有意な改善を示した(P<0.001,ANCOVA)ことから,ジフェリケファリンにより皮膚のかゆみや刺激感,皮膚症状の見た目や恥ずかしさなどの悩み,かゆみによる生活への悪影響やかゆみの発現部位を改善することが示された.さらに,患者の印象による全般的効果を評価したPGICにおいて,かゆみの全般的症状が「良くなった」及び「非常に良くなった」と評価した被験者の割合は,プラセボ群17.4%及び3.5%,ジフェリケファリン群29.4%及び14.1%であり,ジフェリケファリンにより患者自身が治療効果を実感できることが示された(P=0.001,2標本Wilcoxon検定).
ナルフラフィンによる治療歴,ベースラインの平均NRSスコア,性別,残腎機能,かゆみに対するベース治療薬,年齢,ドライウェイト,血液透析歴及びかゆみの罹病期間の部分集団解析の結果,ジフェリケファリンは被験者の背景によらず一貫してかゆみを改善することを示した.
全期間(二重盲検期及び継続投与期)の有効性の解析対象集団は164例(プラセボ-ジフェリケファリン群83例,ジフェリケファリン-ジフェリケファリン群81例)であった.ジフェリケファリン-ジフェリケファリン群の平均NRSスコアのベースラインからの変化量(平均値±標準偏差)は,6週時-2.53±2.38,18週時-3.34±2.11,34週時-3.81±2.11及び58週時-4.31±2.04であり,継続投与期移行後も経時的に低下した(図11).NRSスコア改善率について,58週時の3点及び4点改善例の割合は72.4及び63.8%であり,長期投与時のかゆみの改善効果が示された.副次評価項目である白取の重症度基準に基づくかゆみスコア,Skindex-16スコア,5-D Itch Scaleスコア及びPGICにおいても,長期間にわたりスコア及び症状の改善が示された.プラセボ-ジフェリケファリン群は,継続投与期移行後さらにスコアが改善し,ジフェリケファリン-ジフェリケファリン群と同程度のかゆみの改善効果が示された.

二重盲検期:ジフェリケファリン0.5 μg/kg又はプラセボを週3回,透析終了時の返血時に透析回路静脈側より投与した.継続投与期:ジフェリケファリン0.5 μg/kgを週3回,透析終了時の返血時に透析回路静脈側より投与した.データは平均値+標準偏差を示す.
二重盲検期の安全性の解析対象集団は178例(プラセボ群89例,ジフェリケファリン群89例)であった.有害事象の発現率は,プラセボ群47.2%(42/89例)及びジフェリケファリン群56.2%(50/89例)であり,有害事象の発現率に差は認められなかった(P=0.293,Fisherの正確検定).死亡に至った有害事象は,プラセボ群で1例(1.1%)に認められた.他の重篤な有害事象は,プラセボ群11.2%(10/89例)及びジフェリケファリン群7.9%(7/89例)に認められ,発現率に大きな差はなかった.2例以上に認められた重篤な有害事象は,プラセボ群ではシャント狭窄(4例)及び肺炎(2例),ジフェリケファリン群ではシャント狭窄(2例)であった.副作用の発現率は,プラセボ群3.4%(3/89例),ジフェリケファリン群14.6%(13/89例)であり,ジフェリケファリン群で2%以上の被験者に認められた副作用は,便秘(プラセボ群0.0%及びジフェリケファリン群4.5%,以下同順)及び血圧低下(1.1%及び2.2%)であり,いずれも軽度であった.
全期間の安全性の解析対象集団は168例(プラセボ-ジフェリケファリン群83例,ジフェリケファリン-ジフェリケファリン群85例)であった.有害事象の発現率は,プラセボ-ジフェリケファリン群98.8%(82/83例)及びジフェリケファリン-ジフェリケファリン群96.5%(82/85例)であった.死亡に至った有害事象は,プラセボ-ジフェリケファリン群で2例(2.4%),ジフェリケファリン-ジフェリケファリン群で2例(2.4%)に認められたが,いずれも治験薬との因果関係はないと判断された.他の重篤な有害事象は,プラセボ-ジフェリケファリン群44.6%(37/83例)及びジフェリケファリン-ジフェリケファリン群38.8%(33/85例)に認められた.2例以上に認められた重篤な有害事象は,プラセボ-ジフェリケファリン群ではシャント狭窄(7例),肺炎及びシャント閉塞(各4例),末梢動脈閉塞性疾患(3例),COVID-19,白内障,冠動脈狭窄,発熱及びシャント瘤(各2例),ジフェリケファリン-ジフェリケファリン群ではシャント閉塞(6例),末梢動脈閉塞性疾患(3例),COVID-19,胃腸炎及びシャント狭窄(各2例)であった.副作用の発現率は,プラセボ-ジフェリケファリン群13.3%(11/83例),ジフェリケファリン-ジフェリケファリン群18.8%(16/85例)であった.いずれかの投与群で2%以上の被験者に認められた副作用は,便秘(プラセボ-ジフェリケファリン群0.0%及びジフェリケファリン-ジフェリケファリン群4.7%,以下同順),傾眠(2.4%及び2.4%)及び浮動性めまい(2.4%及び1.2%)であり,いずれも軽度であった.有害事象及び副作用はいずれも長期投与に伴い増加する傾向はなく,遅発性の事象も認められなかった.また,依存性評価委員の判定に基づく依存性評価の結果,評価可能であったすべての被験者が精神依存性,身体依存性なしと判断された.さらに,依存性評価の一環として耐性(長期投与に伴う抗そう痒効果の減弱)の有無について評価を行った結果,明らかな耐性は認められなかった.
非臨床薬理試験において,ジフェリケファリンはKORに特異的に作用するフルアゴニストであり,KORを介した抗そう痒作用と免疫細胞のサイトカインを抑制する抗炎症作用を有することが示された.また,KOR拮抗薬を用いた試験結果並びにジフェリケファリンの薬物動態学的な特徴である中枢移行性の低さより,ジフェリケファリンの抗そう痒作用は末梢のKORを介していると考えられた.さらには,ジフェリケファリンは肝代謝を受けにくく,CYP分子種やトランスポーターに起因する薬物相互作用を引き起こす可能性が低いことから,様々な合併症の治療を受けている血液透析患者においても,安全に使用できる薬剤と考えられた.
既治療のそう痒症を有する血液透析患者を対象とした第Ⅲ相臨床試験において,ジフェリケファリンは投与早期からかゆみを改善し,かゆみによる睡眠障害やかゆみに関するQOLの改善効果を示した.ジフェリケファリンの副作用の発現率は低く,耐性や依存性が認められなかったことからも,ジフェリケファリンは長期間投与することが可能であることが確認された.
ジフェリケファリンは,透析終了後の返血時に透析回路より注入する用法のため患者の服薬負担がない.また,投与量はドライウェイトに応じて決定するプレフィルドシリンジ製剤であることから,服薬過誤や服薬アドヒアランス低下を防ぐなどの利便性に優れた薬剤である.ジフェリケファリンは既存治療で効果不十分なそう痒症に対する新たな治療選択肢として,血液透析患者のQOL向上に貢献できると考えられる.
桃谷 圭一,野尻 瑠美(丸石製薬株式会社),内山 琢麻,谷口 保(キッセイ薬品工業株式会社).