要旨
潰瘍性大腸炎(UC)の重要な合併症として癌の発生があるが,存在診断や範囲診断,深達度診断は難しい.腫瘍性異型上皮(dysplasia)の検出が重要である.発病7-10年以降はサーベイランス内視鏡を,できれば寛解期に施行する.UC関連腫瘍の肉眼形態は様々なものがあるが,隆起を伴うことが多い.周囲と異なる粘膜模様や色調変化,領域のある発赤に注意する.白色光観察に加え,色素内視鏡や拡大観察などの画像強調観察により病変を絞り込むが,生検して組織学的検討も行う.以前はステップ生検が推奨されてきたが,近年狙撃生検で十分であることが示された.生検標本の評価には,Ki-67やp53の免疫染色も行う.治療方針決定には炎症性か非炎症性かが重要である.周囲のdysplasiaの存在やp53蛋白の過剰発現は炎症性を示唆する.進歩する画像強調観察も援用して積極的に拾い上げたい.
Ⅰ はじめに
潰瘍性大腸炎(UC)は,近年著増しており,最近の推計では20万人を超える罹患者がいると推定されている.このUCの重要な合併症の一つに癌の発生がある.その頻度は,2001年のメタ解析では,10年で1.6%,20年で8.3%.30年で18.4%と高率である
1).本邦では大腸癌研究会による会員施設へのアンケートから,10年まででは2%未満,10年を経過すると5%前後,21年以降は10%以上であったと2002年に報告されている
2).一方,St Mark’s Hospitalでの追跡調査では10年で0.7%,20年で2.9%,30年で6.7%,40年で10.0%,および50年で13.6%であった
3).また,デンマークの1,160人を対象にした調査では10年で0.4%,20年で1.1%,30年で2.1%であった
4).近年は,抗炎症治療の進歩により,その頻度は低下していることが予想されるが,注意すべき重要な合併症であることに変わりはない.
このUC粘膜を背景とするUC関連腫瘍は,非UC粘膜を背景として発症してくる通常の大腸癌と治療方針が大きく異なる.通常の大腸癌では,EMR,ESDあるいは定型的外科手術といった局所治療が施行される.これに対しUC関連腫瘍では,境界明瞭なものは非炎症性腫瘍に準じて内視鏡治療も行われているが,炎症性腫瘍は多発することが多いこと,その背景粘膜も既に前がん状態であると考えられること等から,大腸全摘が基本である
5).近年は,ESDも行われるようになってきた
6).しかし炎症後の粘膜のため線維化が強く内視鏡的切除の難易度は高い.また,内視鏡治療の前提としては,範囲診断が正確になされている必要があり,さらに,しばしば多発するUC関連腫瘍をきちんと検出してあることも重要である.
Ⅱ UC関連腫瘍の特徴
炎症粘膜を母地としない通常の大腸癌の診断は,pit pattern診断やnarrow band imaging(NBI)等の画像強調観察の応用により,内視鏡の視野に入りさえすればそれほど困難ではない.存在診断に加えて,範囲診断や深達度診断も,色素内視鏡やNBI,拡大観察といった画像強調観察によりきわめて高い正診率がある.
これに対し,UC関連腫瘍の存在診断や範囲診断は容易ではない.背景粘膜が炎症のために多彩な像を呈していることや,UC関連腫瘍は多様な肉眼形態,pit patternを呈することから困難なことが多い.さらに粘膜内病変が残存したまま浸潤性に発育して進行癌となっていることもあるなど,表面性状が必ずしも深部の性状を反映していないことから深達度診断も難しいことが多い
7).
大腸癌を合併したUC粘膜には,前がん病変と考えられている腫瘍性異型上皮(dysplasia)が認められる
8).そこで,こうしたdysplasiaの検出が重要となってくる.
Ⅲ 各種ガイドラインと課題
様々なガイドラインが発表されているが,それぞれ相違がある
9)~11).内視鏡の進歩により,dysplasiaは内視鏡的に検出可能と考えられるようになってきている.一方,最近のメタ解析では,内視鏡的認識可能なlow grade dysplasia(LGD)では癌やhigh grade dysplasia(HGD)の発生は100患者年あたり1.0件であるのに対し,内視鏡で認識できない平坦なlow grade dysplasiaが存在すると,100患者年あたり6.1件であったとしており,注意を要する
12).
統一的なものができないかということで,国際的なコンセンサスが発表された(Table 1)
13).このSCENICコンセンサスでは,色素内視鏡が重視されている.すなわち希釈したインジゴカルミン溶液を全大腸に散布して,疑われる場合には通常のインジゴカルミン溶液で精査するというものである(Table 2).コンセンサスでは,通常内視鏡よりも高画質内視鏡の使用を推奨している.また,散布カテーテルや鉗子チャンネルを利用してインジゴカルミンやメチレンブルーを散布することにより,粘膜表面の微細構造が観察しやすくなるとしている.メタ解析では,色素内視鏡により発見率はほぼ2倍になる一方で,検査時間の延長が指摘されている.NBIは,ここでは推奨されていない.しかし,根拠となっている研究は,古い機器に基づくものであり,最新機種では,NBIでも俯瞰的観察が可能である.渡辺らは,NBIによるdysplasia検出能の向上を示しており
14),今後の再検討が必要である.また,ランダム生検か狙撃生検かという問題については,ここでは,コンセンサスを示していない.この点は後述する本邦からの研究が参考になる.また,autofluorescence imaging(AFI)の有用性は確認されていないとしており,endomicroscopyについては,拾い上げた病変の精査には有用かもしれないが,拾い上げについては使用されがたいとしている.
1)サーベイランスの時期
発癌頻度が高いため,発病7-10年以降はサーベイランス内視鏡を施行する.炎症があると炎症異型や再生異型があるため腫瘍の検出が内視鏡的にも病理検査でも難しくなるため,寛解期に施行することが望ましい.難治で炎症が持続している例は腫瘍の検出が内視鏡的にも病理検査でも難しくなるが,こうした例こそが高危険群であり,より注意を要する.また,診断されずに長期間罹患していたり,初診時にすでにUC関連腫瘍を併発していることもあるので,内視鏡施行時にはUC関連腫瘍も存在している可能性を念頭に置く.
検査間隔は,通常の大腸癌では,近年クリーンコロンであれば3年に1回で十分であることが示された15).UC関連腫瘍では,検査間隔について十分な研究はなされていないが,早期診断の困難性を考慮すると,現段階では年1回のサーベイランス内視鏡が行われる.欧米のガイドラインでは,危険因子により層別化して検査間隔を勧告している
9),11).粘膜治癒が達成されていれば,腫瘍はできにくくなり,さらに早期診断も容易になると考えられる.しかし発生頻度が低下してもゼロになるわけではないので,注意を要する.
UC関連腫瘍の危険因子としてTable 3に挙げたものがある
16).注意すべき点として高齢発症患者では,早期に腫瘍が発生してくることがあり,オランダの全国調査からは,より早期のサーベイランス開始が提案されている
17).
2)生検の意義
UCの診断と異なり,UC関連腫瘍の内視鏡診断は絶対的なものではないため,病理標本による検討が不可欠である.
そこで,腫瘍を疑う場合は,積極的に生検を行い拾い上げる必要がある.以前は,全大腸の10cm毎に4カ所ずつ生検して診断するステップ生検が推奨されてきた.標本採取と病理診断に多大な労力が必要なわりには,腫瘍の発見率は高くないが画質が不十分で粘膜の詳細な観察が困難であったことを考えると仕方のないことであった.しかし,近年の高画質化から,内視鏡で腫瘍を疑う場所からの生検,すなわち狙撃生検のみで十分ではないかと考えられる.これについて本邦からの多施設共同研究が報告されている
18).この研究では,左側大腸炎型,全大腸炎型UCを対象として,大腸10cm毎に4カ所ずつ生検を行うランダム生検群と,内視鏡下で腫瘍を疑う部位に加え下部直腸から1カ所生検を行う狙撃生検群にランダムに割り付け,それぞれの腫瘍の発見率を比較している.狙撃生検群では,114例から24個の,ランダム生検群では107例から18個のdysplasiaがそれぞれ検出され,ランダム生検に対する狙撃生検の非劣性が示された.さらに総検査時間は有意に狙撃生検群が短かった.少なくとも経験を積んだ内視鏡医による検査では狙撃生検で十分であることが示された.精細な観察が前提ではあるが,今後狙撃生検によるサーベイランスが主流になっていくと考えられる.
生検標本の評価にも注意が必要である.dysplasiaの診断には,消化器専門の病理医2名以上の診断が望ましいとされており,UC関連腫瘍の病理診断の困難さがうかがわれる.実際,dysplasiaでは,HE染色では異型が弱くdysplasiaと認識されないことがある.そのためKi-67やp53の免疫染色による評価も行い,増殖帯の位置やp53の過剰発現等から推定する
7).HE染色による評価のみでdysplasiaなしと病理診断されてしまうこともあるので,UC関連腫瘍を疑う場合には,p53やKi-67染色の希望も検査申込書に記載しておく.その他,内視鏡像からはUC関連腫瘍を強く疑うが,免疫染色を含めても病理診断は非腫瘍とされることもある.この時は,3カ月毎のclose follow-upが安全である.
生検標本でHGDあるいは癌と診断されれば,基本的に大腸全摘が行われる.LGDでは,3-6カ月後に再検査する.しかし,前述のように表面は必ずしも全体を反映しておらず,生検標本からの病理診断と手術標本からの病理診断とが一致しないこともある.近年はEMRやESDによる診断的治療も行われている.
前述のSCENICコンセンサスでは,内視鏡的に完全切除された,2.5mm以上の高さを持つポリープ状病変については,大腸全摘よりもサーベイランスの継続を推奨している
13).この場合,再検査を3-6カ月後に行い,そこで腫瘍が検出されなければ1年後の再検査が提唱されている.一方,2.5mm以下の軽度の隆起あるいは,平坦,陥凹性病変については,検出の困難性から,手術を行わずにサーベイランス内視鏡を継続することについては弱い推奨となっている.
Ⅳ 方 法
当院で行われている方法を示す.診断時には,直腸炎型,左側大腸炎型,全大腸炎型といった病型にかかわらず十分な前処置を行い,回腸終末部を含めた全大腸内視鏡検査を行う.各部位において,まず白色光観察を行う.この時,領域性をもった発赤の有無に注意する.続いて,拡大NBIで血管網を観察する.過去に炎症の既往がある場合,正常粘膜で観察される蜂巣状の血管網に乱れがみられたり,枯れ枝状を呈している.続いてインジゴカルミンを散布し,無名溝の観察を行う.炎症の既往があると無名溝の消失や乱れが観察される.また粘膜の凹凸を観察するには,こうした色素内視鏡は有用である.炎症の既往のある粘膜にはUC関連腫瘍発生の可能性があるので,UC罹患範囲の把握は重要である.白色光観察で活動性がなくとも,一度は大腸の各部位から生検を行い,炎症の既往について把握しておく.
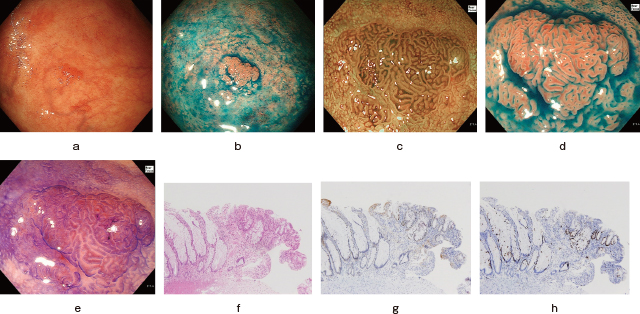
UC関連腫瘍の肉眼形態は表に挙げた様々なものを呈する(Table 4)
19).特に,隆起を伴うことが多く
20)注意する.周囲と異なる粘膜模様や色調変化,領域のある発赤は注意すべきである(Figure 1).現在,いくつかのアトラスが発表されており,これらも参考にする
21),22).
表面微細構造も参考になる.できれば色素拡大内視鏡も併用して不規則なpit patternの出現をとらえるようにする.UC関連腫瘍の表面微細構造は,管状pitを呈する場合と,絨毛状を呈する場合とがある
23).規則正しく配列した均一なpit patternは非腫瘍性を示唆する.しかし,切除された手術標本で術前に内視鏡的に認識できなかったdysplasiaが検出されることは留意される.白色光観察に加え,色素内視鏡や拡大観察などの画像強調観察による病変の絞り込みができる可能性はあるが,炎症性変化であろうと考えられても,腫瘍を否定できない場合は,組織学的検討をするために生検をする
24).
炎症の既往のある粘膜に発生した腫瘍では,炎症性か非炎症性かの鑑別が問題となる.周囲にdysplasiaがないこと,p53蛋白の過剰発現がない場合は非炎症性と考えられている.また,有茎性や亜有茎性の形態を呈するものや,境界が明瞭な病変は非炎症性の可能性が高い
20).また,典型的なⅢL型pit patternを呈する場合は,非炎症性を考える(Figure 2).
Ⅴ おわりに
より低侵襲な治療の前提として,正確な内視鏡診断が必要であることは,UC関連腫瘍においても同様である.進歩する画像強調観察も援用して積極的に拾い上げを行っていくようにしたい.
本論文内容に関連する著者の利益相反:齊藤詠子(2016年4/1~2017年3/31まで以下の寄付講座に所属.アッヴィ合同会社,EA Pharma株式会社,JIMRO株式会社,ゼリア新薬株式会社)
文 献
- 1. Eaden JA, Abrams KR, Mayberry JF. The risk of colorectal cancer in ulcerative colitis:a meta-analysis. Gut 2001; 48: 526-35.
- 2. 平井 孝, 加藤 知行, 金光 幸秀.炎症性腸疾患と大腸癌 第55回大腸癌研究会アンケート結果.胃と腸 2002; 37: 887-93.
- 3. Choi CH, Rutter MD, Askari A et al. Forty-Year Analysis of Colonoscopic Surveillance Program for Neoplasia in Ulcerative Colitis:An Updated Overview. Am J Gastroenterol 2015; 110: 1022-34.
- 4. Winther KV, Jess T, Langholz E et al. Long-term risk of cancer in ulcerative colitis:a population-based cohort study from Copenhagen County. Clin Gastroenterol Hepatol 2004; 2: 1088-95.
- 5. Coviello LC, Stein SL. Surgical management of nonpolypoid colorectal lesions and strictures in colonic inflammatory bowel disease. Gastrointest Endosc Clin N Am 2014; 24: 447-54.
- 6. Iacopini F, Saito Y, Yamada M et al. Curative endoscopic submucosal dissection of large nonpolypoid superficial neoplasms in ulcerative colitis (with videos). Gastrointest Endosc 2015; 82: 734-8.
- 7. 味岡 洋一, 佐野 知江.【炎症性腸疾患と大腸癌】潰瘍性大腸炎における大腸癌の病理組織学的特徴と生検診断.日消誌 2013; 110: 379-84.
- 8. Riddell RH, Goldman H, Ransohoff DF et al. Dysplasia in inflammatory bowel disease:standardized classification with provisional clinical applications. Hum Pathol 1983; 14: 931-68.
- 9. Van Assche G, Dignass A, Bokemeyer B et al. Second European evidence-based consensus on the diagnosis and management of ulcerative colitis part 3:special situations. J Crohns Colitis 2013; 7: 1-33.
- 10. Kornbluth A, Sachar DB. Practice Parameters Committee of the American College of Gastroenterology. Ulcerative colitis practice guidelines in adults : American College Of Gastroenterology, Practice Parameters Committee. Am J Gastroenterol 2010; 105: 501-23.
- 11. Mowat C, Cole A, Windsor A et al. Guidelines for the management of inflammatory bowel disease in adults. Gut 2011; 60: 571-607.
- 12. Fumery M, Dulai PS, Gupta S et al. Incidence, Risk Factors, and Outcomes of Colorectal Cancer in Patients With Ulcerative Colitis With Low-Grade Dysplasia : A Systematic Review and Meta-analysis. Clin Gastroenterol Hepatol 2017; 15: 665-74. e5.
- 13. Laine L, Kaltenbach T, Barkun A et al. SCENIC international consensus statement on surveillance and management of dysplasia in inflammatory bowel disease. Gastroenterology 2015; 148: 639-51.
- 14. 渡辺 憲治, 西下 正和, 嶋本 文雄.Colitic cancerの諸問題 潰瘍性大腸炎サーベイランス内視鏡におけるNBIと色素内視鏡の多施設共同前向きランダム化比較試験 Navigator Study.Gastroenterological Endoscopy 2016; 58(Suppl.2): 1741.
- 15. 松田 尚久, 関口 正宇, 角川 康夫ほか.内視鏡による大腸癌の予防と早期診断.日消誌 2016; 113: 1176-85.
- 16. Althumairi AA, Lazarev MG, Gearhart SL. Inflammatory bowel disease associated neoplasia:A surgeon’s perspective. World J Gastroenterol 2016; 22: 961-73.
- 17. Baars JE, Kuipers EJ, van Haastert M et al. Age at diagnosis of inflammatory bowel disease influences early development of colorectal cancer in inflammatory bowel disease patients:a nationwide, long-term survey. J Gastroenterol 2012; 47: 1308-22.
- 18. Watanabe T, Ajioka Y, Mitsuyama K et al. Comparison of Targeted vs Random Biopsies for Surveillance of Ulcerative Colitis-Associated Colorectal Cancer. Gastroenterology 2016; 151: 1122-30.
- 19. 癌化「サーベイランス法の確立」プロジェクト研究グループ.潰瘍性大腸炎サーベイランスアトラス.難治性炎症性腸管障害に関する調査研究班,東京, 2006.
- 20. 岩男 泰, 下田 将之, 杉野 吉則ほか.内視鏡検査からみたcolitic cancerの初期病変 拡大内視鏡所見を中心に.胃と腸 2014; 49: 1464-78.
- 21. Matsumoto T, Iwao Y, Igarashi M et al. Endoscopic and chromoendoscopic atlas featuring dysplastic lesions in surveillance colonoscopy for patients with long-standing ulcerative colitis. Inflamm Bowel Dis 2008; 14: 259-64.
- 22. Soetikno R, Sanduleanu S, Kaltenbach T. An atlas of the nonpolypoid colorectal neoplasms in inflammatory bowel disease. Gastrointest Endosc Clin N Am 2014; 24: 483-520.
- 23. 岩男 泰, 下田 将之, 三上 修治ほか.【消化管拡大内視鏡診断2016】大腸 炎症性腸疾患の拡大内視鏡診断 腫瘍.胃と腸 2016; 51: 690-9.
- 24. 樋田 信幸, 飯室 正樹, 中村 志郎.内視鏡検査からみたcolitic cancerの初期病変 遡及例の検討を含めて 通常内視鏡所見を中心に.胃と腸 2014; 49: 1435-45.