要旨
【背景と目的】大腸内視鏡的粘膜下層剥離術(endoscopic submucosal dissection;ESD)は,技術的に難しい・治療時間が長い・偶発症発生割合が高い,といった原因で,未だに高い技術が必要とされる手技である.大腸ESDを簡便な手技にするために,われわれは糸付きクリップによる牽引補助下大腸ESD(traction-assisted colorectal ESD using a clip-and-thread;TAC-ESD)を考案し,TAC-ESDの有効性を証明するために無作為化比較試験を行った.
【方法】20mm以上の表在型大腸腫瘍をもつ患者が本試験に登録され,従来法ESD群とTAC-ESD群に無作為に割付けられた.50mm以下の表在型大腸腫瘍に対しては大腸ESD中級者2名が,50mm以上の表在型大腸腫瘍に対しては大腸ESD上級者2名が術者となった.主要評価項目は治療時間とした.副次評価項目はTAC-ESD成功割合(治療終了まで糸付きクリップが外れず,有効であった割合),中級者の自己完遂割合,偶発症発生割合とした.
【結果】両群ともに42病変が解析対象となった.治療時間中央値[範囲]は,TAC-ESD群が40[11-86]分で,従来法ESD群の70[30-180]分よりも有意に短かった(P<0.0001).TAC-ESD成功割合は95%(40/42)であった.中級者の自己完遂割合は100%[39/39]で,TAC-ESD群の90%[36/40]より有意に高かった(P=0.04).偶発症は,術中穿孔を従来法ESD群で1例,遅発穿孔をTAC-ESD群で1例認めた.
【結論】TAC-ESDは大腸ESDの治療時間を短縮し,中級者の自己完遂割合を高めた(UMIN000018612).
Ⅰ 緒 言
大腸がんは世界のがん統計において,がん死亡率4位であり,今後さらに増加することが予測されている
1),2).しかしながら,高度先進国では,大腸内視鏡検査と内視鏡的な大腸ポリープ摘除の普及により,大腸がんによる死亡は減少傾向である
3)~5).大部分の大腸ポリープは内視鏡摘除で治癒するが,大きな表在型大腸腫瘍の内視鏡摘除は時に困難なことがある
6).西欧諸国では,大きな表在型大腸腫瘍に対しては分割内視鏡的粘膜切除術(Piecemeal endoscopic mucosal resection;piecemeal EMR)や外科手術が標準治療として行われているものの,piecemeal EMRは再発割合(16%)が高いことが問題となる
6).また,大部分の表在型大腸腫瘍は粘膜内に限局する病変でありリンパ節転移しないため,手術も過大な侵襲となる
7).
日本では,完全摘除割合が高く再発割合が低い(0.4-1.0%)
8),9),内視鏡的粘膜下層剥離術(Endoscopic submucosal dissection;ESD)が大きな表在型大腸腫瘍に対する標準治療とされている.しかしながら,西欧諸国では,ESD(技術的に難しい・治療時間が長い・偶発症発生割合が高い)はEMRと比較して普及してない
8)~10).日本においてでさえも,ESD中に適切な剥離層と内視鏡の操作性が安定した状態を維持することは経験の少ない術者にとっては難しいため,ESDは技術を要する手技とされている
11),12).よって,われわれは大腸ESDを簡便にするために,新しく簡単な牽引法である,糸付きクリップによる牽引補助下大腸ESD(traction-assisted colorectal ESD using a clip-and-thread;TAC-ESD)を考案し
13)~15),その実施可能性を報告してきた
14),15).今回はTAC-ESDの有効性を評価するために前向き無作為化比較試験を計画した.
Ⅱ 方 法
試験デザイン
本研究は,大阪国際がんセンターで立案された前向き無作為化比較試験である.本研究のプロトコールは大阪国際がんセンターの倫理委員会により承認されている.本研究は,大学病院医療情報ネットワーク研究センター(UMIN000018612)に事前に登録された.この論文はCONSORT(Consolidated Standards of Reporting Trials:臨床試験報告に関する統合基準)2010声明に基づいて作成された.すべての共著者は研究結果に目を通し,本論文の内容について承認している.
参加者
EMRで一括切除困難な20mm以上の表在型大腸腫瘍(腺腫あるいは腺癌)を有する患者に対して,本研究への登録が検討された.大腸ESD上級者である2人の内科医(Y.T.,N.U.)の外来を受診した患者に対して,連続して登録の呼びかけを行った.以下の条件を満たす場合,本研究から除外された(1)粘膜下層浸潤癌を疑う,(2)バウヒン弁・虫垂開口部・憩室に病変が接する,(3)内視鏡切除後の局所再発,(4)炎症性腸疾患あるいは家族性大腸腺腫症を基礎疾患に有する,(5)出血傾向あるいは重篤な臓器障害を有する.対象病変が複数存在した場合は,近位側の病変のみ(1患者1病変)が,研究に登録された.すべての患者は,登録前に文書による説明を受け,同意を取得された.
無作為化の方法
参加者は本研究に直接関与していない研究者によって,最小化法で無作為化割付された
16).乱数表はエクセル2010(Microsoft Corp.,Redmond,WA)で作成され,治療の直前まで術者に情報は伏せられた.病変部位(直腸/結腸),肉眼型(隆起型・LST-G/LST-NG),病変径(<50mm/≥50mm),術者,を層別化因子として,参加者は無作為に従来法ESD群もしくはTAC-ESD群に1:1で割付けられた.治療前に50mm未満と診断された表在型大腸腫瘍は大腸ESD中級者2名(Y.Y.,T.K.)によって治療された.本研究開始時に,Y.Y.は大腸ESD経験20例(TAC-ESD10例,従来法ESD10例),T.K.は大腸ESD経験40例(TAC-ESD5例,従来法ESD35例)であった.50mm以上の表在型大腸腫瘍は大腸ESD上級者2名(Y.T.,N.U.)によって治療された.上級者2名は大腸ESD経験200例以上であり,Y.T.はTAC-ESD 10例,N.U.はTAC-ESD5例の経験があった.
大腸ESDの方法
すべてのESDで先端透明フード(D-201-13404 or D-201-11804;Olympus)を装着した大腸内視鏡[EVIS(CF-Q260DI,PCF-Q260AZI,or PCF-Q260JI);Olympus,Tokyo]を用い,Flushknife-BT(1.5mm,DK2618JB;Fujifilm Medical,Tokyo
17))を使用した.止血用の処置具としてCoagrasper(FD-410LR;Olympus)を使用し,高周波装置はVIO 300D(ERBE,Tübingen,Germany)を使用した.Flushknife-BTの高周波装置の設定は,粘膜切開:endo-cut I mode effect 2,duration 3,interval 3;粘膜下層剥離:swift-coagulation mode effect 2,50Wとし,Coagrasperはsoft-coagulation mode effect 4,80Wで使用した.
中級者は上級者の指導の下にESDを施行し,中級者が以下に示すような状況に遭遇した場合,上級者が交代し術者となった.(1)治療時間2時間以上,(2)術中穿孔,(3)止血困難あるいは治療継続困難.中級者によってESDが完遂された場合を“自己完遂”と定義した.
従来法ESDの手技
まず,0.4%ヒアルロン酸ナトリウム(MucoUp;Boston Scientific K. K.,Tokyo)を病変外の正常粘膜に局注した.病変の肛門側から粘膜切開を行い,その後,切開部位の粘膜下層を剥離した.次に,粘膜切開・粘膜下層剥離を左右に広げ,同様の操作を徐々に繰り返して,粘膜切開・粘膜下層剥離を継続して行った.これは,当院の大腸ESDの基本的な手技であり
18),最終的に病変の周囲全周を切開し,粘膜下層を完全に剥離して病変を切離した.ESD後の粘膜欠損を注意深く観察し,拍動する血管を予防的に焼灼した.
TAC-ESDの手技
直腸病変に対するTAC-ESDは従来の報告通りに施行した
15).治療を開始する前に,0.25mm径の3-0ポリエステル糸(Figure 1-a)(Natsume Seisakusho Co., Ltd, Tokyo)をクリップ装置に装着したクリップ(Figure 1-b)(HX-610-090;Olympus)の付け根に結び付けた(Figure 1-c).その後,大腸内視鏡を直腸に挿入し,TAC-ESDを開始した.粘膜下層へ0.4%ヒアルロン酸ナトリウムを局注した後,病変肛門側の正常粘膜を切開・剥離した後に,大腸内視鏡を一旦体外へ引き抜いた.糸付きクリップを充填したクリップ装置を大腸内視鏡の鉗子口から挿入し,鉗子口出口から糸を引き出し(Figure 1-d),この状態で大腸内視鏡を直腸に再挿入した.腸管内でクリップを展開し,切開・剥離した粘膜フラップの肛門側をクリップで把持した.用手的に,直腸の外にある糸をゆっくり引くと,粘膜下層が視認できた(Figure 1-e).剥離したい部位の粘膜下層が良好に視認できたら,糸への過度なテンションを防ぐために糸の牽引をやめ,ペアンで把持して検査台上に放置した.さらに牽引が必要な場合には,再度用手的に糸を牽引した.全周切開後,粘膜下層の剥離は容易であり,完全に切除した(電子動画 1).
電子動画 1
結腸病変に対するTAC-ESDも従来の報告通りに施行した
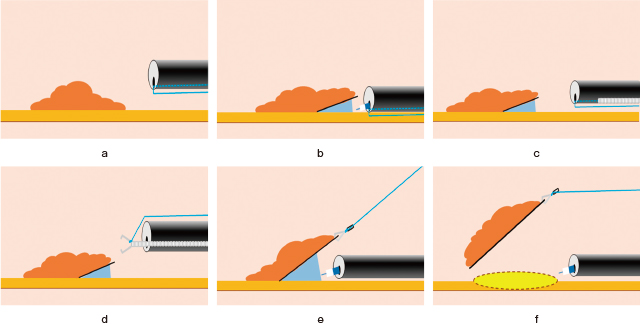
13),14).大腸内視鏡を挿入する前に,長さ約3mの3-0ポリエステル糸の端を掴んだCoaglasperを鉗子口から挿入し,糸を鉗子口出口から引き出し,糸の両端を大腸内視鏡の外で結んだ(Figure 2-a).この事前準備に要した時間は1分未満であった.大腸内視鏡を挿入し,大腸内視鏡が結腸病変に到達した後,粘膜下層へ0.4%ヒアルロン酸ナトリウムを局注し,病変肛門側の粘膜切開・剥離を行った(Figure 2-b).その後,大腸内視鏡の外側で結んでおいた糸の結び目をハサミで切り,鉗子口から出ている糸をクリップ装置に装着されたクリップ(HX-610-090;Olympus)の付け根に結び付けた(Figure 2-c).この際,クリップを再収納できるように,完全には展開させないことが重要である.糸付きクリップをクリップ装置に再収納した後,肛門から出ている糸を術者が引くのと同時に,介助者がクリップ装置を鉗子口に挿入した(Figure 2-d).内視鏡先端からクリップが結腸の中に出たのちにクリップを完全に展開し,切開・剥離した粘膜フラップの肛門側をクリップにより把持した(Figure 2-e).その後,肛門からでている糸をゆっくり用手的に牽引し,直腸の時と同様の方法で牽引の程度を調整した.全周切開後,粘膜下層を視認した状態で,剥離は容易であった(Figure 2-f,電子動画 2).Figure 3に結腸病変に対するTAC-ESDのシェーマを示す.
電子動画 2
組織学的評価
すべての切除標本は消化管上皮性腫瘍のVienna分類に基づいて,病理専門医により評価された
19),20).切除断端は以下のように評価された:(1)側方断端,垂直断端ともに陰性(R0),(2)側方断端あるいは垂直断端陽性(R1),(3)側方断端あるいは垂直断端不明瞭(RX).
評価項目
主要評価項目は治療時間(粘膜下層への局注開始から病変切除終了まで)とした.治療時間は,大腸内視鏡の鉗子口に糸を通し糸によるループを作成する内視鏡挿入前の事前準備の時間(1分未満)を除いたすべてのTAC-ESDの準備および手技時間を含んでいる.副次評価項目は,TAC-ESD成功割合,中級者の自己完遂割合,偶発症の発生割合とした.TAC-ESD成功とは,治療終了まで糸付きクリップが外れず,有効であった場合と定義した.
症例数設定
症例数設定は当院での過去の治療成績に基づいて算出された.当院での従来法ESDの治療時間は約70分(823例,2005年1月から2014年9月まで)であり,TAC-ESDの治療時間は約53分(20例,2014年10月から2015年3月まで)
14)であった.TAC-ESDの大部分の症例では大腸ESD中級者あるいは初級者が術者であったが,従来法ESDの半数以上の症例で術者は上級者であった.以上より,従来法ESD 65分,TAC-ESD 45分,標準偏差31分(従来法ESD,TAC-ESDの治療成績より算出)として治療時間の仮説を立て,両側α 0.05,検出力80%としたところ,必要症例数は76例と算出された.10%の脱落を考慮し,最終的な必要症例数は84例とした.計算にはSouthwest Oncology Group statistical center(https://stattools.crab.org)の統計ツールを使用した.
統計解析
連続変数の結果は中央値(範囲)で示した.カテゴリー変数についてはχ
2検定とFisherの正確確率検定を使用し,連続変数についてはMann-WhitneyのU検定を使用し,P<0.05を統計学的に有意と判定した.統計解析にはJMP(version 12)software package(SAS Institute,Cary,NC)を使用した.
Ⅲ 結 果
症例登録
2015年8月から2016年10月の間に,20mm以上の表在型大腸腫瘍を有する159名の患者が当院を受診した.この中で,74名は除外された.結果,85名が登録され,43名は従来法ESD群,42名はTAC-ESD群へと無作為に割付けられた.1名は,病変が予想されたよりも小さかったためEMRで治療されESDが実施されず,最終的に84名84病変がプロトコール治療を実施されて解析対象となった(Figure 4).
対象の背景
Table 1に両群の患者および病変背景を示す.両群ともに結腸が34病変(81%),直腸が8病変(19%)であった.
臨床病理学的特徴
切除された病変の臨床病理学的特徴については,両群間で有意な差を認めなかった(Table 2).すべての病変は一括切除され,従来法ESD群で粘膜下層深部浸潤癌であった患者2名に追加外科手術が勧められたが,2名とも追加治療を行わず経過観察を希望した.一方で,TAC-ESD群で粘膜下層深部浸潤癌あるいはリンパ管侵襲陽性であった患者4名は,全員追加外科手術を受けた.
主要・副次評価項目
治療時間中央値は,TAC-ESD群が40[11-86]分で,従来法ESD群の70[30-180]分よりも有意に短かった(P<0.0001,Figure 5).結腸病変と直腸病変に分けたサブグループ解析においても,いずれの病変でも治療時間は,TAC-ESD群が従来法ESD群よりも有意に短かった(Figure 6).TAC-ESD成功割合は95%であった(40/42).TAC-ESDは近位側結腸の2病変で不成功であった(上行結腸1例,横行結腸1例).中級者の自己完遂割合はTAC-ESD群で100%であり,従来法ESD群の90%よりも有意に高かった(P=0.04,Table 3).従来法ESD群の4例で術者を上級者に交代し,その理由は治療時間の超過(n=3)と術中穿孔(n=1)であった.従来法群で1例(2%)に術中穿孔が生じたが,保存的に改善した.TAC-ESD群では盲腸病変の1例(2%)に遅発穿孔が生じ,緊急回盲部切除術が施行された(Table 3).生命に関わる重篤な偶発症はなかった.
術者によるサブグループ解析
中級者は79名に対して大腸ESDを施行した.従来法ESD群は40名,TAC-ESD群は39名であった.中級者による治療時間はTAC-ESD群において43[11-86]分で,従来法ESD群の68[30-180]分よりも有意に短かった(P<0.0001,Table 4).
病変部位によるサブグループ解析
Table S1,2(電子付録):出典Digestive Endoscopy 2018;30に病変部位(直腸あるいは結腸)による治療成績を示す.
Ⅳ 考 察
本研究で,われわれはTAC-ESDの有効性を示した.TAC-ESDを使用すると従来法ESDと比較して治療時間は短縮され,中級者の自己完遂割合は高まった.TAC-ESDは簡単で安全な手技であり,成功割合も高いことが証明された.
TAC-ESDは大腸ESDを簡便にするための5つの利点がある.まず,TAC-ESDは,粘膜下層の視認性を良好にし,粘膜下層を剥離する際の術野を良好な状態で保つことができる.さらに,血管や筋層が明確に認識可能なため,術者は適切な深度で粘膜下層の剥離ができ,術中出血や術中穿孔を避けることができる.実際に,TAC-ESD群では術中穿孔がなかった.次に,TAC-ESDにおける牽引は組織とFlushknifeの接地面積を減少させる.接地面積が減少すると電流密度は増加し,より効率的に剥離ができ,結果として剥離スピードが向上する
21).この利点が,TAC-ESDの治療時間の短さに反映されている.さらには,糸付きクリップにより大腸の一部分である病変が固定され,呼吸や心拍動による大腸壁の動きが抑制され,大腸内視鏡の操作性が向上する.このため,中級者の自己完遂割合が高まったと考えられる.また,TAC-ESDだと治療の手順が簡単になる.糸付きクリップで粘膜フラップを把持した後は,全周切開を行い,粘膜下層剥離を行う.TAC-ESDでは,病変部位や病変径に応じて治療の手順を変える必要がない.最後に,TAC-ESDは特別なデバイスが必要ないので,世界中どこでも使用可能である.
S-O clip
22),ring-shaped thread traction
23),cross-counter technique
24),clip-and-snare method
25),clip flap
26)といった牽引法が大腸ESDを簡便にするために考案されている.これらの牽引法は,良好な視野を展開し治療時間を短縮するが,それぞれの方法に限界があり,広く用いられてはいない.S-O clipとring-shaped thread traction
22),23)は大腸壁の動きを抑えたり,牽引の強さを調整したりすることはできない.剥離が進むにつれて牽引が弱まり,追加のデバイスが必要になることがある.しかも,これらの牽引法では病変対側の大腸粘膜に牽引に用いたデバイスが固定されるため,ESD後の切除標本およびデバイスの回収がやや煩雑である.Cross-counter techniqueとclip-and-snare methodは,牽引の強さの調整が可能であるが
24),25),バルーンタイプオーバーチューブが必要である.Clip flapは,簡単で効果的な,重力を利用した間接的な牽引法であるが,常に効果的な牽引が得られるわけではない
26).これらの問題点を克服するために,われわれは従来の“糸付きクリップ法”
27)~31)を改良し,大腸内視鏡の抜去および再挿入を必要としないTAC-ESDを考案した.
しかしながら,TAC-ESDにも弱点がある.TAC-ESD成功割合は100%ではなかった.粘膜下層の剥離途中に近位側結腸の2例で糸付きクリップが外れた.腸管内の空気量や蠕動が牽引を強めてしまうことがあるので,近位側結腸では,牽引の強さを注意深く調整する必要がある.肛門からでている糸を強く引きすぎると,糸付きクリップに過度な摩擦が生じてしまう.このため良好な視野が得られたら,過度な牽引と摩擦を避けるために,決して糸を強く引かないようにしている.
今回の研究にはいくつかの限界がある.第一に,本研究は,試験開始前にTAC-ESDの経験がある大腸ESD中級者2名を主たる術者として実施した,単一施設によるものである.事前にTAC-ESDの経験があったことが結果に影響を与えているかもしれないので,TAC-ESDのラーニングカーブを考慮に入れる必要がある.世界中に大腸ESDを普及させるためには,TAC-ESDが大腸ESD初級者の自己完遂割合を向上させることができるかどうかを検討することも重要である.このため,本研究の正当性を評価するために,TAC-ESD経験のない初級者を術者とした多施設試験を行うことが望まれる.第二に,困難な部位や状況にあった表在型大腸腫瘍の患者は除外されている.われわれは,困難症例に対するTAC-ESDの使用経験を報告しているが,困難症例に対するTAC-ESDの有効性は十分に検証されていない
32),33).最後に,本研究では,術者が治療中に分かってしまうので,どちらの群に割付けられているかを術者に対して盲検化することができなかった.このため,本研究は非盲検化研究である.とは言え,従来法ESD群の治療時間中央値は70分であり,TAC-ESD群よりは長かったがわれわれの以前の従来法ESDの治療時間とは遜色なかった
18).これらの結果は,われわれは治療時間を意図的に長くするような時間の使い方はしていないことを示している.
われわれはTAC-ESDと従来法ESDを比較する無作為化比較試験を初めて行った.TAC-ESDは大腸ESD中級者にとって,治療時間を短縮することに有効であった.
謝 辞
今回の研究に協力して下さった大阪国際がんセンター内視鏡室のスタッフに深謝申し上げます.
補足資料
Table S1 中級者が施行した直腸ESD病変の臨床病理学的特徴と治療成績.
Table S2 中級者が施行した結腸ESD病変の臨床病理学的特徴と治療成績.
電子動画 1 直腸病変に対するTAC-ESD.治療の前に,ポリエステル糸をクリップに結び付ける.その後,糸付きクリップをクリップ装置に収納する.次に,大腸内視鏡を直腸に挿入する.直腸の4cmの病変に対して,粘膜切開を行った後,内視鏡を直腸の外へ引き抜いた.糸付きクリップを充填したクリップ装置を鉗子口から挿入し,大腸内視鏡を再度直腸内に挿入した.糸付きクリップで先程切開した肛門側の粘膜フラップを把持した.糸をゆっくり引くと,下層の視野が良好になった.
電子動画 2 結腸病変に対するTAC-ESD.大腸内視鏡を挿入する前に,ポリエステル糸を鉗子口内に挿入し,大腸内視鏡の外で糸を結んだ.その後,大腸内視鏡を結腸に挿入した.結腸の4cmの病変に対して粘膜切開を行った後,先程作った糸の結び目をハサミで切り,鉗子口側の糸をクリップの付け根に結び付けた.糸付きクリップが充填されたクリップ装置を鉗子口から挿入し,腸管内でクリップを完全に展開した.その後,糸付きクリップで粘膜フラップの肛門側を把持した.最終的に粘膜下層の視野が良好になり,病変の剥離が容易になった.
文 献
- 1. Torre LA, Bray F, Siegel RL et al. Global Cancer Statistics, 2012. CA Cancer J Clin 2015; 65: 87-108.
- 2. Arnold M, Sierra MS, Laversanne M et al. Global patterns and trends in colorectal cancer incidence and mortality. Gut 2017; 66: 683-91.
- 3. Winawer SJ, Zauber AG, Ho MN et al. Prevention of colorectal cancer by colonoscopic polypectomy. The National Polyp Study Workgroup. N Engl J Med 1993; 329: 1977-81.
- 4. Zauber AG, Winawer SJ, OʼBrien MJ et al. Colonoscopic polypectomy and long-term prevention of colorectal-cancer deaths. N Engl J Med 2012; 366: 687-96.
- 5. Løberg M, Kalager M, Holme Ø et al. Long-term colorectal-cancer mortality after adenoma removal. N Engl J Med 2014; 371: 799-807.
- 6. Moss A, Williams SJ, Hourigan LF et al. Long-term adenoma recurrence following wide-field endoscopic mucosal resection(WF-EMR)for advanced colonic mucosal neoplasia is infrequent:results and risk factors in 1000 cases from the Australian Colonic EMR(ACE)study. Gut 2015; 64: 57-65.
- 7. Ahlenstiel G, Hourigan LF, Brown G et al. Actual endoscopic versus predicted surgical mortality for treatment of advanced mucosal neoplasia of the colon. Gastrointest Endosc 2014; 80: 668-76.
- 8. Shigita K, Oka S, Tanaka S et al. Long-term outcomes after endoscopic submucosal dissection for superficial colorectal tumors. Gastrointest Endosc 2017; 85: 546-53.
- 9. Yamada M, Saito Y, Takamaru H et al. Long-term clinical outcomes of endoscopic submucosal dissection for colorectal neoplasms in 423 cases:a retrospective study. Endoscopy 2017; 49: 233-42.
- 10. Takeuchi Y, Iishi H, Tanaka S et al. Factors associated with technical difficulties and adverse events of colorectal endoscopic submucosal dissection:retrospective exploratory factor analysis of a multicenter prospective cohort. Int J Colorectal Dis 2014; 29: 1275-84.
- 11. Hori K, Uraoka T, Harada K et al. Predictive factors for technically difficult endoscopic submucosal dissection in the colorectum. Endoscopy 2014; 46: 862-70.
- 12. Yamashina T, Takeuchi Y, Nagai K et al. Scissor-type knife significantly improves self-completion rate of colorectal endoscopic submucosal dissection:single-center prospective randomized trial. Dig Endosc 2017; 29: 322-9.
- 13. Yamasaki Y, Takeuchi Y, Hanaoka N et al. A novel traction method using an endoclip attached to a nylon string during colonic endoscopic submucosal dissection. Endoscopy 2015; 47(Suppl 1):E238-9.
- 14. Yamasaki Y, Takeuchi Y, Uedo N et al. Traction-assisted colonic endoscopic submucosal dissection using clip and line:a feasibility study. Endosc Int Open 2016; 4:E51-5.
- 15. Yamasaki Y, Takeuchi Y, Uedo N et al. Feasibility of simple traction technique for rectal endoscopic submucosal dissection. Dig Dis Sci 2016; 61: 2127-31.
- 16. Taves DR. Minimization:a new method of assigning patients to treatment and control groups. Clin Pharmacol Ther 1974; 15: 443-53.
- 17. Toyonaga T, Man-I M, Fujita T et al. The performance of a novel ball-tipped Flush knife for endoscopic submucosal dissection:a case-control study. Aliment Pharmacol Ther 2010; 32: 908-15.
- 18. Takeuchi Y, Uedo N, Ishihara R et al. Efficacy of an endo-knife with a water-jet function(Flushknife)for endoscopic submucosal dissection of superficial colorectal neoplasms. Am J Gastroenterol 2010; 105: 314-22.
- 19. Schlemper RJ, Riddell RH, Kato Y et al. The Vienna classification of gastrointestinal epithelial neoplasia. Gut 2000; 47: 251-5.
- 20. Dixon MF. Gastrointestinal epithelial neoplasia:Vienna revisited. Gut 2002; 51: 130-1.
- 21. Lee BI. Debates on colorectal endoscopic submucosal dissection:traction for effective dissection:gravity is enough. Clin Endosc 2013; 46: 467-71.
- 22. Sakamoto N, Osada T, Shibuya T et al. Endoscopic submucosal dissection of large colorectal tumors by using a novel spring-action S-O clip for traction(with video). Gastrointest Endosc 2009; 69: 1370-4.
- 23. Mori H, Kobara H, Nishiyama N et al. Novel effective and repeatedly available ring-thread counter traction for safer colorectal endoscopic submucosal dissection. Surg Endosc 2017; 31: 3040-7.
- 24. Okamoto K, Muguruma N, Kitamura S et al. Endoscopic submucosal dissection for large colorectal tumors using a cross-counter technique and a novel large-diameter balloon overtube. Dig Endosc 2012; 24(Suppl 1): 96-9.
- 25. Yamada S, Doyama H, Ota R et al. Impact of the clip and snare method using the prelooping technique for colorectal endoscopic submucosal dissection. Endoscopy 2016; 48: 281-5.
- 26. Yamamoto K, Hayashi S, Saiki H et al. Endoscopic submucosal dissection for large superficial colorectal tumors using the “clip-flap method.”Endoscopy 2015; 47: 262-5.
- 27. Oyama T. Counter traction makes endoscopic submucosal dissection easier. Clin Endosc 2012; 45: 375-8.
- 28. Suzuki S, Gotoda T, Kobayashi Y et al. Usefulness of a traction method using dental floss and a hemoclip for gastric endoscopic submucosal dissection:a propensity score matching analysis(with videos). Gastroint Endosc 2016; 83: 337-46.
- 29. Yoshida M, Takizawa K, Ono H et al. Efficacy of endoscopic submucosal dissection with dental floss clip traction for gastric epithelial neoplasia:a pilot study(with video). Surg Endosc 2016; 30: 3100-6.
- 30. Koike Y, Hirasawa D, Fujita N et al. Usefulness of the thread-traction method in esophageal endoscopic submucosal dissection:randomized controlled trial. Dig Endosc 2015; 27: 303-9.
- 31. Jacques J, Geyl S, Carrier P et al. A combination of the clip-with-line method and the tunnel technique during esophageal endoscopic submucosal dissection:a technical solution? Endoscopy 2015; 47(Suppl 1):E307-8.
- 32. Kanesaka T, Uedo N, Higashino K et al. Traction-assisted endoscopic submucosal dissection of a rectal adenoma located on the anastomotic suture line. Gastrointest Endosc 2017; 85: 857-8.
- 33. Shichijo S, Yamasaki Y, Takeuchi Y. A case of colonic adenoma involving a diverticulum resected by a traction-assisted endoscopic submucosal dissection technique. Dig Endosc 2017; 29: 729-30.
 https://orcid.org/0000-0002-2992-9863
https://orcid.org/0000-0002-2992-9863
 https://orcid.org/0000-0003-3814-298X
https://orcid.org/0000-0003-3814-298X
 https://orcid.org/0000-0002-3029-9272
https://orcid.org/0000-0002-3029-9272
 https://orcid.org/0000-0002-1330-6282
https://orcid.org/0000-0002-1330-6282
 https://orcid.org/0000-0002-9322-9642
https://orcid.org/0000-0002-9322-9642