要旨
64歳,男性.食欲不振・下痢により,9カ月間で23kgの体重減少を認めた.高血圧症に対して,オルメサルタン内服歴が10年間あった.上下部内視鏡検査では原因となる疾患を認めず,小腸カプセル内視鏡検査で,十二指腸・小腸の絨毛萎縮を認めた.十二指腸粘膜生検ではアミロイド沈着,異型リンパ球は認めず,便培養・便虫卵検査が陰性であることから,セリアック病を疑った.オルメサルタン内服中であることから,セリアック病と同様の臨床像を呈するオルメサルタン関連スプルー様腸疾患を疑い,オルメサルタンを中止とした.その後,食欲不振・下痢・体重減少は改善し,4カ月後の小腸カプセル内視鏡検査で,十二指腸・小腸の絨毛萎縮の改善を認めた.慢性下痢の原因として,オルメサルタン内服中の場合には,オルメサルタン関連スプルー様腸疾患を念頭におくべきである.小腸カプセル内視鏡検査は小腸絨毛の萎縮評価に有用であった.
Ⅰ 緒 言
オルメサルタンによる吸収不良症候群として,オルメサルタン関連スプルー様腸疾患が近年提唱されている.今回,小腸カプセル内視鏡検査が診断に有用であると考えられた症例を経験したので報告する.
Ⅱ 症 例
症例:64歳,男性.
主訴:食欲不振,下痢,体重減少.
既往歴:高血圧症,糖尿病,十二指腸潰瘍.
内服薬:オルメサルタン10mg/日,メトホルミン1,000mg/日,ファモチジン40mg/日,酪酸菌製剤.
渡航歴:なし.
現病歴:2016年3月から食欲不振,水様性下痢(10回/日)が出現した.血液検査・上下部内視鏡検査・胸腹骨盤部造影CT検査・腹部超音波検査を施行したが,原因を同定できなかった.
6月から食欲不振はさらに悪化した.脱水による腎前性腎不全も認めたため,緊急入院となった.
入院時現症:身長168cm.体重55kg(2015年12月まで70kg).体温36.1℃.血圧79/61mmHg.脈拍106回/分,整.
頭部:眼瞼結膜に貧血なし.
胸部:異常所見なし.
腹部:平坦,軟,自発痛・圧痛なし.
臨床検査成績(2016年6月入院時):低栄養によるアルブミン・コリンエステラーゼ・総コレステロールの低下,脱水に伴う腎機能障害,電解質異常,耐糖能障害,GPT・ALP・CRP・TSHの軽度上昇を認めた(Table 1).便培養・便虫卵検査は陰性だった.
上部内視鏡所見:ピロリ感染胃炎,十二指腸球部前壁に潰瘍瘢痕を認めた.
下部内視鏡所見:回腸末端まで挿入.回腸末端にリンパ濾胞を認めた.結腸・直腸に粗大病変は認めなかった.回腸末端・結腸・直腸の生検は未施行.
臨床経過:点滴で脱水は改善し,ある程度の食事摂取が可能になったため退院となったが,その後も食欲不振・下痢は持続していた.体重は9カ月間で23kg減少した.
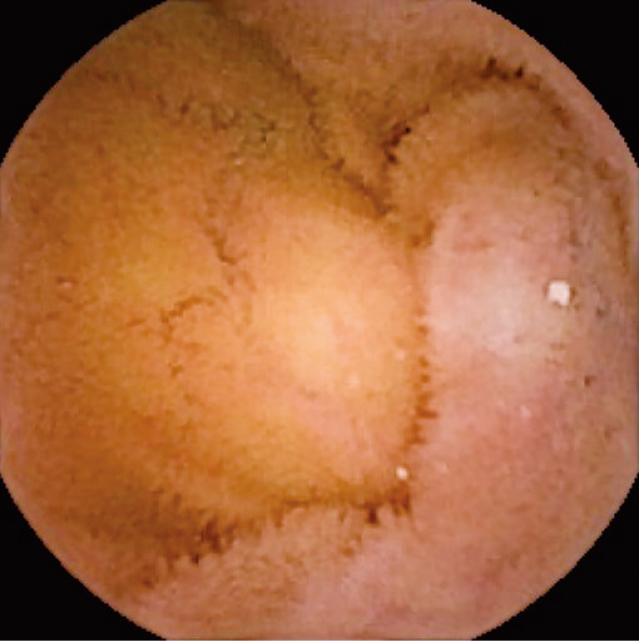
9月に小腸カプセル内視鏡検査(以下CE)を施行し,十二指腸・空腸・回腸に,びまん性に平坦状粘膜面(絨毛が消失し,平坦になった粘膜面)を認めた.絨毛の丈は低くなっており絨毛萎縮と判断した(Figure 1,電子動画 1).生検目的に上部内視鏡検査を再検し,十二指腸下行部においてインジゴカルミン散布後の近接観察でリング状絨毛(丈が低くなり,蛇行が増強し,リング状かそれに近似した外形となった絨毛)と平坦状粘膜面を認めた.絨毛萎縮と判断し同部から生検を施行した(Figure 2).十二指腸粘膜生検では,絨毛の萎縮・消失,粘膜固有層に多彩な炎症細胞浸潤を認めた.上皮内リンパ球の増加,異型リンパ球,膠原繊維の肥厚,アミロイド沈着,陰窩過形成は認めなかった(Figure 3).
電子動画1
以上より,腸管アミロイドーシス,腸管悪性リンパ腫,ランブル鞭毛虫症,糞線虫症は鑑別疾患から除外され,セリアック病が疑われた.オルメサルタン内服中であることから,セリアック病と同様の臨床像を呈するオルメサルタン関連スプルー様腸疾患を疑い,オルメサルタンを中止とした.オルメサルタン中止7日後には食欲不振・下痢は改善した.体重は3カ月で16kg増加し,アルブミンは2.1g/dlから3.7g/dlまで上昇した(Figure 4).
2017年1月にCEを施行した.十二指腸・空腸・回腸全域で,小腸絨毛は丈が高くなっており,指状絨毛を認めた.絨毛萎縮改善と判断した.(Figure 5,電子動画 2).上部内視鏡検査でも,十二指腸絨毛は丈が高くなっており,指状絨毛を認めた.十二指腸粘膜生検では,絨毛の高さは改善し,粘膜固有層の炎症細胞浸潤もやや改善していた(Figure 6).
電子動画2
オルメサルタンの中止のみで症状・内視鏡所見・病理組織像が改善したことから,オルメサルタン関連スプルー様腸疾患と最終診断した.
Ⅲ 考 察
2012年にRubio Tapiaらはオルメサルタン関連スプルー様腸疾患を提唱した
1).オルメサルタン服用後に発症する,慢性下痢と体重減少を主症状とする吸収不良症候群である.
発症機序としては2つの仮説が提唱されている.1つ目の仮説は,腸管粘膜の免疫維持に重要なTGF-βがオルメサルタンにより抑制される説である
1).2つ目の仮説は,アンギオテンシンⅡがAT2受容体に結合することで,小腸アポトーシスが促進されるという説である.オルメサルタンによりアンギオテンシンⅡのAT1受容体の結合が阻害され,その結果アンギオテンシンⅡとAT2受容体との結合が増加し,小腸アポトーシスが促進される
2).
内視鏡所見は,小腸絨毛の萎縮・白色顆粒状隆起の集簇・粗造粘膜が認められると報告されている
3).自験例では,小腸カプセル内視鏡検査にて小腸全域の絨毛萎縮を確認することができた.
病理組織像は,小腸絨毛の萎縮(頻度100%),上皮内リンパ球の増加(頻度64%),上皮下の膠原繊維の肥厚(頻度32%),粘膜固有層の炎症細胞浸潤が認められるとされる
1).自験例では小腸絨毛の萎縮・粘膜固有層の炎症細胞浸潤を認めたが,上皮内リンパ球の増加・上皮下の膠原繊維の肥厚は認めなかった.
同様の症状・内視鏡所見・病理組織像を呈する疾患としてセリアック病との鑑別を要する.セリアック病は臨床症状として,慢性下痢・腹痛・腹部不快感などの消化器症状に加え,鉄欠乏症・低蛋白血症・骨粗鬆症などの消化管外症状を合併しうる.血清学的検査としては,抗グアリジン抗体・抗筋内膜抗体が陽性となる.組織学的所見としては,十二指腸粘膜における所見が重要とされており,粘膜上皮内細胞浸潤・陰窩過形成・絨毛萎縮・絨毛消失・上皮細胞のアポトーシスの増加などの変化がみられる
4).腸上皮間リンパ球/腸上皮細胞>30/100(十二指腸)または>40/100(空腸)がセリアック病の診断基準として挙げられている
5).以上の臨床症状・血清学的所見・組織学的所見およびグルテンフリー食への反応から総合的に診断される.セリアック病ではなく,オルメサルタンスプルー様腸疾患を支持する鑑別点としては,①抗グリアジン抗体・抗筋内膜抗体が陰性であること,②グルテンフリー食で症状が改善しないこと,③オルメサルタンの中止のみで症状が短期間で改善することが挙げられている
6).自験例では保険未承認のため,抗グリアジン抗体・抗筋内膜抗体は測定していない.しかし,オルメサルタンの中止のみで症状が劇的に改善したことから,オルメサルタン関連スプルー様腸疾患と診断した.
医学中央雑誌で“オルメサルタン”ד副作用”をキーワードにして2015年から2017年の期間に報告された症例を検索した結果,オルメサルタン関連スプルー様腸疾患を本邦では3例認めた.Table 2に自験例を含めた報告例の一覧を示す
3),6),7).患者の年齢は60歳代~76歳だった.性別は男性3例,女性1例で,すべての症例で体重減少を認めた.Ueharaらにより,Wernicke脳症を呈するほど重症化した症例が報告されている
7).体重減少量は12kg~23kg,オルメサルタン内服期間は1年6カ月~10年,発症から診断までの期間は2カ月~9カ月だった.オルメサルタン内服開始から腸疾患発症までに,いずれも数年が経過していた.そのため下痢の原因としてオルメサルタンを想起し難く,診断に至るまで長時間を要していた.内視鏡所見・病理組織像としては,十二指腸絨毛の萎縮をすべての症例に認めた.

絨毛萎縮の内視鏡評価は通常観察のみでは困難であり,コントラスト法の併用・染色法の併用・NBI等の画像強調観察の併用・近接または拡大内視鏡の併用・水浸下での観察等の工夫が必要である
8)~11).絨毛萎縮の内視鏡分類としては田中の分類がある
8),9).正常絨毛の外形は,指状・葉状・尾根状に分類されている.萎縮絨毛の外形は,旋回状・リング状・平坦状に分類されている.自験例では初回の上下部内視鏡で十二指腸および回腸末端は通常観察のみであり,絨毛外形の評価は不十分だった.CEでは腸液により水浸下の観察となるため,近接および拡大効果により絨毛外形の評価が容易である
10),12)~15).自験例でもCEにより生理的条件下で絨毛萎縮を観察することができ,これを契機にオルメサルタン関連スプルー様腸疾患と診断することができた.福島らはダブルバルーン小腸内視鏡検査・CEで全小腸を観察し得た本疾患を報告しているが,オルメサルタン中止後のCEについての記載はない
3).自験例ではCEを用いて,オルメサルタン中止後の小腸の絨毛萎縮の改善も観察することができた.なお,山本らはオルメサルタンによりMicroscopic enterocolitisの一つであるリンパ球性腸炎を呈した症例を報告している
16).自験例では大腸から生検を行っていないため,Microscopic enterocolitisの合併は否定できない.
Ⅳ 結 語
オルメサルタン関連スプルー様腸疾患の1例を経験した.オルメサルタン内服患者の慢性下痢の原因として本疾患を念頭におくべきであり,CEは小腸絨毛の萎縮評価に有用であった.
本論文内容に関連する著者の利益相反:なし
補足資料
電子動画1 オルメサルタン中止前の小腸のカプセル内視鏡の動画.
びまん性に平坦状粘膜面を認めた.一部に,粘膜粗造や粘膜発赤を認めた.
電子動画2 オルメサルタン中止4カ月後の小腸のカプセル内視鏡の動画.
小腸絨毛は丈が高くなっており,指状絨毛を認めた.粘膜粗造や粘膜発赤は改善していた.
文 献
- 1. Rubio-Tapia A, Herman ML, Ludvigsson JF et al. Severe spruelike enteropathy associated with olmesartan. Mayo Clin Proc 2012; 87: 732-8.
- 2. Ianiro G, Bibbo S, Montalto M et al. Systematic review:sprue-like enteropathy associated with olmesartan. Aliment Pharmacol Ther 2014; 40: 16-23.
- 3. 福島 政司, 伊藤 卓彦, 松本 一寛ほか.オルメサルタンスプルー様腸疾患の1例.胃と腸 2016; 51: 497-502.
- 4. 中澤 英之, 石田 文宏.セリアック病.臨牀消化器内科 2013; 28: 237-42.
- 5. 渡辺 知桂子, 穂刈 量太, 三浦 総一郎.セリアック病と類縁疾患.消化と吸収 2016; 38: 168-72.
- 6. 小泉 忠史, 古家 乾, 馬場 英ほか.オルメサルタンによる体重減少,腎不全を伴う重症の水様性下痢を来たした1例.日本内科学会雑誌 2015; 104: 1167-74.
- 7. Uehara T, Ikusaka M, Ohira Y et al. Olmesartan-induced enteropathy manifesting as Wernicke-Korsakoff syndrome. Intern Med 2016; 55: 3675-8.
- 8. 田中 三千雄, 藤本 誠, 小尾 龍右ほか.拡大観察と組織構築の関連 十二指腸・小腸.胃と腸 2007; 42: 557-62.
- 9. 田中 三千雄, 岩井 久和.小腸絨毛の形態分類.消化器内視鏡 2014; 104: 75-80.
- 10. 大塚 和朗, 児玉 健太, 池田 晴夫ほか.十二指腸・小腸の内視鏡.臨床消化器内科 2010; 25: 1139-44.
- 11. 馬場 由紀子, 松田 彰郎, 西俣 伸亮ほか.グルテン制限食で臨床症状,画像所見が改善したセリアック病の1例.胃と腸 2015; 50: 950-6.
- 12. 藤谷 幹浩, 伊藤 貴博, 高後 裕ほか.消化吸収障害とカプセル内視鏡.日本消化器病学会雑誌 2011; 108: 575-84.
- 13. Petroniene R, Dubcenco E, Baker JP et al. Given capsule endoscopy in celiac disease:evaluation of diagnostic accuracy and interobserver agreement. Am J Gastroenterol 2005; 100: 685-94.
- 14. Hopper AD, Sidhu R, Hurlstone DP et al. Capsule endoscopy:an alternative to duodenal biopsy for the recognition of villous atrophy in coeliac disease? Dig Liver Dis 2007; 39: 140-5.
- 15. Rondonotti E, Spada C, Cave D et al. Video capsule enteroscopy in the diagnosis of celiac disease:a multicenter study Am J Gastroenterol 2007; 102: 1624-31.
- 16. 山本 壮一郎, 三朝 博仁, 釼持 孝弘ほか.オルメサルタンが関連したと考えられたリンパ球性腸炎の1例.Progress of Digestive Endoscopy 2017; 90: 116-7.