要旨
58歳,女性.5年程前から排便時出血が出現.出血が多くなってきたため精査目的に当科受診.下部消化管内視鏡検査で直腸に40mm大の非腫瘍粘膜で覆われ黄色調を呈し急峻に立ち上がる,頂部潰瘍を伴う有茎性隆起性病変を認めた.潰瘍辺縁から生検し,neuroendocrine tumor(NET)の診断となった.造影CTでは側方リンパ節腫大を伴い,肝S3に石灰化伴う腫瘍も認めた.二期的に手術が施行され直腸腫瘍・腫大リンパ節・肝腫瘍ともに切除されたが,いずれも病理診断はNET G1であった.直腸NET G1で肝転移を伴う大きな腫瘍に進行した症例は稀であり,文献的考察を加味し報告する.
Ⅰ 緒 言
消化管の高分化型神経内分泌腫瘍(neuroendocrine tumor:NET)は,WHO 2019で増殖能(核分裂像,Ki-67指数)に基づいて分類されている.核分裂像数(/2mm2)<2で低悪性度(G1),2-20で中悪性度(G2),>20で高悪性度(G3)となっている.一方Ki-67指数は<3%でG1,3-20%でG2,>20%でG3となっている.どちらかの高い方に基づいて悪性度が確定される
1).悪性度が高くなるにつれて膵臓や消化管のNETは予後が悪化する
2).しかしながら,低悪性度であれば緩徐に進行することが予想されるものの,NET G1でも遠隔転移が生じた症例が報告されている.今回われわれは,出血症状があったが長期間様子をみられ,NET G1であるが肝転移を伴い潰瘍形成を伴う40mm大の病変に進行した直腸NETを経験したので,文献的考察を加味し報告する.
Ⅱ 症 例
患者:58歳,女性.
主訴:排便時出血.
既往歴:42歳 子宮筋腫で子宮全摘術,51歳 右被殻出血で保存的治療(後遺症なし).
家族歴:特記事項なし.
現病歴:5年ほど前から排便時出血があったが,痔出血と患者が自己判断し放置していた.最近出血の頻度が多くなってきたため,精査目的に当科外来を受診した.
現症:身長160cm,体重83.2kg,体温36.4℃,血圧138/86mmHg,脈拍96/min,心音・呼吸音に異常なし.腹部平坦軟で圧痛なし.顔面紅潮発作や下痢などのカルチノイド症状はなし.
血液検査および生化学検査;血算・生化学・凝固検査に特記すべき所見なし.腫瘍マーカーはCEAとCA19-9は基準値範囲内.
内視鏡所見(Figure 1):肛門部に血管拡張所見や炎症所見は認めなかった.直腸下Houston弁を基部とする,非腫瘍粘膜で覆われ黄色調を呈し急峻に立ち上がる40mm大でやや凹凸のある隆起性病変を認めた.鉗子で押すと硬い腫瘍であり,反転観察では頂部に潰瘍を伴っていた.硬い粘膜下腫瘍の鑑別として平滑筋腫や神経原性腫瘍,消化管間質腫瘍,神経内分泌腫瘍(neuroendocrine tumor:NET)などを考え,潰瘍辺縁から生検しNETの診断を得た.
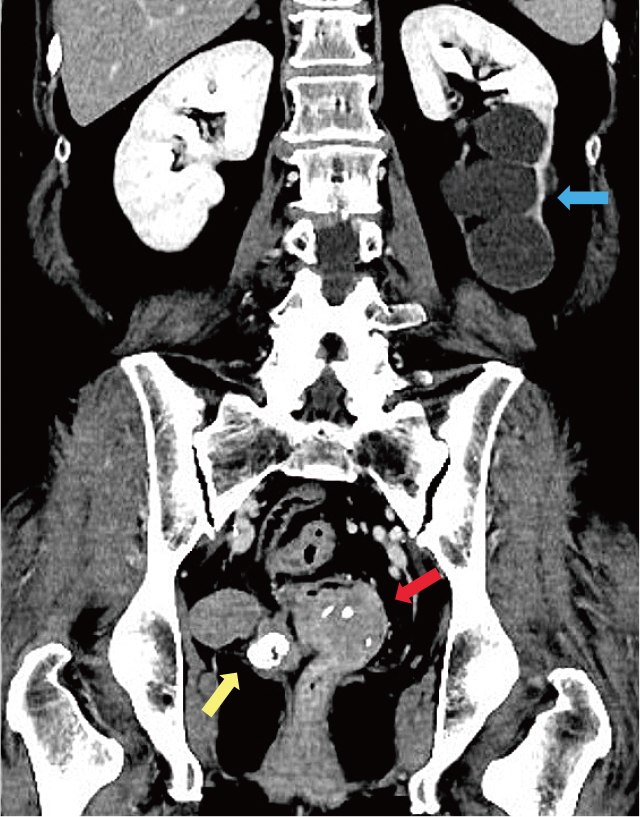
腹部CT所見(Figure 2):直腸に44×40mm程の軟部組織と同程度の濃度を有する境界明瞭な腫瘤を認め,内部に石灰化を伴っていた.さらには骨盤右側に35mm大,膣断端右側に石灰化を伴う20mm大の直腸と同濃度の腫瘤がみられた.さらに肝S3に10mm大の小石灰化を伴う結節を認めた.なお,L5/S1レベルで左尿管結石を認め,左水腎症を伴っていた.
肝EOB-MRI所見(Figure 3):肝細胞相で肝S3に10mm大の低信号を認め,直腸NETの転移を疑った.
治療経過:低残渣食を摂取してもらうことで排便時出血は落ち着いた.左尿管結石治療後に外科で腹腔鏡下超低位前方切除術,上方リンパ節D3郭清,右側方リンパ節摘出術を施行された.直腸手術の2カ月後,肝転移についても腹腔鏡下肝S3区域切除が施行された.両病変ともに切除断端は陰性で,術後経過は良好であった.その後,無治療で術後1年経過観察したが,再発は認めていない.
切除標本所見(直腸)(Figure 4):直腸粘膜下層を中心に筋層に浸潤した45×38×34mmの粘膜下腫瘍を認め,割面像では腫瘍内部に出血と一部石灰化を認めた.直下の外膜,漿膜下層側に40×32×25mmの石灰化伴う腫瘤形成を伴っていた.
病理組織学的所見(直腸)(Figure 5):索状から胞巣状,ribbon状の構造を呈して増殖する腫瘍で,比較的単調な類円形の核を有し,細胞分裂像は0個/10高倍率視野であった.高分化なNETに一致する形態であり,免疫染色でSynaptophysin(+),CD56(+),chromograninごく一部に(+),Ki-67:1.9%でNET G1と診断された.しかし,EVG染色で静脈侵襲を認め,郭清リンパ節には6/19個に転移が認められた.
病理組織学的所見(肝臓)(Figure 6):直腸の腫瘍部と同様の形態を示す腫瘍であった.免疫染色上,Synaptophysin(+),CD56(+),chromogranin(-),Ki-67:1%未満であり,NET G1の転移として矛盾しない所見であった.
Ⅲ 考 察
消化管NETは非常に稀な疾患であるが,Itoらによる本邦の疫学調査によると,1年間の人口10万人あたりの新規発症数は2005年が2.1人,2010年が3.5人と増加傾向である
3).内視鏡による診断能の向上で発見率が上がっているとされ,特に本邦では精密検査やサーベイランス・スクリーニングの大腸内視鏡検査で発見される非機能性直腸NETの頻度が高い.本邦における消化管NETの70%は後腸(横行結腸遠位1/3から肛門管)由来であり,大腸NETのうち90%は直腸から発生し,直腸NETの80%は内分泌細胞の分布の関係で歯状線から約10cmの下部直腸に発生すると言われており,直腸は反転観察で詳細な観察が可能なことも発見率が高いことに関係していると考えられる
4),5).直腸NETはアジア人に多く,無症候性で結腸NETよりも生存率が良く,5年生存率は62- 88%と言われている
6),7).多くの研究から,腫瘍の大きさがリンパ節転移の予測に不可欠な要素であることが確認されており,腫瘍径が10mm以上ではリンパ節転移率が32.4%と高く,リンパ節郭清を伴う直腸切除術が推奨されている
8).一方で10 mm以下で発見されれば内視鏡治療で根治が得られる症例が少なくない.関口らは内視鏡切除した直腸NET G1を検討しており,大きさ中央値5mm(2-13mm)の90病変において,約半数にあたる46.7%がリンパ管侵襲もしくは静脈侵襲を伴っていたものの,観察期間中央値76.1カ月(12.2-198.2カ月)で再発・転移・原病死となった症例は1例も認めなかったと報告している
9).
今回われわれが経験した症例は,肛門部に出血所見は認めないことから,長期にわたる排便時出血は直腸NETから生じたことが示唆された.本症例は長期経過でもKi-67で示される増殖能が悪化しているわけではなく,NET G1のままで転移が広がったと考えた.直腸NETはKi-67が転移能の予測因子として有用であるとの報告があり
10),悪性度が高いほど転移リスクが高いことが予測される.しかし,ItoらはNET G1,G2でも2.7%に遠隔転移を認めたと報告しており
3),実際にKi-67も低く腫瘍径10mm以下の小さな病変でも転移をきたした症例が報告されている
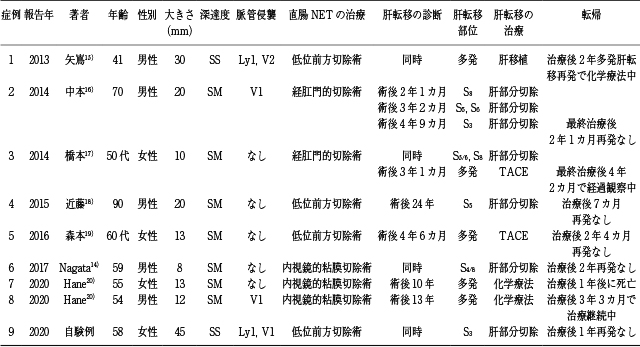
11)~14).NETの増殖能に基づいた分類が確立された2010年から2020年にかけてPubMedで「rectal neuroendocrine tumor」と「liver metastasis」,さらに医中誌で「直腸神経内分泌腫瘍or直腸カルチノイドor直腸NET」と「肝転移」で検索し,ヒットした文献から直腸NET G1と診断されて肝転移を認めた報告例は,自験例を含め9例であった(Table 1)
14)~20).術後24年経ってから指摘された症例もあり,直腸NETはG1であっても長期間にわたる経過観察が必要であることが示唆される.腫瘍径やKi-67では評価できない転移リスク因子の解明が待たれる.
今回の症例において,直腸NETと肝NETがどちらも原発である可能性も考えられたが,肝原発のNETは非常に珍しく,直腸NETの遠隔転移の好発部位は圧倒的に肝臓が多いと報告されており
14),どちらの病理診断結果もNET G1であったことからも転移と診断した.主に膵NETでの報告ではあるが,切除可能な肝転移であれば領域リンパ節郭清を伴う手術を施行することで65-80%という良好な5年生存率が得られることが報告されており,本邦の膵・消化管NETの診療ガイドラインでも治癒切除可能病変については切除を中心とした集学的治療が推奨されている
1).NET肝転移に対する肝移植治療も報告されているが,5年生存率63%と良好であるものの移植後再発率は31.3-56.8%と高率であった
21).術後補助療法については,膵・消化管NET切除後で実施するエビデンスが確立しておらず,今回の症例も術後は無治療で経過観察となっている.切除標本のKi-67が高い場合,リンパ節転移陽性例や肝転移巣切除後で術後再発率が高いことが示されており
22),23),有効なNETの術後補助療法の登場が期待される.
Ⅳ 結 語
長期経過と考えられる肝転移をきたした直腸NET G1の1例を経験した.NET G1であるが40 mm超に増大し,リンパ節転移や肝転移を伴っていた症例であった.NET G1のままでも増大や転移のリスクがあることを示す症例であり,非常に稀な経過と考え報告した.
文 献
- 1. 日本神経内分泌腫瘍研究会.膵・消化管神経内分泌腫瘍(NEN)診療ガイドライン2019(第2版).金原出版,東京,2019.
- 2. Heetfeld M, Chougnet CN, Olsen IH et al. Characteristics and treatment of patients with G3 gastroenteropancreatic neuroendocrine neoplasms. Endocr Relat Cancer 2015; 22:657-64.
- 3. Ito T, Igarashi H, Nakamura K et al. Epidemiological trends of pancreatic and gastrointestinal neuroendocrine tumors in Japan:a nationwide survey analysis. J Gastroenterol 2015; 50:58-64.
- 4. 千野 晶子, 片岡 星太, 田顔夫 佑樹ほか.直腸NETの診断,予後,経過観察法.消化器内視鏡 2016;28:1793-801.
- 5. 佐野村 誠, 川上 研, 柿本 一城ほか.直腸カルチノイド (2)内視鏡診断と治療.INTESTINE 2019;23:55-62.
- 6. Anthony LB, Strosberg JR, Klimstra DS et al. The NANETS consensus guidelines for the diagnosis and management of gastrointestinal neuroendocrine tumors(nets):well-differentiated nets of the distal colon and rectum. Pancreas 2010; 39:767-74.
- 7. Shah MH, Goldner WS, Halfdanarson TR et al. NCCN guidelines insights:neuroendocrine and adrenal tumors, version 2. 2018. JNatl Compr Canc Netw 2018; 16:693-702.
- 8. Soga J. Early-Stage carcinoids of the gastrointestinal tract:an analysis of 1,914 reported cases. Cancer 2005; 103:1587-95.
- 9. 関口 正宇, 関根 茂樹, 坂本 琢ほか.大腸カルチノイドの診断と長期経過.胃と腸 2017;52:441-9.
- 10. Hotta K, Shimoda T, Nakanishi Y et al. Usefulness of Ki 67 for predicting the metastatic potential of rectal carcinoid. Pathol Int 2006; 56:591-6.
- 11. 大久保 翔志, 大沼 忍, 鈴木 秀幸ほか.リンパ節転移を認めた長径5mmの直腸神経内分泌腫瘍の1例.癌と化学療法 2017;45:1985-7.
- 12. 嶋田 仁, 野田 顕義, 佐々木 貴浩ほか.側方リンパ節転移を伴った10mmの直腸NETの1例.手術 2017;71:1233-7.
- 13. 小室 浩康, 浦上 尚之, 面高 俊祐ほか.脈管侵襲を伴った小さな直腸NETの1例.Progress of Digestive Endoscopy 2016;88:162-3.
- 14. Nagata K, Tajiri K, Shimada S et al. Rectal Neuroendocrine Tumor G1 with a Solitary Hepatic Metastatic Lesion. Intern Med 2017; 56:289-93.
- 15. 矢嶌 弘之, 磯本 一, 黒濱 大和ほか.多発肝転移を伴った直腸神経内分泌腫瘍の1例.胃と腸 2013;48:1043-8.
- 16. 中本 貴透, 小山 文一, 中川 正ほか.異時性肝転移および側方リンパ節転移に対し四度の切除術を施行した直腸カルチノイドの1例.癌と化学療法 2014;41:1829-31.
- 17. 橋本 安司, 佐々木 洋, 横山 茂和ほか.肝動脈塞栓化学療法の反復により長期生存を得ている直腸カルチノイド肝転移再発の1例.癌と化学療法 2014;41:2142-4.
- 18. 近藤 宏佳, 岡本 光順, 小山 勇ほか.低位前方切除後24年目に肝転移を認めた直腸カルチノイドの1例.日臨外会誌 2015;76:2263-7.
- 19. 森本 祥悠, 賀川 義規, 内藤 敦ほか.肝動脈化学塞栓療法により病巣制御可能であった直腸NET異時性多発肝転移の1例.癌と化学療法 2016;43:1812-4.
- 20. Hane Y, Tsuchikawa T, Tanaka K et al. Metachronous liver metastasis after long-term follow-up endoscopic resection for rectal neuroendocrine neoplasms:a report of three cases. Surg Case Rep Publication Date:15 Jan 2020;DOI:10.1186/s40792-020-0792-5.
- 21. Moris D, Tsilimigras DI, Ntanasis-Stathopoulos I et al. Liver transplantation in patients with liver metastases from neuroendocrine tumors:A systematic review. Surgery 2017; 162:525-36.
- 22. Ramage JK, De Herder WW, Delle Fave G et al. Vienna Consensus Conference participants ENETS consensus guidelines update for colorectal neuroendocrine neoplasms. Neuroendocrinology 2016; 103:139-43.
- 23. Frilling A, Clift AK. Therapeutic strategies for neuroendocrine liver metastases. Cancer 2015; 121:1172-86.