要旨
【背景・目的】胃癌と非癌粘膜の白色球状外観(white globe appearance:WGA)の違いを明らかにする.
【方法】胃WGA症例の内視鏡所見と臨床的特徴を後ろ向きに解析した.
【結果】胃癌18例,非癌23例にWGAを認めた.胃癌症例は7例(38.9%),非癌症例は17例(73.9%)がプロトンポンプ阻害剤(proton pump inhibitor:PPI)を内服していた.病理学的には,胃癌症例(18例)のうち腺管の嚢胞状拡張は12例(66.7%),腺腔内壊死物質は12例(66.7%),壁細胞の過形成と内腔への鋸歯状の突出(parietal cell protrusion:PCP)は1例(5.6%)でみられた.一方,非癌症例のうち14例で生検が実施され,腺管の嚢胞状拡張は8例(57.1%),PCPは7例(50.0%)でみられたが,腺腔内壊死物質は指摘できなかった.非癌群において,自己免疫性胃炎を2例,内視鏡的粘膜下層剝離術後瘢痕を2例,腺腫を1例,ランタン沈着を1例,胃MALTリンパ腫を1例に認めた.
【結論】胃癌粘膜と非癌粘膜ではWGAの成因は異なり,非癌症例ではPPI服用が関与している可能性が示唆された.
Ⅰ 緒 言
白色球状外観(white globe appearance:WGA)は,“狭帯域光観察(narrow band imaging:NBI)併用拡大内視鏡観察中に認める,上皮直下に存在する小さな(1mm以下の)白色球状外観”と定義されており,土山らにより提唱された
1).WGAは早期胃癌の約20%にみられ,demarcation line内側近傍に存在することが多く,分化型成分を有する癌に認められるのに対し,純未分化型癌には存在しない等の特徴がある
2)~4).一方で,良性潰瘍瘢痕や,好酸球性胃腸炎の胃粘膜においてもWGAがみられ
2),4),われわれも以前,自己免疫性胃炎(A型胃炎)やプロトンポンプ阻害薬(proton pump inhibitor:PPI)服用中の非癌患者の胃粘膜にWGAを認めることを報告した
5)~7).胃癌に随伴するWGAは,拡張した癌腺管内に貯留した壊死物質を反映した所見とされている
1),2)のに対し,われわれの検討では,非癌患者においては腺管の拡張は認めるものの,壊死物質の貯留はなく,胃癌粘膜と非癌粘膜ではWGAの成因や病態,あるいは疾患自体が異なる可能性が示唆された
5),6).そこで今回われわれは,胃癌と非癌粘膜のWGAの違いを明らかにするため,自施設でWGAと診断した症例について,背景疾患および病理組織学的特徴を後ろ向きに解析した.
Ⅱ 対象と方法
検討1
既報に倣い,“NBI併用または青色レーザーイメージング(blue laser imaging:BLI)拡大内視鏡観察中に認める小さな白色球状外観で,表面に微小血管模様を伴うもの”をWGAと定義した
1)~4).2015年12月~2019年11月に岡山大学病院光学医療診療部で実施された内視鏡検査のうち,42例で所見用紙に“white globe appearance”および/または“WGA”と記載されていた.食道癌にWGAを伴う1症例を除いた41例について,年齢,性別,内視鏡所見,背景病変,PPI服用の有無,糖尿病薬の使用の有無,腎障害の有無,H. pylori感染状態を後ろ向きに解析した.本研究では,透析中またはeGFR 60mL/min/1.73m2未満の患者を“腎障害あり”と定義し,透析中,腎不全(eGFR 15mL/min/1.73m2未満),eGFR高度低下(30mL/min/1.73m2未満),eGFR中程度低下(60mL/min/ 1.73m2未満)に細分類した.H. pylori感染状態は,H. pylori除菌歴の問診,尿素呼気試験,迅速ウレアーゼ試験,血中H. pylori IgG抗体および/または鏡顕法の結果に基づき,未感染,現感染,既往感染,判定不能に分類した.
次に,生検および/または内視鏡的粘膜下層剝離術(endoscopic submucosal dissection:ESD)にてWGA部分も含めた病理学的検査を実施した32例について,腺管の嚢胞状拡張の有無,腺腔内壊死物質の有無,壁細胞の過形成と内腔への鋸歯状の突出(parietal cell protrusion:PCP)の有無を評価した.なお,今回の対象症例には既報の症例が含まれる
5)~8).
検討2
WGAの頻度を算出するため,2015年12月~2019年11月に当院で実施された上部消化管内視鏡検査の総件数および胃癌に対して行った胃ESDの件数,ESD後の病理診断結果を調査した.さらに胃ESD症例の術前の内視鏡画像を見返し,WGAの有無を調べた.
本研究の計画書は岡山大学生命倫理審査委員会の承認を得た(承認番号 研1910-020,2107-010).
Ⅲ 結 果
検討1
41例の臨床的特徴をTable 1に示す.背景病変は胃癌18例,非癌23例
5)~8)であった.胃癌の組織型は高分化管状腺癌14例,中分化管状腺癌3例,低分化腺癌非充実型1例であり,低分化腺癌非充実型の症例は分化型腺癌成分を伴っていた.WGA指摘時の平均年齢は胃癌群72.9±5.6歳,非癌群71.0±9.5歳であった.男性の割合は胃癌群83.3%(15例),非癌群60.9%(14例)であった.
全体で24例がPPIを内服しており,PPI内服率は胃癌群38.9%(7/18例),非癌群73.9%(17/ 23例)であり,非癌群で有意に高かった.糖尿病薬使用例は14例で,内訳はシタグリプチン(5例),リナグリプチン(4例),ビルダグリプチン・メトホルミン配合剤(2例),レパグリニド(1例),グリメピリド(1例),アログリプチン(1例),カナグリフロジン(1例),エンパグリフロジン(1例),インスリン注射(2例)であった(重複あり).糖尿病薬使用率は胃癌群22.2%(4例),非癌群43.5%(10例)であった.腎障害は15例で認め,11例はeGFR中程度低下,4例は血液透析中であった.腎障害の割合は胃癌群38.9%(7例),非癌群34.8%(8例)であった.H. pylori感染状態は,胃癌群の72.2%(13例)が既往感染,27.8%(5例)が現感染であった.非癌群は既往感染が52.2%(12例),未感染と現感染が21.7%(5例)ずつであり,1例は判定不能であった.なお,NBI観察とBLI観察の間ではWGAの像に明らかな違いを認めなかった.
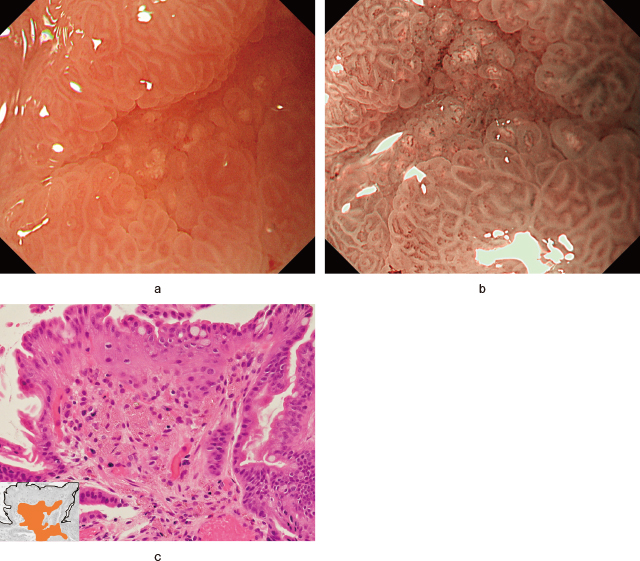
WGA部分の病理学的検査を実施した32例の特徴をTable 2に示す.胃癌群(18例)のうち腺管の嚢胞状拡張は12例(66.7%),腺腔内壊死物質は12例(66.7%),PCPは1例(5.6%)でみられた(Figure 1).一方,非癌群(14例)では,腺管の嚢胞状拡張は8例(57.1%),PCPは7例(50.0%)でみられたが,腺腔内壊死物質は指摘できなかった(Figure 2).
非癌群において病理学的に自己免疫性胃炎を2例,ESD後瘢痕を2例,腺腫を1例,ランタン沈着を1例,粘膜関連リンパ組織型節外性辺縁帯リンパ腫(MALTリンパ腫)を1例に認めた.同期間に内視鏡検査を実施した自己免疫性胃炎症例は14例,ランタン沈着症例は36例,MALTリンパ腫は86例であり,それぞれのWGAの頻度は14.3%(2/14),2.8%(1/36),1.2%(1/86)であった.
ランタン沈着,胃MALTリンパ腫症例の生検組織中には腺管の嚢胞状拡張,腺腔内壊死物質およびPCPのいずれも認めなかった.ランタン沈着の症例では,腸上皮化生による陥凹内に微小な白色沈着物を複数認め,一部は球状を呈していた(Figure 3).胃MALTリンパ腫症例では体部粘膜に点状の白色部分がみられ,BLI併用拡大観察で白色の球状の微小な沈着物として認められたが,典型的なWGAに比べて淡く,視認しづらい印象であった.同部位の生検では,腺管の拡張はなく,リンパ腫細胞の集簇を認めるのみであった.
検討2
対象期間内の胃癌に対してESDはのべ521件で実施され,WGAの陽性率は8.9%(49/521)であった.これらWGA陽性者のうち,65.3%(32/ 49)の症例ではWGAの見落としを認め,内視鏡画像の見返しにより,新たにWGAが存在することが明らかとなった.胃癌の病理組織学的な分化度別の検討では,WGA陽性率は分化型胃癌10.0%(48/481),未分化型胃癌3.2%(1/31)であり,両群間に有意差を認めなかった(Fisherの正確確率検定,p=0.18).
Ⅳ 考 察
本検討では,WGAと診断した胃癌18例,非癌23例を後ろ向きに解析した.まず胃癌症例に着目すると,高分化管状腺癌14例,中分化管状腺癌3例,分化型腺癌成分を伴う低分化腺癌非充実型1例であり,“WGAは分化型成分を有する癌に認められるのに対し,純未分化型癌には存在しない”という既知の特徴
1)~4)に合致していた.
胃癌群と非癌群の比較では,病理学的にいずれも約2/3に腺管の嚢胞状拡張を認めた.ただし前者では拡張腺管が癌細胞からなるのに対して,後者では非癌細胞で構成されている.また胃癌群の約2/3で拡張腺腔内に壊死物質を認めたが,非癌群ではこの所見はなかった.一方,PCPは胃癌群の5.6%のみに認めたのに対し,非癌群では50.0%でみられた.
前述した通り,WGAは内視鏡所見における用語であるが
1),4),組織学的には内部に好酸性壊死物質が貯留する著明に拡張した腺管,いわゆるintraglandular necrotic debrisに対応し,その頻度は70%(14/20例)と報告されている
1).自験例では腺管の嚢胞状拡張と腺腔内壊死物質をそれぞれWGAの66.7%に認めており,既報と同様の頻度であった.なおWGAとintraglandular necrotic debrisの有無が一致しない原因については,内視鏡観察と切除までの期間の影響や,微小な所見であるため顕微鏡標本作成時に切断面にintraglandular necrotic debrisが含まれない可能性などが挙げられている
1).
胃癌におけるintraglandular necrotic debrisの形成機序として,腺腔を形成する分化型胃癌細胞がアポトーシスにより腺管の嚢胞状拡張をきたし,癌細胞のネクローシスによって腺腔内壊死物質が貯留すると考えられている
1).これに対して,自験例のうち非癌群では,腺管の嚢胞状拡張を57.1%で認める一方,腺腔内壊死物質はなかった.したがって胃癌粘膜でみられるWGAと非癌粘膜のそれは病理学的に異なるものであり,後者については“広義のWGA”または“WGA様所見”と呼ぶべき病態と考えられる.またわれわれはPPI内服が非癌粘膜におけるWGA出現に関与しているのではないかと推測している.
今回の検討において,非癌群の57.1%に腺管の嚢胞状拡張を,また50.0%にPCPを認めた.PCPや胃底腺の拡張は,PPI内服に伴う病理学的変化として知られている
9),10).PPIの長期内服により壁細胞の過形成および内腔への突出,すなわちPCPを生ずると,腺峡部での流路閉塞をきたし,粘液が貯留することで胃底腺の拡張に至るのではないかと推測されている
11)~13).このような胃底腺の拡張は,PPIの内服を開始して8~60カ月後にみられるという
14),15).したがって,PPI内服によりPCPや胃底腺の拡張をきたし,胃底腺の拡張が高度となれば,内視鏡でWGA様所見として捉えられるのではないかと考えられるが,PPI内服の有無とWGAの関連を解析するためには,WGAのない患者も含めた多数例での検討や,PPI内服中止後にWGAが消失するかどうかに関する検討を行う必要がある.
PCPや胃底腺の拡張などの粘膜構造の変化は,H. pylori陰性胃粘膜ではPPI使用に伴って生じるが,H. pylori現感染患者ではPPIの服用とは無関係にこれらの構造変化がみられるとの報告もある
16).本研究では,H. pylori未感染患者は非癌群のうち5例(21.7%)にとどまり,大部分は既往感染もしくは現感染患者であった.これは内視鏡検査を受ける母集団の比率の影響を受けていると思われ,H. pylori感染状態とWGAの関連については今後の検討課題である.その他の背景因子の検討では,腎障害の割合は胃癌群(38.9%)と非癌群(34.8%)でほぼ同等であった.糖尿病薬の使用率は胃癌群(22.2%)に比べて非癌群(43.5%)の方が2倍程度高かったが,統計学的有意差はなかった.
WGAは自己免疫性胃炎の2例にもみられたが,これはわれわれの既報論文と同一症例である
6).自己免疫性胃炎にWGAを伴った症例は,他の研究者からも報告がある
17).また本邦11施設から245例の自己免疫性胃炎を集めた最近の研究では,同様の所見が32.0%(71/222例)にみられたと報告されており,Teraoらはこれを“散在性微小白色隆起”(scattered minute whitish protrusions)と呼称している
18).自己免疫性胃炎では壁細胞の破壊により粘液の流出経路の閉塞をきたした結果,粘液貯留と腺管拡張を生じ,これがWGAとして認識できるのではないかと推測しているが,真の発生機序は明らかとなっていない.さらに今回の検討では,胃ランタン沈着症および胃MALTリンパ腫症例にもWGAを認めた.生検組織中には腺管の嚢胞状拡張はみられなかったことから,リン酸ランタン沈着およびリンパ腫細胞の集簇がそれぞれWGAとして捉えられたと考えられる.
胃ESD症例の術前の内視鏡画像を再評価したところ,胃ESD症例に占めるWGAの陽性率は8.9%(50/561)であった.既報の前向き研究では胃癌症例の21.4%(70例中15例),非癌症例の2.5%(118例中3例)でWGAを認めたと報告されている
2).本研究でのWGAの陽性率が既報よりも低い原因としては,後ろ向きの検討であることから,施行医が本所見を充分に認知しておらず,WGAを識別できないために写真として記録されていない可能性が考えられる.
本検討の限界は,後ろ向き研究であり,上記の通り選択バイアスが存在することである.また胃癌病変の周囲,すなわち背景粘膜にWGAがあるかどうかは評価できていない.WGAを正確に診断し,陽性症例の臨床的特徴を明らかにするためには,内視鏡施行医に対してWGAに関するレクチャーを行ったうえで,前向きに症例を集積する必要がある.第二に,本研究では非癌群でPPI内服率が高かったが,WGA陽性の症例のみの検討であり,かつPPIの投与量や服用期間に関する情報の収集ができていない.リスク比を統計学的に算出するためには,副薬歴の聴取とともに,WGAのない症例も含めた解析を行う必要がある.
Ⅴ 結 論
WGAは分化型胃癌に随伴して認める症例が多かったが,非癌粘膜にも検出された.非癌群は胃癌群に比してPPI内服率が有意に高かった.非癌群では組織学的に腺管の嚢胞状拡張を認めるものの,腺腔内壊死物質はなく,PCPを認める点が胃癌に随伴するWGAと異なっており,両者の成因は異なる可能性が示唆された.WGAは胃癌病変の拾い上げや質的診断を行ううえで有用な所見の一つであるが
8),より正確な内視鏡診断を行うためには,非癌粘膜にもWGA様所見が出現し得るとの認識が重要と考えられる.
謝 辞
“散在性微小白色隆起”(scattered minute whitish protrusions)に関してご教示いただいた寺尾秀一先生(加古川中央市民病院)に深謝申し上げます.
本論文内容に関連する著者の利益相反:河原祥朗(岡山西大寺病院),岡田裕之(アストラゼネカ株式会社,第一三共株式会社,武田薬品工業株式会社,大塚製薬株式会社,日本化薬株式会社,EAファーマ株式会社)
文 献
- 1. Doyama H, Yoshida N, Tsuyama S et al. The “white globe appearance”(WGA):a novel marker for a correct diagnosis of early gastric cancer by magnifying endoscopy with narrow-band imaging(M-NBI). Endosc Int Open 2015; 3:E120-4.
- 2. Yoshida N, Doyama H, Nakanishi H et al. White globe appearance is a novel specific endoscopic marker for gastric cancer:A prospective study. Dig Endosc 2016; 28:59-66.
- 3. Omura H, Yoshida N, Hayashi T et al. Interobserver agreement in detection of “white globe appearance” and the ability of educational lectures to improve the diagnosis of gastric lesions. Gastric Cancer 2017; 20:620-8.
- 4. 土山 寿志.胃癌診断体系以外の有用な所見―white globe appearance(WGA).胃と腸 2019;54:210-3.
- 5. Iwamuro M, Tanaka T, Sakae H et al. Two cases of white globe appearance in non-cancerous stomach. Ecancermedicalscience 2018; 12:856.
- 6. Iwamuro M, Tanaka T, Kanzaki H et al. Two Cases of White Globe Appearance in Autoimmune Atrophic Gastritis. Case Rep Gastrointest Med 2018; 2018:7091520.
- 7. Iwamuro M, Urata H, Tanaka T et al. Gastric lanthanum phosphate deposition masquerading as white globe appearance. Dig Liver Dis 2019; 51:168.
- 8. Iwamuro M, Sakae H, Tanaka T et al. White globe appearance in gastric high-grade dysplasia. Gastrointest Endosc 2019; 89:1254-5.
- 9. 宮本 秀一, 加藤 元嗣, 津田 桃子ほか.プロトンポンプ阻害薬による胃粘膜変化の検討~ひび割れ粘膜と敷石様粘膜~.Gastroenterol Endosc 2018;60:68-77.
- 10. Miyamoto S, Kato M, Tsuda M et al. Gastric mucosal cracked and cobblestone-like changes resulting from proton pump inhibitor use. Dig Endosc 2017; 29:307-13.
- 11. Lundell L, Vieth M, Gibson F et al. Systematic review:the effects of long-term proton pump inhibitor use on serum gastrin levels and gastric histology. Aliment Pharmacol Ther 2015; 42:649-63.
- 12. Shiotani A, Katsumata R, Gouda K et al. Hypergastrinemia in Long-Term Use of Proton Pump Inhibitors. Digestion 2018; 97:154-62.
- 13. Synnerstad I, Holm L. Omeprazole induces high intraglandular pressure in the rat gastric mucosa. Gastroenterology 1997; 112:1221-30.
- 14. Stolte M, Bethke B, Rühl G et al. Omeprazole-induced pseudohypertrophy of gastric parietal cells. Z Gastroenterol 1992; 30:134-8.
- 15. Stolte M, Bethke B, Seifert E et al. Observation of gastric glandular cysts in the corpus mucosa of the stomach under omeprazole treatment. Z Gastroenterol 1995; 33:146-9.
- 16. Kumar KR, Iqbal R, Coss E et al. Helicobacter gastritis induces changes in the oxyntic mucosa indistinguishable from the effects of proton pump inhibitors. Hum Pathol 2013; 44:2706-10.
- 17. 綾木 麻紀, 小原 英幹, 松永 多恵ほか.多発性white globe appearanceを認めたA型胃炎の1例.Gastroenterol Endosc 2019;61:1226-30.
- 18. Terao S, Suzuki S, Yaita H et al. Multicenter study of autoimmune gastritis in Japan:Clinical and endoscopic characteristics. Dig Endosc 2020; 32:364-72.