要旨
光線力学療法(PDT:photodynamic therapy)は,腫瘍親和性光感受性物質(PS:photosensitizer)とPSの吸収波長に特化した励起レーザーを用いたがんに対する治療方法である.第1世代PSを用いたPDTは,1990年代に早期胃がん,表在性食道がんに対する治療として薬事承認されたが,4-6週間の遮光期間が必要なこと,ESDの開発によって活躍の場を失った.欧米では,バレット食道に対するアブレーション治療,進行食道がんや胆道がんの症状緩和目的治療として良好な治療成績の報告があるが,現在では薬剤を用いないラジオ波アブレーションなどの治療が主流である.近年開発された,遮光期間が短く日光過敏症が少なくなった第2世代PSを用いたPDTは,放射線治療後遺残再発食道がんに対する開発が進み,医師主導治験の良好な治療成績によって,2015年に薬事承認が得られた.第2世代PDTは少しずつ普及が進んでいるが,消化器がんでは再発食道がんにしか承認されておらず,対象となる症例は少ない.今後,PDTが消化器がんの治療において,その適応を拡大しさらに普及するためには解決すべき課題も多い.
Ⅰ はじめに
光線力学療法(PDT:photodynamic therapy)は,腫瘍親和性光感受性物質(PS:photosensitizer)とPSの吸収波長に特化した励起レーザーを用いたがんに対する治療方法の一つである.PDTの主な抗腫瘍メカニズムは,がん細胞内でのPSと励起光の光化学反応によって発生した活性酸素による直接障害,血管塞栓作用,急性炎症による免疫反応などが考えられている
1),2).
がん治療としてのPDTの臨床応用については歴史が古く,1970年代に転移性乳がんに対してヘマトポルフィリン誘導体を用い体表に光を照射する光線力学療法が米国から報告されている
3).わが国では,1980年代に肺がん,食道がん,胃がんに対する内視鏡治療として開発され
4),5),1990年代初頭にポルフィマーナトリウムとエキシマダイレーザーを用いた第1世代PDTの治験が行われ,早期肺がん,表在性食道がん,早期胃がん,子宮頸部初期がんおよび異形成に対する治療として1994年に薬事承認が得られた
6).消化管がんについては,内視鏡的粘膜切除術(EMR)で治療が困難な潰瘍併存例や手術不能な粘膜下層浸潤例で3cm以下程度の比較的小さい病変が適応と考えられていた
7),8).その後,わが国では消化管がんに対する内視鏡的粘膜下層剝離術(ESD)の開発と爆発的な普及,低侵襲手術や食道がんにおける化学放射線療法(CRT:chemo radiotherapy)の開発などがあり,PDT適応になる病変は少なくなった.PDT特有の有害事象である日光過敏症対策のために,4-6週間の遮光期間が必要である不便さも相俟って,PDTは活躍の場を失った.その後,PDTが有効であることが報告されたCRT後遺残再発食道がんに対して
9),肺がんに対して承認された遮光期間の短い第2世代PSであるタラポルフィンナトリウムと半導体レーザーを用いた治療開発が行われ,2015年に再発食道がんに対する薬事承認が得られた.CRT後遺残再発食道がんに対するPDTは,新しい内視鏡治療として少しずつ普及が進んでいる.本稿では,食道がんを中心とした消化管がんに対するPDTの現状について,国内外からの論文報告をまとめて解説し,PDTの課題を明らかにし,将来を展望する.
Ⅱ 放射線治療後遺残再発食道がんに対するPDT
食道がんに対するCRTは,特に扁平上皮がんではその放射線感受性の高さから手術不耐例や手術不能局所進行例に対する根治を目指すことが出来る内科的な治療と位置づけられている.高齢者や肝腎機能の悪い症例に対しては,根治率は低くなるが放射線治療単独(RT:radiotherapy)が選択されることも多い.CRTやRTは食道扁平上皮がんに対する有効性が高く,多くの症例で縮小が得られるが,完全奏効(CR:complete response)に至らない遺残例やCR後の再発例が多く,臨床的な課題と考えられている.局所遺残再発病変の進行は早く,数カ月で増悪し食事の通過障害を来し,誤嚥性肺炎,気道や大動脈との瘻孔形成などの重篤な合併症に及ぶことがある
10),11).局所遺残再発病変に対する根治的な治療方法と考えられているサルベージ外科手術は,合併症も多く手術不耐例,拒否例が少なくない
12),13).遺残再発病変が表層性の病変の場合は,EMRやESDを用いた内視鏡的なサルベージ治療が可能で,その高い有効性や安全性が報告されているが,適応となる病変は粘膜内から粘膜下層浅層までの病変に限られる
14).また,放射線治療後の線維化や潰瘍が原因でESDでも切除が難しい病変も存在する
15).PDTは,治療手技としては内視鏡を用いた病変部に対するレーザー照射なので,EMRやESDと違って潰瘍や線維化によって影響を受けることが少なく,より深部までの治療効果が期待できる.CRT後遺残再発食道がんに対する第1世代ポルフィマーナトリウムとエキシマダイレーザーを用いた第1世代PDTの有効性と安全性を評価した前向き臨床試験では,手術不能でEMRやESDでの切除が困難と判断されたT1b遺残再発例を対象として行いCR割合は,76%(25例中19例)であった
16).一方で,安全性については,ポルフィマーナトリウム投与後約1カ月半の遮光期間を設けたが,光過敏症は32%(8/25)であった.その他,多くの合併症については軽度で内科的な治療で制御可能であったが,1例PDT後33日目にレーザー照射部位の食道大動脈瘻が原因と思われる大出血を来し治療関連死亡した.CRT後遺残再発病変に対する第1世代PDTは,長期での良好な局所制御や生存成績が報告されたが
17),日光過敏症とそれに伴う長い遮光期間,レーザー機器自体が製造販売停止されたこともあって普及には至らなかった.
Ⅲ 第2世代PDTの開発とCRT後遺残再発食道がんへの薬事承認
第2世代PSであるタラポルフィンナトリウム(レザフィリン,MeijiSeikaファルマ)は,植物の葉緑素から抽出されたクロリン環を有する薬剤で,第1世代PSであるポルフィリン化合物と比較すると薬剤の半減期が短く,光の吸収ピーク波長が長いことが特徴である.タラポルフィンナトリウムは,投与後に必要な遮光期間は2週間で第1世代PDTと比べると大幅に短縮された.また,第1世代PDTで用いたエキシマダイレーザーが630nmだったのに対してタラポルフィンナトリウムでは664nmの半導体レーザーが用いられるようになった.基礎的な研究では,ポルフィリン化合物を用いたPDTよりもクロリン環を有するPSを用いたPDTの方がより深部にまで治療効果が及ぶことが示されている
18).タラポルフィンナトリウムは国産の薬剤であり,世界に先駆けてわが国で臨床応用が進み,肺がんに対する内視鏡を用いた治療として薬事承認を目指した治験が行われた.治験は,2cm以下の中心型早期肺がん41例46病変が登録され84.6%の病変で完全奏効が得られ,日光過敏症は2週間の遮光期間で84.8%の症例で消失したと報告されている
19).治験での高い有効性と安全性が評価され,2004年に早期肺がんに対する薬事承認が得られた.食道がんに対する適応拡大については,大型動物での組織障害の評価を経て
20)臨床導入がされ,放射線治療後遺残再発食道がんに対する安全性と至適レーザー照射量を明らかにするために第Ⅰ相試験が行われた
21).第Ⅰ相試験には,9例が登録され,日光過敏症や重篤な有害事象は1例も認めず,至適レーザー照射量は肺がんと同じ100J/cm2になった.その後,薬事申請を目的に国内7施設で医師主導治験が行われ,その主な適格基準は,1)深達度T2までに留まる局所遺残再発病変,2)長軸径3cm以下,3)周在性半周以下,4)頸部食道に及ばない,5)リンパ節・遠隔転移を有さない,であった
22).また,第1世代PDTでの食道大動脈瘻による治療関連死亡例の経験よりCRTまたはRT前に大動脈浸潤が疑われたT4(AortaT4)が除外基準に入れられた.医師主導治験には,26例28病変(T1b:21病変,T2:7病変)が登録され,23例がCRになり(CR割合88.5%),T1病変のCR割合は100%,T2病変では57.1%であった.2週間の遮光期間で,日光過敏症は1例も認めず,食道他臓器瘻などの重篤な合併症も認めなかった.医師主導治験の良好な有効性と安全性の結果によって,タラポルフィンナトリウムとPDレーザーを用いた第2世代PDTは,2015年に放射線治療後遺残再発食道がんに対して薬事承認され,保険適用となり,国内では少しずつ普及が進んでいる(Figure 1).現在,食道癌診療ガイドラインにおいても,PDTは化学放射線療法後の局所遺残,再発例に対する救済治療の一つとして記載されている
23).
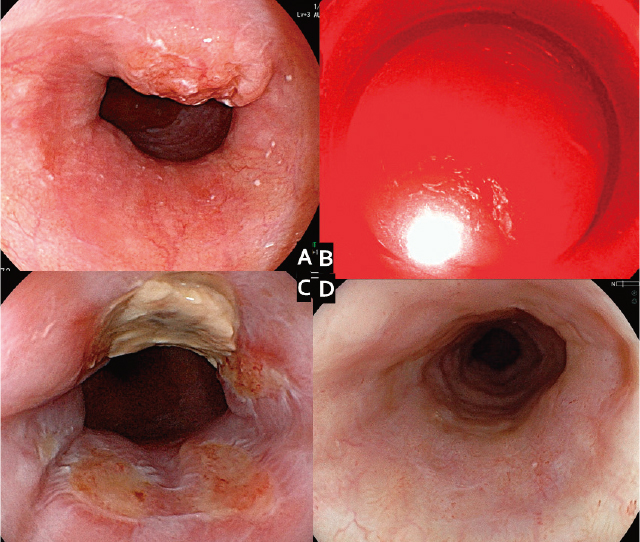
Ⅳ 進行食道がんに対する症状緩和治療としてのPDT
切除不能局所進行食道がんの症状は食事の通過障害であり,化学放射線療法などの根治的な治療適応がない症例では,症状緩和目的の治療が選択される.食道がんに対するPDTはわが国では表在がんに対する根治的な治療として開発され承認されたが,米国では通過障害を伴う進行食道がんに対する症状緩和目的の治療として開発され1995年に薬事承認された.Litleらは,215例の通過障害を伴う進行再発食道がんに対して症状緩和目的にポルフィマーナトリウムを用いたPDTを施行し,その治療成績を報告した.研究対象例の主な組織型は腺がん(85%)の下部食道がん(75%)で,PDT後85%の症例でdysphagia scoreが改善し,通過障害のない期間の中央値は約2カ月と報告されている
24).Lindenmannらは,進行食道がんに対してPDT,ステント留置,腔内照射など複数の症状緩和目的治療を実施した248例(腺がん:48.4%,扁平上皮がん:51.6%)の治療成績を解析し,症状緩和治療の初回治療としてPDTを選択した症例の生命予後が有意に良かったと報告した
25).PDTの症状緩和目的治療としての有効性が報告されている一方で,第1世代PDTはPS投与後に日光過敏症を防ぐために遮光期間が必要であることの不便さから欧米でも普及はしていない.欧州内視鏡学会のガイドラインでも,通過障害のある進行食道がんに対する症状緩和目的の治療としては,PDTは記載されているが,カバードステントの留置が第一選択として推奨されている
26).一方,近年PDT以外のアブレーション治療として冷凍アブレーション治療(spray cryotherapy)の症状緩和目的治療としての有望な短期成績が報告されている
27).症状緩和目的治療としてのステント留置には痛み,出血,穿孔などの合併症,放射線治療との相性の悪さ,頸部食道には留置が難しいなどの課題があるため,簡便で有効性が高いアブレーション治療が開発されれば,治療選択肢の一つになる可能性がある.
Ⅴ バレット食道がんに対するPDT
米国では,PDTは食道腺がんを予防するための治療として,異形成を伴うバレット食道に対する治療としても2003年に追加承認されている.高度異形成を伴うバレット食道に対するポルフィマーナトリウムを用いたPDTの有効性は,208例を対象に行ったプロトンポンプインヒビター投与(PPI:proton pump inhibitor)とのランダム化比較試験(RCT)で評価され,PDTはPPI投与単独と比べて有意に高度異形成の除去割合が高いことが示された
28).欧州では,経口投与が可能でより遮光期間が短いアミノレブリン酸(5ALA)を用いたPDTが評価された.小規模なRCTであるが,5ALAを用いたPDTは,異形成を伴うバレット食道に対してPPI単独と比較して有効な治療成績が報告されている
29).また,5ALAPDTは,粘膜内がんを伴うバレット食道に対する治療としても,良好な長期成績が報告されている
30).しかしながら,異形成を伴うバレット食道に対するがん予防のためのアブレーション治療については,現在,その後に登場したラジオ波アブレーション治療(RFA:radiofrequency ablation)がRCTを含む質の高いエビデンスを背景にしてPDTに置き換わり標準的治療に位置づけられている
31).PDTは,前述のPS投与後の遮光期間が必要である点以外にも,食道狭窄の頻度が高いことが弱点として挙げられる.PDTでは,特に広範な照射や治療を繰り返している症例では線維化を伴う深刻な食道狭窄を来すことが報告されている
32).現在,バレット食道に対するPDTは,RFAや冷凍アブレーション治療抵抗症例に対するサルベージ治療として米国内でも限られた施設でしか行われていない.
Ⅵ 胃がんに対するPDT
前述のように,第1世代PDTは1994年に早期胃がんに対する治療として承認され,EMRが困難な潰瘍合併症例や手術不能な粘膜下層浸潤例に対する内視鏡治療として期待された.Mimuraらは,早期胃がんに対するポルフィマーナトリウムを用いたPDTの有効性を明らかにするための多施設前向き研究を行い,87.5%(21/24)の症例でCRが得られ,特に2cm以下で潰瘍を伴わない症例ではその後の再発も認めなかったと報告している
33).Oinumaらは,わが国における胃がんに対する第1世代PDTの施行例調査を報告し,PDTはEMR適応外の潰瘍合併例において,73.7%のCR割合が得られたと報告している
34).
しかしながら,早期胃がんに対するESDの開発によって潰瘍合併例も安全に一括切除が可能になり,一括切除検体の詳細な病理評価に基づいて追加外科切除の有無を判断する治療ストラテジーが確立し,胃がんに対する内視鏡切除は爆発的に普及した.さらには質の高い多施設前向き研究の良好な治療成績によって内視鏡切除の適応拡大は順調に進み
35),36),PDTを必要とする症例はさらに限られるようになった.Kakushimaらは,手術不耐例の粘膜下層深部浸潤胃がんに対するESDを中心とした内視鏡治療の治療成績について,12例のESD+第1世代PDTの成績を含めて報告している.ESD非治癒例に対する追加PDTはその後の再発も多く,5年疾患特異的生存割合も64%と低いため推奨できないと述べられている
37).放射線治療後遺残再発食道がん症例に薬事承認されたタラポルフィンナトリウムを用いたPDTについては,症例報告での有効例が示されているが
38),現時点では胃がんにおいてPDTを必要とする対象の選択が難しく適応拡大は予定されていない.
Ⅶ 胆道がん,膵がんに対するPDT
胆道がんは,根治外科手術後の再発例や治癒切除不能例が多い予後不良のがん種であり,欧米からは古くからPDTの臨床使用での有効例の報告が多くやRCTでの予後延長効果も証明されており,PDTの適応拡大のニーズが高い
39).現時点では,胆道がんに対して薬事承認,保険適用になっているPDTは存在しないが,欧米から有効性の報告が多いこともあって,国内の診療ガイドラインにも切除不能胆道がんに対する治療として記載されている
40).欧米では,1990年代から胆道狭窄を伴う進行胆道がんに対して胆道開存期間の延長を期待して胆管ステントにPDTを追加する治療方針の検討がなされ,小規模なRCTではあるがステント単独と比較してステント+PDTの生存期間の延長が証明されている(片群20例,生存期間中央値;ステント+PDT:493日 vs ステント:98日)
41).オーストリアのグループが行った国内後ろ向き調査では,悪性胆道狭窄に対するPDTは重篤な有害事象がない有効な治療であり,多変量解析ではPDTの治療回数が生存期間の長さに寄与する唯一の独立した因子であったと報告している
42).一方で,遮光期間が必要になるPSを投与する必要がないRFAの悪性胆道狭窄に対するアブレーション治療としての有効性が報告され始めている
43),44).わが国の研究者を含むこの領域のエキスパートによるコンセンサスでも,悪性胆道狭窄に対してステント留置にPDTやRFAを加えることで,ステントの開存期間,クオリティ・オブ・ライフ(QOL),生存期間延長が期待できるが,標準的治療になるためにはRCTによる検証が必要であると結論されている
45).
胆道がんと同様に難治がんである膵がんについては,超音波内視鏡(EUS)を用いたPDTの臨床応用について,近年,米国からいくつかの探索的な臨床試験が報告されている.DeWittらは,ポルフィマーナトリウムを用いた第1世代PDTのEUSガイド下PDTの第Ⅰ相試験を実施し,最適な薬剤投与量とレーザー照射量の探索し,安全性を評価した
46).この試験の結果,膵がんに対するEUSガイド下PDTの安全性は忍容可能で抗腫瘍効果があり,抗がん剤治療とも安全に併用できたと報告されている.米国の別のグループからは,わが国で加齢黄斑変性症に対するPDTで薬事承認をされている新しいPSであるベルテポルフィンを用いた膵がんに対するEUSガイド下PDTについても臨床試験の結果が報告されている
47),48).いずれの臨床試験においても,日光過敏症は少なく,安全性は忍容可能で高い抗腫瘍効果が報告されている.ベルテポルフィンは,第2世代の合成ポルフィリンで第1世代と比べて正常組織から速やかに排出されるため遮光期間が短いことや血管親和性が高いため新生血管閉塞作用が期待できること,励起に用いるレーザーの波長域は690nmと従来のPDTに用いるレーザーより長いためより深部への効果が期待できること等が特徴である
49).また,ベルテポルフィンは基礎的な研究で抗がん剤の透過性を亢進するだけでなく,膵がんにおける薬剤耐性の一因と考えられている細胞分化,アポトーシス,血管新生に関連しているYes-associated protein-1(YAP)経路を標的にする効果も証明されており
50),膵がんに対する臨床的な効果が期待されている.
Ⅷ PDTの課題と展望
PDTは,薬剤とレーザー光を用いてがんに対して選択的に治療できるユニークな治療方法である.消化管がんに対しては,古くから内視鏡を用いたアプローチで開発が進められてきた.最大の課題であった薬剤投与後の長い遮光期間は,新しいPSの開発によって緩和されたが,消化管がんで保険診療が出来るのは放射線治療後遺残再発食道がんだけであり,治療対象は少ない(Table 1).欧米では,消化管がんに対するアブレーション治療については,RFAや冷凍アブレーションの臨床導入が進んでおり,バレット食道ではすでに標準的治療にも位置づけられており,今後も表層性の病変については薬剤を用いないアブレーション治療が主体になると考えられる.他のアブレーション治療と比べて,PDTが持つ強みは,より深部にまで治療効果が期待できること,腫瘍選択性が高いことである.PDTが抗がん治療としての強みを活かして普及するために解決すべき課題はいくつか考えられる.第一に,PDTの強みを理解して消化管がんにおける治療対象を明確化することである.消化管がんに対する治療は,手術,抗がん剤治療,放射線治療の3大がん治療に,効果と安全性が高いESDを中心とした内視鏡切除を加えて,ステージ毎の治療選択や集学的治療方法が確立している.近年,外科手術においても鏡視下手術など低侵襲手技の確立によって,PDTがその価値を発揮できる臨床的な場面や患者は限られる.CRT後またはRT後遺残再発食道がんは,放射線治療によって照射野内リンパ節再発が限られること,サルベージ外科手術の侵襲が大きいこと,局所のみ制御すれば長期生存が得られる可能性があること,などによってPDTがその価値を発揮できる治療対象と考えられた.今後,PDTが普及するためには,いずれのがん種においてもその強みを活かすことが出来る治療対象を明らかにすることが重要である.さらに,臨床的な位置づけを明確にするためには,バレット食道に対するRFAのように質の高いRCTで評価され,ガイドラインに標準的治療方法として掲載される必要がある.2つめに必要なのは,より腫瘍選択性が高く遮光が必要ない薬剤を開発することである.基礎研究では,腫瘍選択性を高めるためにPSと抗体薬の複合体やナノ粒子などドラッグデリバリーシステムを応用した新しい薬剤の開発が積極的に試みられている
51)~53).なかでもEGFR抗体と光感受性物質の複合体を用いた光免疫療法は,再発頭頸部がんに対する臨床応用が進み,国内で治験が実施され2020年に薬事承認,保険適用が得られた
54).現在,消化管がんに対する適応拡大が試みられている.PDTにおける最大の弱点である光過敏症が解決し,より腫瘍選択性が高い治療が実現できれば理想的な治療になり得る.最後に,PDTの免疫学的効果や免疫チェックポイント阻害剤(ICI:immune checkpoint inhibitor)等との相乗効果を探索し,その全身的な効果を明らかにし,局所治療の枠を超えることを目指すことである.PDTによる局所の急性炎症は,免疫刺激を引き起こしT細胞への腫瘍由来抗原の提示を増加させ全身的な免疫学的効果をもたらすことは以前から基礎研究では報告されている
55),56).さらに,PDTとICIの相乗効果を評価した研究では,併用することで原発巣と転移巣いずれにおいても腫瘍に浸潤するT細胞が増え腫瘍の増殖が抑制されたと報告されている
57).PDTが,PD-1/PDL-1耐性の抑制することでICIの効果を高め効果持続性をもたらすと考えられており,併用療法の効果が期待されている
58).消化管がんに対するICIは,多くのRCTで既存抗がん剤治療を上回る効果や上乗せ効果が証明されており
59)~61),今後初回治療例でも標準的治療に組み込まれることが予想されている.PDTの免疫学的効果やICIとの相乗効果を臨床的にも明らかにすることが出来れば,市場規模が大きくなり,力のある製薬企業の参入,開発や普及の促進が期待できる.

本論文内容に関連する著者の利益相反:矢野友規(オリンパス株式会社,Meiji Seikaファルマ株式会社,富士フイルム株式会社,HOYA PENTAX,株式会社島津製作所,楽天メディカル社,株式会社東京技研),橋本裕輔(ゼオンメディカル株式会社,米国IBM,タカラバイオ株式会社)
文 献
- 1. Dolmans DE, Fukumura D, Jain RK. Photodynamic therapy for cancer. Nat Rev Cancer 2003; 3:380-7.
- 2. Kessel D, Oleinick NL. Cell Death Pathways Associated with Photodynamic Therapy:An Update. Photochem Photobiol 2018; 94:213-8.
- 3. Dougherty TJ, Lawrence G, Kaufman JH et al. Photoradiation in the treatment of recurrent breast cancer. J Natl Cancer Inst 1979; 62:231-7.
- 4. Hayata Y, Kato H, Konaka C et al. Hematoporphyrin derivative and laser photoradiation in the treatment of lung cancer. Chest 1982; 81:269-77.
- 5. Hayata Y, Kato H, Okitsu H et al. Photodynamic therapy with hematoporphyrin derivative in cancer of the upper gastrointestinal tract. Semin Surg Oncol 1985; 1:1-11.
- 6. 吉田 一成, 鈴木 茂, 嶋尾 仁ほか.PHE(Porfimer Sodium)およびエキシマダイレーザー(PDT EDL-1)による食道表在癌に対するPhotodynamic therapy(PDT)の臨床第Ⅲ相試験.癌と化学療法 1993;20:2063-6.
- 7. 嶋尾 仁, 比企 能樹.食道癌の光線力学的治療.癌と化学療法 1996;23:36-40.
- 8. 三村 征四郎, 楢原 啓之, 上原 宏之ほか.胃癌の光線力学療法.癌と化学療法 1996;23:41-6.
- 9. Yano T, Muto M, Minashi K et al. Photodynamic therapy as salvage treatment for local failures after definitive chemoradiotherapy for esophageal cancer. Gastrointest Endosc 2006; 62:31-6.
- 10. Zenda S, Hironaka S, Taku K et al. Optimal timing of endoscopic evaluation of the primary site of esophageal cancer after chemoradiotherapy or radiotherapy:a retrospective analysis. Dig Endosc 2009; 21:245-51.
- 11. Ishikura S, Nihei K, Ohtsu A et al. Long-term toxicity after definitive chemoradiotherapy for squamous cell carcinoma of the thoracic esophagus. J Clin Oncol 2003; 21:2697-702.
- 12. Mitchell KG, Nelson DB, Corsini EM et al. Morbidity following salvage esophagectomy for squamous cell carcinoma:the MD Anderson experience. Dis Esophagus 2020; 33:doz067.
- 13. Cohen C, Tessier W, Gronnier C et al. Salvage Surgery for Esophageal Cancer:How to Improve Outcomes? Ann Surg Oncol 2018; 25:1277-86.
- 14. Yano T, Muto M, Hattori S et al. Long-term results of salvage endoscopic mucosal resection in patients with local failure after definitive chemoradiotherapy for esophageal squamous cell carcinoma. Endoscopy 2008; 40:717-21.
- 15. Nakajo K, Yoda Y, Hori K et al. Technical feasibility of endoscopic submucosal dissection for local failure after chemoradiotherapy or radiotherapy for esophageal squamous cell carcinoma. Gastrointest Endosc 2018; 88:637-46.
- 16. Yano T, Muto M, Minashi K et al. Photodynamic therapy as salvage treatment for local failure after chemoradiotherapy in patients with esophageal squamous cell carcinoma:a phase Ⅱ study. Int J Cancer 2012; 131:1228-34.
- 17. Hatogai K, Yano T, Kojima T et al. Salvage photodynamic therapy for local failure after chemoradiotherapy for esophageal squamous cell carcinoma. Gastrointest Endosc 2016; 83:1130-9.
- 18. Wong Kee Song LM, Wang KK, Zinsmeister AR. Mono-L-aspartyl chlorin e6(NPe6) and hematoporphyrin derivative(HpD) in photodynamic therapy administered to a human cholangiocarcinoma mode. Cancer 1998; 82:421-7.
- 19. Kato H, Furukawa K, Sato M et al. Phase Ⅱ clinical study of photodynamic therapy using mono-L-aspartyl chlorin e6 and diode laser for early superficial squamous cell carcinoma of the lung. Lung Cancer 2003; 42:103-11.
- 20. Horimatsu T, Muto M, Yoda Y et al. Tissue damage in the canine normal esophagus by photoactivation with talaporfin sodium(laserphyrin):a preclinical study. PLoS One 2012; 7:e38308. doi:10.1371/journal.pone.0038308.
- 21. Yano T, Muto M, Yoshimura K et al. Phase Ⅰ study of photodynamic therapy using talaporfin sodium and diode laser for local failure after chemoradiotherapy for esophageal cancer. Radiat Oncol 2012; 7:113. doi:10.1186/1748-717X-7-113.
- 22. Yano T, Kasai H, Horimatsu T et al. A multicenter phase Ⅱ study of salvage photodynamic therapy using talaporfin sodium(ME2906) and a diode laser(PNL6405EPG) for local failure after chemoradiotherapy or radiotherapy for esophageal cancer. Oncotarget 2017; 8:22135-44.
- 23. 特定非営利活動法人日本食道学会.食道癌診療ガイドライン 2017年版.金原出版,東京,2017.
- 24. Litle VR, Luketich JD, Christie NA et al. Photodynamic therapy as palliation for esophageal cancer: experience in 215 patients. Ann Thorac Surg 2003; 76:1687-92.
- 25. Lindenmann J, Matzi V, Neuboeck N et al. Individualized, multimodal palliative treatment of inoperable esophageal cancer:clinical impact of photodynamic therapy resulting in prolonged survival. Lasers Surg Med 2012; 44:189-98.
- 26. Spaander MCW, van der Bogt RD, Baron TH et al. Esophageal stenting for benign and malignant disease:European Society of Gastrointestinal Endoscopy(ESGE) Guideline - Update 2021. Endoscopy 2021; 53:751-62.
- 27. Kachaamy T, Prakash R, Kundranda M et al. Liquid nitrogen spray cryotherapy for dysphagia palliation in patients with inoperable esophageal cancer. Gastrointest Endosc 2018; 88:447-55.
- 28. Overholt BF, Lightdale CJ, Wang KK et al. Photodynamic therapy with porfimer sodium for ablation of high-grade dysplasia in Barrettʼs esophagus:international, partially blinded, randomized phase Ⅲ trial. Gastrointest Endosc 2005; 62:488-98.
- 29. Ackroyd R, Brown NJ, Davis MF et al. Photodynamic therapy for dysplastic Barrettʼs oesophagus:a prospective, double blind, randomised, placebo controlled trial. Gut 2000; 47:612-7.
- 30. Pech O, Gossner L, May A et al. Long-term results of photodynamic therapy with 5-aminolevulinic acid for superficial Barrettʼs cancer and high-grade intraepithelial neoplasia. Gastrointest Endosc 2005; 62:24-30.
- 31. Shaheen NJ, Sharma P, Overholt BF et al. Radiofrequency ablation in Barrettʼs esophagus with dysplasia. N Engl J Med 2009; 360:2277-88.
- 32. Prasad GA, Wang KK, Buttar NS et al. Predictors of stricture formation after photodynamic therapy for high-grade dysplasia in Barrettʼs esophagus. Gastrointest Endosc 2007; 65:60-6.
- 33. Mimura S, Ito Y, Nagayo T et al. Cooperative clinical trial of photodynamic therapy with photofrin Ⅱ and excimer dye laser for early gastric cancer. Lasers Surg Med 1996; 19:168-72.
- 34. Oinuma T, Nakamura T, Nishiwaki Y. Report on the National Survey of Photodynamic Therapy(PDT) for Gastric Cancer in Japan(a secondary publication). Laser Ther 2016; 25:87-98.
- 35. Hasuike N, Ono H, Boku N et al. A non-randomized confirmatory trial of an expanded indication for endoscopic submucosal dissection for intestinal-type gastric cancer(cT1a):the Japan Clinical Oncology Group study(JCOG0607). Gastric Cancer 2018; 21:114-23.
- 36. Takizawa K, Ono H, Hasuike N et al. A nonrandomized, single-arm confirmatory trial of expanded endoscopic submucosal dissection indication for undifferentiated early gastric cancer:Japan Clinical Oncology Group study(JCOG1009/1010). Gastric Cancer 2021; 24:479-91.
- 37. Kakushima N, Hagiwara T, Tanaka M et al. Endoscopic submucosal dissection for early gastric cancer in cases preoperatively contraindicated for endoscopic treatment. United European Gastroenterol J 2013; 1:453-60.
- 38. Nakamura T, Oinuma T. Usefulness of photodynamic diagnosis and therapy using talaporfin sodium for an advanced-aged patient with inoperable gastric cancer(a secondary publication). Laser Ther 2014; 23:201-10.
- 39. 七島 篤志, 角田 順久, 永安 武ほか.胆管癌に対するphotodynamic therapyの本邦ならびに海外における現状~胆道外科医の立場から~.胆道 2016;30:699-708.
- 40. 公益財団法人日本医療機能評価機構.エビデンスに基づいた胆道癌診療ガイドライン 改訂第3版.Minds ガイドラインライブラリー. https://minds.jcqhc.or.jp/n/med/4/med0058/G0001134/0053(閲覧日:2021年12月22日)
- 41. Ortner ME, Caca K, Berr F et al. Successful photodynamic therapy for nonresectable cholangiocarcinoma:a randomized prospective study. Gastroenterology 2003; 125:1355-63.
- 42. Dolak W, Schwaighofer H, Hellmich B et al. Photodynamic therapy with polyhematoporphyrin for malignant biliary obstruction:A nationwide retrospective study of 150 consecutive applications. United European Gastroenterol J 2017; 5:104-10.
- 43. Sofi AA, Khan MA, Das A et al. Radiofrequency ablation combined with biliary stent placement versus stent placement alone for malignant biliary strictures:a systematic review and meta-analysis. Gastrointest Endosc 2018; 87:944-51.
- 44. Mohan BP, Chandan S, Khan SR et al. Photodynamic Therapy(PDT), Radiofrequency Ablation(RFA) With Biliary Stents in Palliative Treatment of Unresectable Extrahepatic Cholangiocarcinoma:A Systematic Review and Meta-analysis. J Clin Gastroenterol 2021 Mar 12. doi:10.1097/MCG. 0000000000001524. Online ahead of print.
- 45. Nakai Y, Isayama H, Wang HP et al. International consensus statements for endoscopic management of distal biliary stricture. J Gastroenterol Hepatol 2020; 35:967-79. doi:10.1111/jgh.14955.
- 46. DeWitt JM, Sandrasegaran K, OʼNeil B et al. Phase 1 study of EUS-guided photodynamic therapy for locally advanced pancreatic cancer. Gastrointest Endosc 2019; 89:390-8.
- 47. Huggett MT, Jermyn M, Gillams A et al. Phase Ⅰ/Ⅱ study of verteporfin photodynamic therapy in locally advanced pancreatic cancer. Br J Cancer 2014; 110:1698-704.
- 48. Hanada Y, Pereira SP, Pogue B et al. EUS-guided verteporfin photodynamic therapy for pancreatic cancer. Gastrointest Endosc 2021; 94:179-86.
- 49. 有田 二郎, 奥山 朋子.光線力学的療法用製剤ベルテポルフィン(ビスダインⓇ)の薬理学的特性および臨床効果.日本薬理学雑誌 2004;124:435-44.
- 50. Wei H, Wang F, Wang Y et al. Verteporfin suppresses cell survival, angiogenesis and vasculogenic mimicry of pancreatic ductal adenocarcinoma via disrupting the YAP-TEAD complex. Cancer Sci 2017; 108:478-87.
- 51. Mew D, Wat CK, Towers GH et al. Photoimmunotherapy:treatment of animal tumors with tumor-specific monoclonal antibody-hematoporphyrin conjugates. J Immunol 1983; 130:1473-7.
- 52. Vrouenraets MB, Visser GW, Stewart FA et al. Development of meta-tetrahydroxyphenylchlorin-monoclonal antibody conjugates for photoimmunotherapy. Cancer Res 1999; 59:1505-13.
- 53. Mitsunaga M, Ogawa M, Kosaka N et al. Cancer cell-selective in vivo near infrared photoimmunotherapy targeting specific membrane molecules. Nat Med 2011; 17:1685-91.
- 54. Tahara M, Okano S, Enokida T et al. A phase Ⅰ, single-center, open-label study of RM-1929 photoimmunotherapy in Japanese patients with recurrent head and neck squamous cell carcinoma. Int J Clin Oncol 2021 Jun 24. doi:10.1007/s10147-021-01960-6.
- 55. Castano AP, Mroz P, Hamblin MR. Photodynamic therapy and anti-tumour immunity. Nat Rev Cancer 2006; 6:535-45.
- 56. Nath S, Obaid G, Hasan T. The Course of Immune Stimulation by Photodynamic Therapy:Bridging Fundamentals of Photochemically Induced Immunogenic Cell Death to the Enrichment of T-Cell Repertoire. Photochem Photobiol 2019; 95:1288-305.
- 57. OʼShaughnessy MJ, Murray KS, La Rosa SP et al. Systemic Antitumor Immunity by PD-1/PD-L1 Inhibition Is Potentiated by Vascular-Targeted Photodynamic Therapy of Primary Tumors. Clin Cancer Res 2018; 24:592-9.
- 58. Cramer GM, Moon EK, Cengel KA et al. Photodynamic Therapy and Immune Checkpoint Blockade. Photochem Photobiol 2020; 96:954-61. doi: 10.1111/php.13300.
- 59. Kato K, Cho BC, Takahashi M et al. Nivolumab versus chemotherapy in patients with advanced oesophageal squamous cell carcinoma refractory or intolerant to previous chemotherapy(ATTRACTION-3):a multicentre, randomised, open-label, phase 3 trial. Lancet Oncol 2019; 20:1506-17.
- 60. Kojima T, Shah MA, Muro K et al. Randomized Phase Ⅲ KEYNOTE-181 Study of Pembrolizumab Versus Chemotherapy in Advanced Esophageal Cancer. J Clin Oncol 2020; 38:4138-48.
- 61. Janjigian YY, Shitara K, Moehler M et al. First-line nivolumab plus chemotherapy versus chemotherapy alone for advanced gastric, gastro-oesophageal junction, and oesophageal adenocarcinoma(CheckMate 649):a randomised, open-label, phase 3 trial. Lancet 2021; 398:27-40.


