要旨
症例は79歳男性.検診の食道X線造影検査で陥凹性病変を指摘され紹介受診.上部消化管内視鏡検査にて胸部上部食道左壁に境界明瞭な深い陥凹性病変を認め内部には複数の粗大顆粒を認めた.Narrow band imaging観察では陥凹内部はIntra-papillary capillary loopの拡張像を認めたが上皮性腫瘍を疑う所見は乏しく,初回の病変部生検でも診断には至らなかった.全身精査のため造影CT検査を行ったところ,縦隔,腹腔リンパ節の腫大と,肝臓にも複数の占拠性病変を認め,悪性腫瘍の多発リンパ節転移・肝転移を疑った.しかし,食道病変のEUSを施行したところ食道の陥凹部と連続するリンパ節と思われる低エコー腫瘤を認め縦隔リンパ節炎からの二次性食道結核を鑑別に挙げた.腫大したリンパ節に対してEUS-FNAを施行したところ,乾酪壊死を伴う肉芽腫を認め,その後の内視鏡生検の再検,肝腫瘍生検で肉芽腫やLanghans型巨細胞を認めた.以上より結核性リンパ節炎による二次性食道結核,肝結核腫と臨床診断し抗結核治療を行った.半年後の内視鏡では陥凹病変は平坦化し粗大顆粒は消失し,CT検査でもリンパ節の縮小,肝病変の消失を認めた.
Abstract
A 79-year-old man was referred to our hospital for evaluation of a depressed lesion detected on esophageal radiography. EGD revealed a deep depressed well-marginated lesion containing multiple coarse granules on the left wall of the upper thoracic esophagus. Additionally, narrow-band imaging revealed a distended intra-papillary capillary loop within the depression. However, findings were not suggestive of an epithelial tumor, and the lesion remained undiagnosed based on the initial biopsy findings. Subsequent contrast-enhanced CT performed for systemic evaluation revealed enlarged mediastinal and celiac lymph nodes and multiple hepatic lesions, suggestive of multiple lymph node and liver metastases of a malignant tumor. However, EUS performed to evaluate the esophageal lesion revealed a hypoechoic mass that appeared to be a lymph node continuous with the esophageal depression, which indicated secondary esophageal tuberculosis with concomitant mediastinal lymphadenitis. Furthermore, EUS-FNA biopsy of the enlarged lymph nodes revealed a granuloma with caseous necrosis. Subsequent endoscopic re-examination and liver tumor biopsies revealed granulomas and Langhans giant cells. Therefore, the patient was clinically diagnosed with secondary esophageal tuberculosis associated with tuberculous lymphadenitis and hepatic tuberculosis and received antituberculosis therapy. Endoscopy performed 6 months later showed flattening of the depressed lesion and disappearance of the coarse granules, and CT revealed reduction in the size of the lymph nodes with disappearance of the liver lesions.
Ⅰ 緒 言
肺外結核の中で食道結核は極めてまれな疾患で,消化管・腹膜結核における食道結核の頻度は0.16%と報告されている
1).感染経路により,食道への直接浸潤による原発性と,隣接臓器からの二次性に大別される.大多数は腫大した結核性炎症性縦隔リンパ節の圧排や癒着によるもので,粘膜下腫瘍様の隆起や直接穿破による潰瘍が特徴的な所見といわれている
2).しかし,本症例は潰瘍を伴わず陥凹病変内が粗大顆粒を伴う扁平上皮に覆われる非典型的な内視鏡所見を呈しており,鑑別診断に難渋した.その後の超音波内視鏡検査(EUS)所見から二次性食道結核を疑い,病理学的評価も含め臨床診断に至った.病変である陥凹面に関して画像強調観察やEUSも含めた内視鏡所見を詳細に観察し診断し得た貴重な1例と考えられ報告する.
Ⅱ 症 例
症例:79歳,男性.
主訴:特になし.
家族歴:特記事項なし.
既往歴:70歳;前立腺肥大症,72歳;膵管内乳頭粘液性腫瘍,76歳;小脳梗塞,高血圧,肺結核の既往はなし.
現病歴:検診の上部消化管造影検査にて胸部食道左壁に3cm大の陥凹性病変を指摘され精査目的に紹介受診となった.
生活歴:喫煙歴なし,飲酒歴なし.
服薬歴:デュタステリド0.5mg,アムロジピンベシル酸塩5mg,クロピトグレル75mg,ラベプラゾールナトリウム10mg.
初診時現症:身長157cm,体重52.7kg,体重指数(BMI):21.3,体温36.3℃,血圧145/80mmHg,脈拍80/分,眼結膜に貧血・黄疽なし.明らかな表在リンパ節蝕知せず.心音清,肺雑音なし.腹部に特記事項なし.下腿浮腫なし.
初診時検査所見:白血球は正常.CRP 2.4mg/dlと軽度の炎症反応上昇を認めた.その他特記すべき異常所見を認めず,腫瘍マーカーも正常値であった.B型肝炎ウイルス抗原,C型肝炎ウイルス抗体,ヒト免疫不全ウイルス(HIV)抗体はすべて陰性であった.
食道X線造影検査(Figure 1):胸部上部食道に境界明瞭で中央部にニッシェを伴う陥凹性病変を認めた.陥凹内部にはバリウムをはじく小結節も複数認められた.
上部消化管内視鏡検査(Figure 2):門歯25cmの胸部上部食道左壁に3cm大の境界明瞭な陥凹性病変を認めた.陥凹内には潰瘍形成を認めず複数の顆粒状隆起を伴っていた(Figure 2-a).Narrow band imaging(NBI)拡大観察では陥凹内平坦部のintra-papillary capillary loop(IPCL)はdot状に軽度拡張しているものの,形状は均一であった.粗大顆粒部はloop構造の乏しい拡張血管はみられるが口径不同に乏しく,上皮性腫瘍を疑う所見はみられなかった(Figure 2-b).インジゴカルミン散布で陥凹内の顆粒状隆起が明瞭化した.顆粒状隆起部より生検を行ったが腫瘍性病変も含め特異的な所見はみられなかった.
造影CT検査(Figure 3):縦隔から噴門部にかけて多数の不均一な造影効果を示すリンパ節腫大を認めた.リンパ節の一部は食道壁に近接しているものの連続性は同定できなかった(Figure 3-a).肝両葉にリング状の造影効果を伴う病変が散在していた(Figure 3-b).
ポジトロン断層法(PET)-CT検査:胸部上部食道に壁肥厚とstandardized uptake value(SUV) max11.1のfluorodeoxyglucose(FDG)高集積を認めた.縦隔,左肺門,上腹部に多発するリンパ節腫大を認めSUV max8.7までの高集積を認めた.肝左様外側区にもSUV max3.2の限局性集積を認めた.
以上までの検査より当初は悪性腫瘍による多発リンパ節転移,肝転移を疑った.食道病変に関しては,特殊型の食道癌や縦隔腫瘍による食道浸潤を鑑別に挙げEUSを施行することとした.
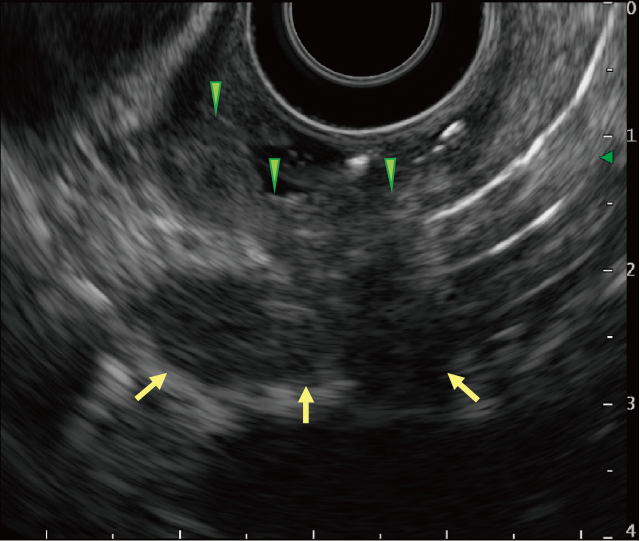
EUS:20MHzプローブでは病変陥凹部に一致して粘膜下~筋層の肥厚を認め中央部は壁外に連続していた.ラジアルスコープ(6MHz)で観察すると縦隔に腫大したリンパ節と思われる低エコー腫瘤を認め,そのうちの1つが食道陥凹部と連続していた(Figure 4).
EUS所見より縦隔リンパ節炎による食道病変を鑑別に挙げ,陥凹部も扁平上皮に覆われ組織学的評価が困難である可能性を考え悪性腫瘍との鑑別も含め安全に穿刺可能な噴門部リンパ節に対して超音波内視鏡下穿刺吸引法(EUS-FNA)を行った.
EUS-FNA:噴門部の19×13mmの腫大したリンパ節より,フランシーン針22Gを用い,1回穿刺を行い,病理組織検査と細胞診を施行した.
噴門部リンパ節病理所見:壊死を伴う肉芽腫性炎症を認めた(Figure 5-a).Ziel-Neelsen染色,PAS染色を施行したが抗酸菌は認めなかった.
EUS-FNAの病理学的所見より二次性食道結核によるリンパ節炎を強く疑い,病変陥凹部から内視鏡生検を再度施行したところ,1度目の内視鏡生検では診断には至らなかったが重層扁平上皮で覆われた粘膜下に肉芽腫(Figure 5-b),Langhans型巨細胞を認めた.肝病変の経皮的生検も一部に肉芽腫様構造を認めた.各病変のZiehl-Neelsen染色,培養検査を行ったが結核菌の証明には至らなかった.
3回の喀痰培養,胃液培養検査でも結核菌の証明には至らず,喀痰,食道病変の結核ポリメラーゼ連鎖反応(PCR)検査も陰性であった.下部消化管内視鏡検査を施行したが回盲部含め腸結核を疑う潰瘍性病変はみられなかった.しかし,T-SPOT強陽性(ESAT-6>=50,CFP10>=50)であったことから造影CT検査所見,EUS-FNA及び食道病変部・肝病変部の病理検査所見と併せて結核性リンパ節炎に伴う二次性食道結核,肝結核腫と臨床診断した.その後,抗結核剤四剤併用(イソニアジド300mg・リファンピシン450mg・エタンブトール750mg・ピラジナミド1,000mg)投与開始,6カ月後の内視鏡検査では病変はわずかに陥凹を残すのみとなっていた(Figure 6).また,CT検査でもリンパ節は著明に縮小し,肝病変は不明瞭となった.また,PET-CT検査も治療前に縦隔にみられたFDG集積は著明に改善した.その後,2年経過するが外来にて無再発経過観察中である.
Ⅲ 考 察
全結核患者の約80%を肺結核が占め,消化管結核は,肺外結核としては結核性胸膜炎,肺門リンパ節以外のリンパ節結核,粟粒結核に次いで4番目に多い
3).肺外結核の中でも食道結核は極めてまれな疾患であり,Lockardによると結核死16,489例中わずか25例(0.15%)であり,非常にまれであると報告している
4).1995~2015年の本邦報告583例の集計では,消化管結核の部位別頻度は多い順に結腸(41.2%),回盲部(38%),小腸(30%),食道(8.9%)であった
3).食道結核の頻度が少ない理由としては,食道内腔は平滑で嚥下運動により菌が付着しにくい,食道粘膜上皮は多層化した扁平上皮であること,食道壁には他の消化管粘膜と比較してリンパ組織が少ない,などから食道は感染症の頻度が少ないとされる
5).背景疾患に関しては,HIV感染症など,種々の免疫異常が発症に関与する場合もあるが,本症例のように免疫異常をきたす基礎疾患がなくても発症し得る.
感染経路は食道壁内から発生する原発性と,隣接臓器から直接浸潤する二次性に大別される
6).大部分が食道周辺臓器からの局所的な波及による二次性のものであり,特に気管周囲・縦隔内乾酪化リンパ節に関連した二次性食道結核が最も多く
7),本例もこれに該当する.
自覚症状としては嚥下障害が最も多く
8),検査所見としてはCRP陽性などの炎症反応上昇が大部分に認められ,ツベルクリン反応は強陽性であることが多いが,白血球増多は認められないことが多い
7).食道X線造影検査では周辺粘膜の盛り上がりを伴う不整な潰瘍として認められることが多い.本例では周囲粘膜のSMT様の隆起は既報とくらべ乏しいものの,境界明瞭な深い陥凹性病変は結核性リンパ節炎による二次性食道結核に矛盾しない所見であった.
内視鏡所見は正常上皮に覆われた周堤を有する潰瘍性病変が典型例であり,一見2型進行癌様にみえ,悪性腫瘍との誤診に留意する必要がある
9).本例は境界明瞭な陥凹性病変を呈しているものの,陥凹部は潰瘍ではなく比較的柔らかい顆粒状の隆起性病変が多発しており異型の乏しい拡張したIPCLを認めていた.これは縦隔リンパ節の炎症による食道穿破からある程度時間が経過しリンパ節炎が落ちついた後の変化で潰瘍部が扁平上皮に覆われ,周囲のSMT様隆起も目立たなくなったと推測され,そのため既報と比較しても非典型的な内視鏡所見を呈したと考えられた.
本症例の鑑別として特殊型の食道癌や悪性リンパ腫などの悪性腫瘍や,重複食道,サイトメガロウイルス食道炎,Crohn病などの炎症性疾患などが挙げられたが今回の症例はEUSの所見が診断の一助となった.EUSの有用性に関しては1993年に荒井ら
10)により報告されており,二次性食道結核の成因として周囲リンパ節の穿破によるものが多いため,EUSにて病変部の食道に連続した腫大リンパ節の所見が診断に有用である.本例はX線画像所見,内視鏡画像所見で通常の食道癌を考える所見に乏しかったが,CTやPETなどの画像所見ではリンパ節腫大,多発肝腫瘤を認め悪性腫瘍を鑑別の上位に挙げていた.その中でラジアルスコープによるEUSを用いることで病変部と腫大した縦隔リンパ節に連続性を認め病変が食道壁外から食道壁内に穿破していることが示唆され結核性リンパ節炎による二次性食道結核を強く疑う契機となった.
食道結核の診断には,結核菌の同定が必須とされるが,生検組織から結核菌が直接証明されることはまれである
6).神戸ら
11)の報告では結核菌を検鏡により直接証明できた症例は13.0%のみであり,一方で,類上皮細胞,Langhans型巨細胞,乾酪壊死などの所見から食道結核が推定された症例は,73.9%と比較的高率であった.また病変部からの粘膜生検培養は44.4%で陽性であり,検鏡による陽性率よりも高率であった.本症例は食道粘膜培養,胃液培養,痰培養を行い結核菌の証明には至らず,初回の食道生検でも診断には至らなかった.これはリンパ節炎による潰瘍が扁平上皮に被覆しており,診断に至らなかったものと考える.EUS-FNAによるリンパ節生検にて乾酪性肉芽腫を認め,その後二次性食道結核を強く疑い食道病変部を深く生検することにより類上皮肉芽腫,Langhans型巨細胞を認めたことから食道結核と臨床診断した.結核の診断においてEUS-FNAによるリンパ節生検の有用性は国内外でも報告されており
8),12),本例においては近年高い組織採取が可能といわれるフランシーン針(22G)を用いることで有効な組織採取が可能であった.
Ⅳ 結 論
非典型的な内視鏡所見を呈した二次性食道結核の1例を経験した.食道に粘膜下腫瘍様の立ち上がりを呈する陥凹性病変,潰瘍性病変を認めた場合には二次性食道結核を鑑別に挙げる必要がある.ただ,本症例は粘膜下腫瘍様の隆起がやや乏しく陥凹面は潰瘍を伴わず扁平上皮で覆われた顆粒状隆起を認めた点が既報と異なっていた.これは,食道穿破からの時間経過や食道への炎症の波及の状態により内視鏡所見が変化する可能性が考えられた.また,診断にはEUSにて食道病変と周囲のリンパ節との連続性を証明することは非常に有用であり,同所見を認めた場合は二次性食道結核を鑑別に挙げ精査することが重要である.