2022 Volume 64 Issue 9 Pages 1541-1549
2022 Volume 64 Issue 9 Pages 1541-1549
膵神経内分泌腫瘍(pancreatic NEN:PNEN)に対する治療の基本は外科切除であるが,膵切除術は未だに周術期偶発症の高い手技であり,膵切除に伴う術後膵機能の低下も問題となる.そのため,腫瘍サイズが小さく,悪性度が低い腫瘍の治療法は議論が分かれており,手術治療に関しても術後の膵機能に配慮した術式選択が必要とされている.近年,主に腫瘍径2cm以内で悪性度の低いPNENに対して,超音波内視鏡ガイド下に腫瘍を穿刺し,エタノールを注入することで腫瘍を凝固壊死させるエタノール局注療法の報告があり,耐術能などが問題で外科切除ができない症例に対する低侵襲治療法の1つとして期待されている.本稿では,EUSガイド下エタノール局注療法の動物実験を含めた報告を紹介し,治療成績や現状の問題点について解説したい.
Surgical resection is considered the standard of care for pancreatic neuroendocrine neoplasms (PNENs). However, the optimal therapeutic approach to small PNETs (≤2 cm in diameter) remains controversial, and the benefits of surgery should be balanced against potential operative complications. Recently, the use of EUS-guided ethanol injection therapy for patients with small PNETs has been reported. This novel therapy may serve as less invasive treatment in patients deemed poor surgical candidates or those rejected for surgery. In this article, we summarize the recent data including that obtained from animal studies and discuss treatment outcomes and current concerns associated with EUS-guided ethanol injection therapy.
消化器に発生する神経内分泌腫瘍(neuroendocrine neoplasm:NEN)は,年間人口10万人に3-5人に発生する比較的稀な腫瘍で,その多くは膵臓と消化管に発生する 1)~3).NENが分泌するホルモンにより特異的な症状が発現する機能性NENと,ホルモンによる症状がない非機能性NENに分けられ,近年の画像診断の進歩に伴い偶発的に発見される非機能性NENの症例が増えてきている 2),3).
膵神経内分泌腫瘍(pancreatic NEN:PNEN)に対する治療の基本は外科切除であるが,膵切除術は未だに周術期偶発症の高い手技であり,膵切除に伴う術後膵機能の低下(内分泌・外分泌機能ともに)も問題となる 4)~6).近年,腫瘍径が小さく,悪性度が低いPNENに対して,超音波内視鏡(EUS)ガイド下に腫瘍を穿刺し,エタノールを注入することで腫瘍を凝固壊死させるEUSガイド下エタノール局注療法の報告が国内・外からされており,今後,低侵襲治療法の1つとして期待されている.本稿では,EUSガイド下エタノール局注療法の動物実験を含めた報告を紹介し,治療成績や現状の問題点について解説したい.
PNENはWHO分類 7)(現行は2019年版)により,核分裂像とKi-67indexの細胞増殖能に応じてGrade(G)1,G2,G3,神経内分泌癌(neuroendocrine carcinoma:NEC),混合型神経内分泌腫瘍(mixed neuroendocrine-nonendocrine neoplasm: MiNEN)に分類され,それぞれ予後や治療内容が異なる.PNENの治療の基本は外科切除であり,切除により生命予後の延長を認め 8),9),悪性度の高いものや,腫瘍サイズが大きい病変に対しては定型的膵切除術が標準治療法となる 1).しかしながら,腫瘍サイズが2cm以内かつ悪性度が低い腫瘍の治療法は議論が分かれており 4),10),11),手術治療に関しても術後の膵機能に配慮した術式選択が必要とされている 1).
一方で,腫瘍径2cm以内のPNENに対する膵切除術の偶発症発生率は32-42%と報告されており,高い数値と言える 4),10),11).また,定型的膵切除術(膵頭十二指腸切除術や膵体尾部切除術)を選択した場合,術後に内分泌機能(糖尿病の新規発症および増悪)および外分泌能力(臨床症状に基づく膵消化酵素製剤の使用)の低下が,それぞれ14-18%,17-33%で発生するとされている 5),6).近年では,腹腔鏡手術の普及により偶発症率は低下してきているが 12),膵切除術は他の消化管手術と比較して,依然として死亡率や術後偶発症率が高い手技であると言える.
そのような背景を元に,本邦2019年版ガイドライン 1)では,非機能性NENは原則として診断がついた全例に切除を行うことを推奨しつつも,腫瘍進行のリスクと手術に伴う偶発症のリスクを十分に説明したうえで,1cm未満,無症状で偶然発見された腫瘍,かつ画像上,転移・浸潤所見を認めないという一定の条件を満たすものに対しては即座の手術ではなく経過観察(6-12カ月ごと)を選択肢とし,腫瘍の増大などがみられた場合に手術を行うことを考慮してもよいとされている.Kuritaら 11)は,2cm以内のPNENの切除例(52例)と経過観察例(23例)を比較し,経過観察中に両群共に原病死は認めず,生存率に差異はなかったとしている(観察期間中央値 切除例:73カ月,経過観察例:52カ月).また,切除例のうちリンパ節転移率は5.8%(3/52)であり,1例(1.9%)に術後35カ月で再発を認めた(腫瘍サイズ19mm,G2症例)が,1cm以内の症例(n=22)に限ればリンパ節転移は認めなかったとしている.経過観察例での腫瘍サイズの変化は平均0.30mmであり,評価開始時から5mm以上の増大や2cm以上になる症例は皆無であり,以上より,1cm以内のG1であれば経過観察も選択肢の1つであるとしている.同様に米国NCCN(National Comprehensive Cancer Network)ガイドライン 13)では腫瘍径1cm未満,欧州ENTES(European Neuroendocrine Tumor Society)ガイドライン 14)では腫瘍径2cm未満であれば条件付きで経過観察の選択肢を提示しており,腫瘍径が小さく,悪性度の低い腫瘍で侵襲の大きい膵切除を要する場合には経過観察を安全に行えるとする報告が増えてきている.
膵腫瘍を想定したエタノール注入の主な動物実験に関する報告をTable 1に示す.最初の報告は,2005年にAslanianら 15)により,8頭の豚の正常膵にエタノールを注入し,濃度と焼灼範囲の検討が行われた.エタノール注入量は0.5ml,濃度は98%と50%とし,EUSガイド下に膵臓内にエタノールを注入し,1週間後に注入箇所をEUSで観察したのち解剖を行った.病理組織学的な結果は,濃度50%では焼灼範囲が2-6mmであり,炎症・壊死所見のある範囲は局所的であったが,濃度98%では焼灼範囲が8-30mmと,50%のものと比較して広範囲であり,1例では周囲の腸管が膵と癒着し,腸管狭窄所見を認めていた.2007年にはMatthesら 16)により,6頭の豚を用いて同様にエタノール注入の実験が行われ,注入量を2.0 mlに固定し,濃度を20-100%に調整して注入された.病理組織学的な結果は,濃度0-20%では炎症・壊死所見はなく,40%で3×20mm,60%で10×15mm,80%で12×25mm,100%で16×23 mmの焼灼範囲であり,十分な焼灼範囲を得るためには濃度80%以上のエタノールを使用することが必要であるとされた.Matsumotoら 17)は,100%エタノールを用いて2頭の豚に1mlおよび2mlのエタノールを注入し,1週間後に解剖し病理組織学的に焼灼範囲を評価したところ,1mlでは約2cmの焼灼範囲で膵内に炎症・壊死所見が限局していたが,2ml注入した豚では炎症・壊死所見が膵外へ波及し,周囲の腸管との癒着を認めていた.また,各論文でそれぞれ解剖前に画像評価を行っているが,概ね病理焼灼範囲と一致しており,画像所見での焼灼範囲の評価はほぼ正確に施行可能であると言える.
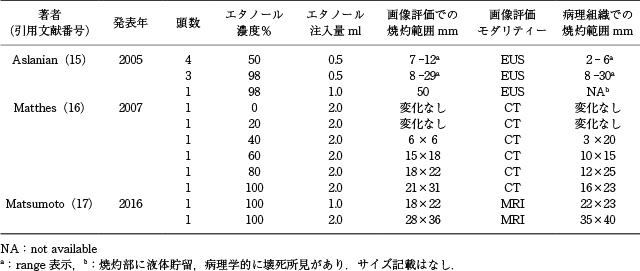
豚の膵臓に対するエタノール注入の主な報告.
EUSガイド下エタノール局注療法は2006年にインスリノーマに対する治療報告 18)が初めて行われ,その後,非機能性PNENにも施行されてきている.主な治療報告例をTable 2 18)~24)に示す.現時点での治療適応は①腫瘍径2cm以内,②耐術能が乏しい,③手術拒否例とされており,外科切除が困難な症例に対する治療の位置づけとされている.
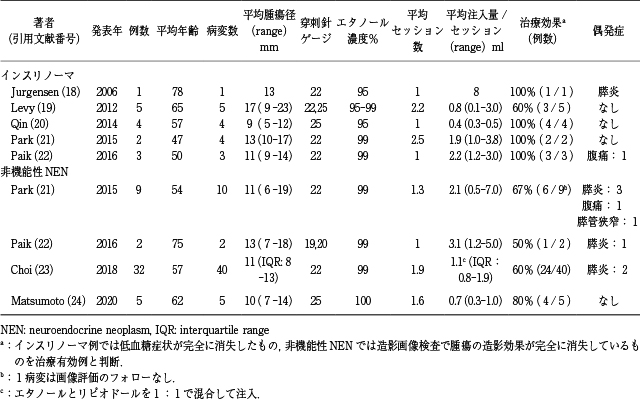
膵内分泌腫瘍に対するEUSガイド下エタノール局注療法の主な報告.
インスリノーマに対する治療は2006年にJurgensenら 18)により報告され,薬物治療(アログリセム)に反応が乏しく,膵切除に対して耐術能のない高齢者のインスリノーマに対して行われた.腫瘍径は13mmで,22ゲージ針が使用され,95%エタノールを8ml注入された.治療直後から血糖値および血糖関連ホルモン値(インスリン,プロインスリン,C-ペプチド)が改善し,術後に軽度の膵炎を認めたが保存的に改善した.治療後からは低血糖症状は起きておらず,画像評価では腫瘍自体の消失も認めていた(観察期間34カ月).2012年にはLevyら 19)により膵切除術に対する耐術能がないと判断された5例のインスリノーマに対してEUSガイド下にエタノール局注療法が行われた.平均年齢(範囲)は65(34-82)歳,平均腫瘍径は17(8-21)mm,エタノール濃度は95-99%で,穿刺針は22および25ゲージが用いられ,1セッション内でのエタノール注入量は0.8(0.1-3.0)ml,平均治療セッション数は2.2(2-3)回であった.治療後は全例で低血糖症状の改善を認め,5例中3例は無症状となり,1例は低血糖発作が1回/月(治療前は20回以上/月),残り1例も1-2回/月(治療前は20回未満/月)と,低血糖症状の頻度改善を認めた(観察期間中央値13カ月).また,治療に伴う偶発症は1例も認めなかった.現在までに,Rimbaşら 25)は機能性PNEN33例38病変(インスリノーマ32例,VIPoma1例)に対する治療報告をレビューしており,平均腫瘍径13mmで,平均治療セッション数は1.1回,1セッションでの平均エタノール注入量は1.9mlで,ホルモン症状の改善は94%(31/33)に認めていた.偶発症は13例に認め,膵炎5例,膵管狭窄1例,膵壊死1例,出血1例,腹痛4例,発熱1例としている.
以上のように,インスリノーマに対する治療効果(=症状の改善)は極めて高く,外科切除が困難な症例に対しては有効な治療方法であると言える.とくに高齢者の症状コントロールを目的とした場合,外科切除の代替治療となり得る可能性があると考える(Figure 1,2,3).
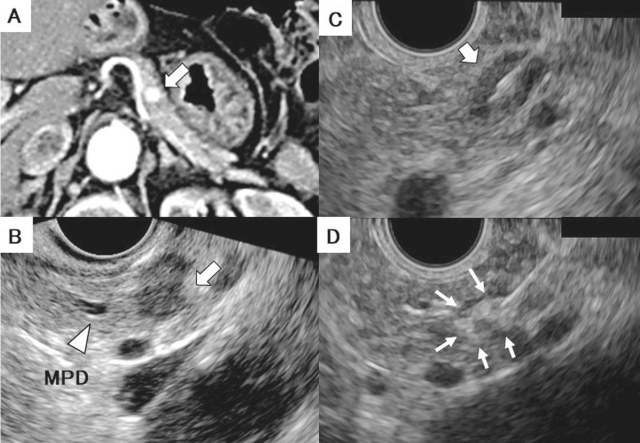
インスリノーマに対する超音波内視鏡(EUS)ガイド下エタノール局注療法.70歳台,G1症例.
A:膵体部に10mmの類縁形の動脈相で濃染する腫瘍を認める(矢印).
B:EUSで,膵体部に低エコー腫瘤(矢印)を認め,主膵管(矢頭)との距離は約5mmであった.
C:25ゲージ針を用いて腫瘍(矢印)を穿刺した.
D:エタノールを注入すると,腫瘍内に高エコーバブルが広がった(矢印).
MPD:main pancreatic duct.
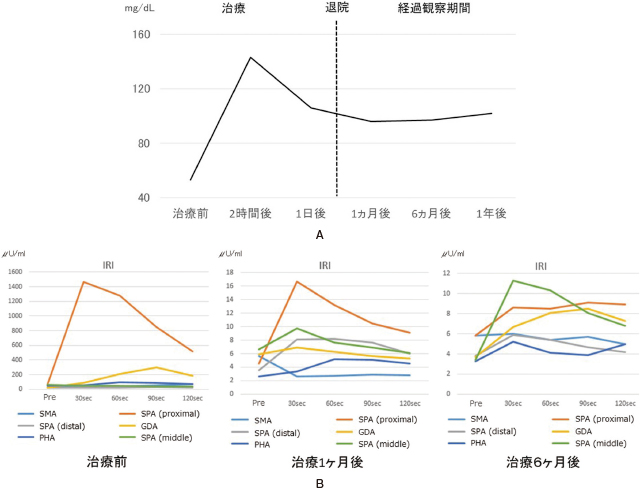
血糖値およびSASI(selective arterial secretagogue injection) テストの治療前後の変化.
A:血糖値の推移.治療前は40mg/dL台であったが,治療後から血糖は正常範囲内まで上昇し,1年半の経過で低血糖症状の出現もなく血糖値も正常範囲内で維持できている.
B:SASIテストの推移.治療前は脾動脈近位部(splenic artery:SPA)のインスリン(immunoreactive insulin:IRI)レベルが正常の約23倍上昇(負荷前:65μU/mlから負荷30秒後:1,467μU/ml)を認めていたが,治療1カ月後では約3倍(負荷前:4.5μU/mlから負荷30秒後:17μU/ml)まで低下し,6カ月後には有意な上昇は認めなかった.
SMA:上腸間膜動脈,superior mesenteric artery.
GDA:胃十二指腸動脈,gastroduodenal artery.
PHA:固有肝動脈,proper hepatic artery.

経時的なCT画像変化.治療後は腫瘍の造影効果が消失し,遺残や遠隔転移は認めていない.
A:治療1カ月後.
B:治療12カ月後.
点線円:治療部.
非機能性PNENに対しては,2015年のParkら21)が9例のEUSガイド下エタノール局注療法の報告をしており,平均年齢(範囲)54(27-76)歳,平均腫瘍径11(6-19)mm,注入エタノール濃度は99%で,穿刺は22ゲージを用いた.平均セッション数1.3回,1セッション内でのエタノール注入量は2.1(0.5-7.0)mlであり,完全焼灼率(治療3カ月後の造影CTもしくは造影EUSで腫瘍の造影効果が完全に消失している割合)は67%(6/9)であったと報告している.偶発症は5例に認めており,早期偶発症は膵炎(中等症)3例,腹痛1例に認めたが,いずれも保存的に改善した.晩期偶発症は膵管狭窄を1例に発症し,膵管ステント留置術で治療を行っていた.Parkらは,膵炎が起きた3例はいずれも1セッション中に2ml以上のエタノール注入を行った例であることから(晩期で膵管狭窄をきたした症例のエタノール注入量は7.0ml),1回での注入エタノール量を調整する必要があることを述べていた.さらに,Choiら 23)は,エタノール注入量の増加による膵炎を予防するため,リピオドールと99%エタノールを1:1で混合したものを注入液として使用し,32例40病変のPNENに対する治療報告を行った.平均腫瘍径は13mmで,穿刺針は22ゲージを用いており,平均セッション数1.9回,1セッションあたりのエタノール・リピオドール混合液の注入量は1.1mlであり,完全焼灼率は60%(24/40)であった(観察期間中央値42カ月).偶発症はわずか膵炎2例(3.2%)であり,いずれも保存的に改善した.Choiらは考察の中で完全焼灼が成功した症例では,画像評価時に腫瘍内のリピオドールが貯留維持しているものの割合が多く,しっかりとした被膜の存在が治療効果に影響しているものと推測している.さらに,腫瘍径が10mm未満の完全焼灼率は76%(13/17)であり,腫瘍サイズも重要な治療因子と考えられた.また,Matsumotoら 24)は完全焼灼率の向上と偶発症を軽減する目的で,計画的なエタノール注入療法の報告を行った.偶発症の軽減のため,1セッション中の穿刺回数を3回,1穿刺あたりのエタノール注入量1.0mlまでと規定し,さらに針孔からのエタノールのリークを予防する目的で25ゲージ針を使用した.焼灼率向上の工夫として,治療3-5日後の早期に造影CTを撮影し,腫瘍の遺残が疑われる症例には同一入院中に追加治療を行った.治療結果は,平均治療セッション数1.6回,1セッションあたりのエタノール注入量は0.7mlで,完全焼灼率は80%(4/5)であった.偶発症は0%であり,1年間の経過観察期間中に腫瘍の再発や糖尿病の発生を含めた晩期偶発症は認めなかった.Rimbaşら 25)は非機能性NEN50例58病変に対するレビューをしており,平均腫瘍径12.6mm,平均治療セッション数は1.8回,1セッションでの平均エタノール注入量は1.6mlで,腫瘍の完全焼灼率は62%(36/ 58),偶発症は13例(膵炎8例,膵管狭窄2例,腹痛2例,発熱1例)に認めたとしている.
以上のように,細い穿刺針の使用や治療スケジュールの工夫により,非機能性PNENに対しても治療効果(=腫瘍の消失)が得られてきているが,未だ十分とは言えない.手技全体での偶発症は膵炎が1割程度に起きており,とくにエタノール注入量が多い症例で起きていることから1回あたりの注入量には注意が必要である.さらに,低悪性度の腫瘍を対象としているため,転移や局所再発を含めた治療効果の判定には,長期での経過観察が必要である(Figure 4).
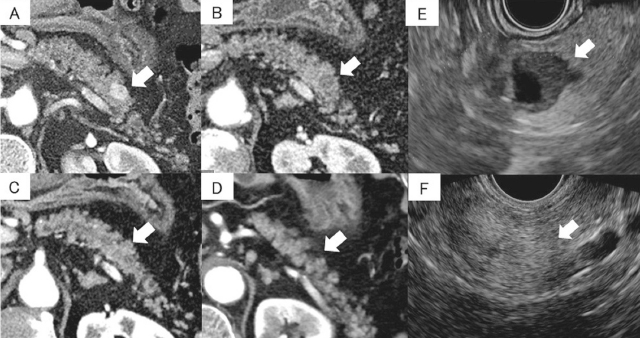
非機能性PNENに対するEUSガイド下エタノール局注療法.70歳台,G1症例.
A:治療前.膵尾部に12mmの類縁形の早期濃染を認める腫瘍(矢印)を認める.
B:治療1カ月後.腫瘍部の造影効果は消失しており完全焼灼成功と判断した(矢印).
C:治療6カ月.腫瘍の造影効果は消失しており,治療後の低吸収領域も縮小し不明瞭化してきている(矢印).
D:治療3年後.治療部(矢印)はほぼ認識できない.
E:治療前EUS.腫瘍は低エコーであり内部に一部囊胞変性を疑う箇所を認めた(矢印).
F:治療3年後EUS.治療部の低エコーは消失し,周囲と比較してやや高エコーを呈している(矢印).
上述したとおり,機能性NENに対する症状改善という点では,十分な治療効果が期待できるが,腫瘍の完全焼灼という点では,治療効果が50-80% 21)~25)に留まっており,十分とは言えない.理論的にはエタノール注入量を増やせば腫瘍焼灼率が上がるが,当然ながら膵炎など偶発症のリスクが高くなる.また,腫瘍の中心部にエタノールを注入することは容易であるが,腫瘍辺縁に残存する場合があり,腫瘍辺縁の治療が課題である 24).これらの観点から海外ではPNENに対する超音波内視鏡ガイド下ラジオ波焼灼療法の報告 26),27)もあり,今後の展望が期待される.
また,本邦のガイドライン 1)でも1cm以内の腫瘍は経過観察も選択肢とされているが,悪性度判断の基準となる超音波内視鏡下穿刺吸引法によるグレード評価には限界があり 28),さらにG1とされる全例が緩徐な増大を示すものとは言えない.6-12カ月ごとの造影剤を使用した画像検査を繰り返すことは被ばくや造影剤アレルギー反応の出現,医療費負担の増額といった面もある.過去の報告 23)からも小さい腫瘍ほど,エタノールによる焼灼効果を得やすいデータもあり,安全に施行が可能であれば,EUSガイド下エタノール局注療法は小さい低悪性度のPNENに対する治療選択になり得る可能性がある.現在,本邦において,15 mm以内のG1症例に対するEUSガイド下エタノール局注療法の安全性と有効性を検討する多施設共同研究が実施中であり 29),研究の結果が待たれる.
本論文内容に関連する著者の利益相反:なし