要旨
1型糖尿病を有する66歳女性.EGDで胃体中部小彎に約5mm大の神経内分泌腫瘍(neuroendocrine tumor:NET)G1を認めた.また,胃体部粘膜の著明な萎縮を有し,抗胃壁細胞抗体と抗内因子抗体がともに陽性で,かつ血中ガストリンが著明高値であることから,自己免疫性胃炎(autoimmune gastritis:AIG)と診断した.さらに,慢性甲状腺炎と1型糖尿病の合併を認め,多腺性自己免疫症候群の3型と診断した.胃NET G1に対してESDを施行した.AIGでは,NETのほか,胃癌の合併も高頻度に生じるとされている.1型糖尿病の患者では,AIGの併存を念頭にEGDを行うことが重要である.
Abstract
A 66-year-old woman who developed type I diabetes mellitus at the age of 50 years was referred to our hospital because of gastric submucosal lesion in the stomach. EGD identified a submucosal lesion, approximately 5 mm in diameter, in the lesser curvature of the middle stomach and showed the corpus dominant atrophy and pseudopyloric metaplasia with the corpus posterior walls. She had positive serum anti-parietal cell and anti-intrinsic factor antibodies. Based on endoscopic findings and histological analysis, G1 gastric neuroendocrine tumor (NET) along with autoimmune gastritis was diagnosed. Additional serological analysis revealed chronic thyroiditis, leading to the final diagnosis of type 3 autoimmune polyendocrine syndrome (APS). ESD was performed for the gastric lesion. Histopathological evaluation revealed a G1 NET. This case suggests that gastroenterologists should be aware of APS and perform EGD for patients with slow progressive type I diabetes mellitus and autoimmune gastritis.
Ⅰ 緒 言
多腺性自己免疫症候群(autoimmune polyglandular syndrome:APS)は,内分泌腺を含む複数臓器に対する自己免疫疾患の組み合わせにより定義される症候群である
1).合併する疾患により4つの病型に分類されるが,APS3型は自己免疫性甲状腺疾患と他の自己免疫性疾患を持つもので,疾患によってさらに4つの亜型に分類される.今回,われわれはAPS3型の患者において,自己免疫性胃炎(autoimmune gastritis:AIG)を背景に神経内分泌腫瘍(neuroendocrine tumor:NET)G1を認め,そのNETの治療として内視鏡的粘膜下層剝離術(ESD)を施行した症例を経験したので報告する.
Ⅱ 症 例
症例:66歳,女性.
主訴:なし.
既往歴:1型糖尿病,肺非結核性抗酸菌症.
家族歴:姉が肺癌.
嗜好歴:喫煙なし.飲酒なし.
現病歴:健診で施行した上部消化管内視鏡検査(EGD)にて胃体中部小彎に隆起性病変を認めた.生検でNET G1と診断されたため,精査加療目的に紹介となった.
現症:血圧121/76mmHg,脈拍72/min・整,体温37.0℃,SpO2(room air)99%,眼瞼結膜貧血なし,眼球結膜黄染なし,呼吸音異常なし,心雑音なし,腹部平坦・軟・圧痛なし,下腿浮腫なし.
臨床検査成績:血液検査ではHb12.2g/dl,Fe121μg/dL,不飽和鉄結合能292μg/dL,フェリチン18ng/mlと貧血は認めなかった.ビタミンB12 721pg/mlおよび葉酸15.2ng/mlと低下は認めなかった.血清ガストリン値は10,850pg/mlと著明な高値を認めたほか,抗胃壁細胞抗体80倍,抗内因子抗体陽性,ペプシノゲンⅠ36.5ng/ml,ペプシノゲンⅡ24.8ng/ml,ペプシノゲンⅠ/Ⅱ比1.5,抗Helicobacter pylori抗体3U/ml未満(ラテックス凝集比濁法,SRL,東京)であった.空腹時血糖297mg/dl,HbA1c 11.7%,抗グルタミン酸脱炭酸酵素抗体127U/mlと高値であった.さらに血中および尿中C-ペプチドはともに測定感度以下で,インスリン分泌は低下しており,1型糖尿病に矛盾しない所見であった.甲状腺機能はfree T3 3.1pg/ml,free T4 0.81ng/dlと正常範囲内であったものの,甲状腺刺激ホルモンは6.28μU/mL,抗サイログロブリン抗体49IU/ml,抗甲状腺ペルオキシダーゼ抗体301IU/mlと高値であった.ヒト白血球抗原(human leukocyte antigen:HLA)typingは日本人1型糖尿病の疾患感受性アレルのDRB1 04:05を有していた.
甲状腺超音波検査:両葉ともにびまん性に腫大していた.辺縁不整,内部不均一であった.
EGD:胃体部優位の萎縮性変化,いわゆる逆萎縮の所見を認め(Figure 1-a,b),胃体上部前壁にはpseudopolyposisを認めた(Figure 1-c).また胃体中部小彎に健診で指摘されたNETを認めた(Figure 1-d).同腫瘍のnarrow band imaging観察で粘膜表層に上皮性腫瘍の所見を認めず,超音波内視鏡検査で第3層に境界明瞭な内部均一の低エコー腫瘤として描出された.胃前庭部,体中部大彎の萎縮部よりそれぞれ生検を施行したところ,AIGとして矛盾しない所見であった(Figure 2).
経過:若年発症の1型糖尿病,無症候性の慢性甲状腺炎,およびAIGを併発したAPS3型と診断した.胃NETは腫瘍径1cm未満,深達度が粘膜下層までのRindi分類Ⅰ型であったことから経過観察も選択肢と考えられたが,治療を希望されたため,ESDの方針とした.入院での血糖コントロールを行った上で,胃NET G1に対しESDを施行し,最終病理診断はNET G1であった(Figure 3).術後は合併症なく退院となった.現在,外来通院中で再発なく経過している.
Ⅲ 考 察
本例は1型糖尿病の加療中に健診を契機にAIGとNET G1を診断された.さらに胃NETに対する術前精査で慢性甲状腺炎も発見され,APS3型の診断に至った貴重な症例と考えられた.各疾患の発症時期については,本例では50歳ころに1型糖尿病が発症している.自己免疫性胃炎や慢性甲状腺炎についても以前より潜在していたと考える.
AIGではガストリン分泌が亢進し,クロム親和性細胞が刺激されることで胃NETが発症すると考えられている
2).本例ではEGDで胃体部優位の逆萎縮パターンを認めていた.胃前庭部と胃体部からの生検で明らかなendocrine cell micronestを認めなかったものの,慢性炎症細胞の浸潤や壁細胞の消失を認め,AIGに矛盾しない病理所見であった.さらに抗胃壁細胞抗体,抗内因子抗体がともに陽性,かつガストリンの著明高値を認めていた.以上より,本例はNETの高リスク患者であったことが推測される.なお,Rindi分類Ⅰ型の胃NETは多発することが特徴であり
3),今後も異時性にNETが発症する可能性もあるため慎重な経過観察が必要であると考えられた.
膵・消化管神経内分泌腫瘍診療ガイドラインでは,本例のようなRindi分類Ⅰ型で腫瘍径1cm未満,かつ深達度が粘膜下層までにとどまるNETでは,経過観察または内視鏡切除が推奨されている
4).しかし,Ki-67指数に関係なく胃NET G1の経過観察中にNET G3に転化した症例や,転移した報告もあり
5),Rindi分類Ⅰ型のNETでも内視鏡切除が選択肢としてあげられる.現在のところ,どのようなNET G1の悪性度が高いかは不明である.そのため,本例のような症例は内視鏡的切除が妥当であったと考えられるが,今後の症例の蓄積が望まれる.
胃NET症例の87.1%にAIGを併発していたと報告されている
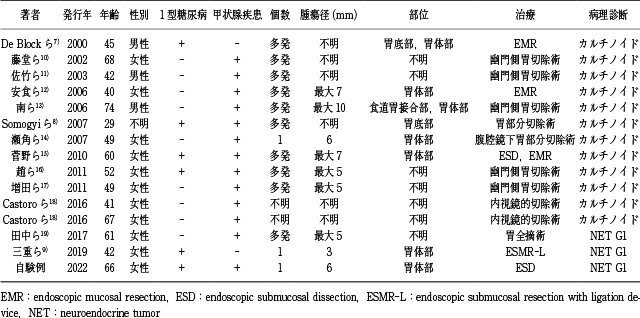
6).医学中央雑誌とPubMedを用いて,2000年から2022年の期間で,「多腺性自己免疫症候群」「神経分泌腫瘍」「カルチノイド」「1型糖尿病」「自己免疫性胃炎」「A型胃炎」「autoimmune polyglandular syndromes」「neuroendocrine tumor」「carcinoid」「type 1 diabetes mellitus」「autoimmune gastritis」をキーワードとして文献を検索したところ,1型糖尿病あるいは甲状腺疾患を合併したAIGは11例であった(Table 1)
7)~19).また,1型糖尿病と甲状腺疾患の両者を合併したAIGは自験例を含め4例のみであった.しかし,このような症例の報告が少ないのは,APSの疾患概念が理解されていないことも要因であると考えられた.
本例のHLAタイピングにおいて,HDRB1 04:05を認めた.HLAはペプチドをT細胞に提示することで免疫応答の中心的な役割を担っており,自己免疫疾患の発症に影響を与えることが報告されている
20).APS3型は複数の遺伝因子および環境因子が関与する多因子疾患と考えられている.環境因子としては感染症などが考えられているが詳細な機序は依然不明である
21).近年,特定のHLAがAPS発症に関与することが指摘されている.Hashimotoらは,APS3型の中で慢性甲状腺炎と1型糖尿病を合併する症例ではHLA遺伝子型のDRB1 04:05やDRB1 08:02が多いと報告している
22).さらに1型糖尿病患者における抗胃壁細胞抗体の存在についてHLA DQA1 0501-DQB 0301との関連が報告されている
23).本例のHLAタイピングを調べたところ,HLA DQA1 0501-DQB 0301は認めなかったものの,DRB1 04:05を有しておりAPS3型の発症に関与していた可能性が示唆される.しかし,本例で認めたDRB1 04:05は1型糖尿病の疾患感受性ハプロタイプとしても報告されているため,APS3型の発症に特異的かどうか解明するには今後の症例の蓄積が望まれる.
Ⅳ 結 語
胃NET G1を合併したAPS3型の症例を経験した.AIGでは,NETのほか,胃癌の発症リスクも高い.したがって,1型糖尿病の患者では,悪性貧血を認めなくても,AIGの併存を念頭に置いたEGDを行うことが大切である.
謝 辞
診断および治療に当たり,徳島大学病院血液・内分泌代謝内科 原 倫世先生,倉橋清衛先生に深く感謝する.
文 献
- 1. Neufeld M, Maclaren N, Blizzard RM. Autoimmune polyglandular syndromes. Pediatr Ann 1980; 9:154-62.
- 2. Itsuno M, Watanabe H, Iwauchi M et al. Multiple carcinoids and endocrine cell micronests in type A gastritis Their morphology, histogenesis, and natural history. Cancer 1989; 63:881-90.
- 3. Rindi G, Luinetti O, Cornaggia M et al. Three subtypes of gastric argyrophil carcinoid and the gastric neuroendocrine carcinoma:a clinicopathologic study. Gastroenterology 1993; 104:994-1006.
- 4. 日本神経内分泌腫瘍研究会(JNETS).膵・消化管神経内分泌腫瘍(NEN)診療ガイドライン2019(第2版).金原出版,東京,2019.
- 5. Spampatti MP, Massironi S, Rossi RE et al. Unusually aggressive type 1 gastric carcinoid:a case report with a review of the literature. Eur J Gastroenterol Hepatol 2012; 24:589-93.
- 6. Ito T, Sasano H, Tanaka M et al. Epidemiological study of gastroenteropancreatic neuroendocrine tumors in Japan. J Gastroenterol 2010; 45:234-43.
- 7. De Block CE, De Leeuw IH, Pelckmans PA et al. Autoimmune hepatitis, autoimmune gastritis, and gastric carcinoid in a type 1 diabetic patient:a case report. J Diabetes Complications 2000; 14:116-20.
- 8. Somogyi A, Ruzicska E, Varga T et al. Development of silent gastric carcinoid in a type 1 diabetic patient with primer hypothyreosis. Orv Hetil 2007; 148:1667-71.
- 9. 三重 尭文, 太田 高志, 岩本 剛幸ほか.多腺性自己免疫症候群に合併した自己免疫性胃炎を背景とした胃神経内分泌腫瘍に対し内視鏡的切除を施行した1例.日消誌 2019;116:654-9.
- 10. 藤堂 祐子, 赤木 盛久, 近松 そのこほか.A型胃炎に発生した多発性胃カルチノイドに幽門側胃切除術を施行した1例.日消誌 2009;99:386-90.
- 11. 佐竹 信祐, 伊舎堂 用大, 中井 玲子ほか.幽門側胃切除によって腫瘍の消退が得られたA型胃炎に伴う多発胃カルチノイドの2例.日消外会誌 2003;36:1173-7.
- 12. 安食 元, 石井 太郎, 大崎 由佳子ほか.A型胃炎に合併し内視鏡的粘膜切除を行った多発胃カルチノイド腫瘍の1例.Gastroenterol Endosc 2006;48:2277-82.
- 13. 南 一仁, 吉田 和弘, 津谷 康大ほか.A型胃炎に高ガストリン血症を伴う多発性胃カルチノイドの1例.日臨外会誌 2006;67:2599-603.
- 14. 瀬角 英樹, 山本 香織, 持塚 章芳ほか.典型的な肉眼形態と考えられたA型胃炎に伴う胃カルチノイドの1例.胃と腸 2007;42:359-65.
- 15. 菅野 雅彦, 福永 正氣, 鷲尾 真理愛ほか.A型胃炎を背景とした多発性胃カルチノイドに対し内視鏡的治療を施行した1例.日外科系連会誌 2010;35:889-94.
- 16. 趙 秀之, 庄田 勝俊, 北川 昌洋ほか.A型胃炎を伴う多発性胃カルチノイドに対し腹腔鏡補助下幽門側胃切除術を施行した1例.臨外 2011;66:513-7.
- 17. 増田 剛, 田中 浩明, 久保 尚士ほか.幽門側胃切除を施行したA型胃炎に伴う多発性胃カルチノイドの1例.日臨外会誌 2011;72:2009-13.
- 18. Castoro C, Le Moli R, Arpi ML et al. Association of autoimmune thyroid diseases, chronic atrophic gastritis and gastric carcinoid:experience from a single institution. J Endocrinol Invest 2016; 39:779-84.
- 19. 田中 啓仁, 柊元 洋紀, 福田 芳生ほか.リンパ管侵襲を認めたA型胃炎合併多発性胃神経内分泌腫瘍の1例.癌の臨 2017;63:539-45.
- 20. Matzaraki V, Kumar V, Wijmenga C et al. The MHC locus and genetic susceptibility to autoimmune and infectious diseases. Genome Biol 2017; 18:76.
- 21. 石井 智弘, 長谷川 行洋.多腺性自己免疫症候群.小児診療 2010;73:2163-7.
- 22. Hashimoto K, Maruyama H, Nishiyama M et al. Susceptibility alleles and haplotypes of human Ieukocyte antigen DRB1, DQA1, and DQB1 in autoimmune polyglandular syndrome type Ⅲ in Japanese population. Hurm Res 2005; 64:253-60.
- 23. De Block CE, De Leeuw IH, Rooman RP et al. Gastric parietal cell antibodies are associated with glutamic acid decarboxylase-65 antibodies and the HLA DQA1*0501-DQB1*0301 haplotype in Type 1 diabetes mellitus. Belgian Diabetes Registry. Diabetic Med 2000; 178:618-22.