2024 Volume 29 Issue 1 Pages 25-
2024 Volume 29 Issue 1 Pages 25-
要 約: 近年の自然環境の悪化に伴い、多くの生物が絶滅の危機に瀕している。こうした絶滅危惧種の保全策の一つとして、生息域外保全及び野生復帰が国内外で幅広く実施されている。しかし、生息域外保全や野生復帰事業においては近交弱勢、飼育栽培環境への適応などによる集団維持の失敗のリスクがある。これらの問題に対処するために、保全遺伝学が果たす役割は非常に大きく、保全遺伝学の成果を反映させた絶滅危惧種の保全策の検討事例も増えている。そこで本稿では、これらの研究成果のさらなる応用を目的として、保全遺伝学の見地から絶滅危惧種の生息域外保全及び野生復帰活動に対する推奨事項を整理した。まず、生息域外保全や野生復帰の際にしばしば問題となる近交弱勢や飼育栽培環境への適応について述べるとともに、それらの対策のための保全遺伝学の見地からの方策、また遺伝的撹乱のリスクや野生復帰後の遺伝的多様性のモニタリングの重要性を紹介した。保全ゲノミクス (ゲノムレベルの情報を活用した生物多様性の保全研究) についてはまだ研究事例が少ないものの、近交弱勢のリスクの検証や集団動態の推定など、生物多様性保全に欠かせない知見が期待されていることを示した。
Abstract: With the recent decline in biodiversity, many organisms face endangerment or extinction. Ex-situ conservation, reinforcement, and reintroduction to wild habitats are common conservation strategies for endangered species. However, these practices risk population disruption due to inbreeding depression and adaptation to captive environments. These issues should be addressed through the application of conservation genetics methods. In recent years, many endangered species conservation policies have been based on the outcomes of conservation genetics studies. In this work, we summarise recommendations for the ex-situ conservation, reinforcement, and reintroduction of endangered species from a conservation genetics perspective. We include discussions of inbreeding depression and adaptation to captive environments, which are often problems in ex situ conservation and reintroduction. We also consider risk assessments of genetic disturbance and the importance of genetic monitoring after reinforcement or reintroduction. Although only a few case studies based on conservation genomics have been published, their findings are expected to be essential for biodiversity conservation, such as inbreeding depression risk assessments and population demography estimations.
近年の地球環境の悪化により、生態系の劣化とともに多くの生物種が絶滅の危機に瀕している (環境省 2020; IUCN 2022)。国際自然保護連合 (IUCN) で絶滅が危惧される種 (絶滅危惧IA類 (CR)、絶滅危惧IB類 (EN)および絶滅危惧II類(VU)) の数は43,867分類群にのぼり (IUCN 2022)、日本国内でも3,716分類群が絶滅危惧種に選定されている (環境省 2020)。こうした生物多様性の危機は国内外で喫緊の課題とされ、生態系とともに個々の絶滅危惧種を保全する必要性は非常に大きい。
絶滅危惧種の保全策の一つとして、人工的な飼育栽培環境で生物を保全する生息域外保全及び野生復帰 (再導入及び補強) があるが、生息域外保全集団の創始から野生復帰に至るまでには、遺伝的多様性の低下やそれに伴う近交弱勢、飼育栽培環境への適応など、様々な問題が起こるために、成功までの道のりは容易ではない。兵庫県豊岡市におけるコウノトリCiconia boycianaの再導入のような成功例がある (内藤ほか 2011) 一方で、2020年にはオガサワラシジミCelastrina ogasawaraensisの生息域外保全集団が繫殖途絶した (公益財団法人東京動物園協会 2020)。こうした生息域外保全及び野生復帰に際し、保全遺伝学が果たす役割は非常に大きく、遺伝的多様性の低下に伴う近交弱勢や飼育環境適応を防ぐために、保全遺伝学な見地から様々な知見が活用されてきた (Frankham et al. 2010)。こうした従来の保全遺伝学はオルガネラDNAや核DNAの少数の遺伝子座のみを対象としていた。一方、近年はゲノムレベルの遺伝解析技術の発展に伴い、ゲノム縮約解析や全ゲノム解析が可能となり、そうした分野は保全ゲノミクスとして注目を浴びている。保全ゲノミクスによって、より高解像度の遺伝的多様性や遺伝構造の推定だけでなく、選択を受けた機能遺伝子や有害変異量の推定などが明らかにできるようになり、生物多様性保全に新たな潮流をもたらしている (Paez et al. 2022)。
生息域外保全及び野生復帰時に生じうる諸問題に対処するために、IUCNや環境省、日本魚類学会などが生息域外保全や野生復帰などに関するガイドラインを公表している (表1)。これらのガイドラインには生息地管理や社会的合意、モニタリングなどに加え、保全遺伝学な観点からも生息域外保全や野生復帰に関わる推奨事項が記載されている。
そこで本稿では、保全遺伝学の視点から生息域外保全及び野生復帰の際に起こりえる問題、さらに実施の際に推奨されるべき事項について、既存の保全遺伝学の知見をもとに整理した。なお、生息域外保全及び野生復帰に際して求められる推奨事項については、現状の保全ゲノミクスでは未解明な点も多い。そのため、今後の保全遺伝学および保全ゲノミクスの課題となる将来的な展望についても議論した。
生息域外保全集団及び野生復帰における問題点
生息域外保全集団の維持や野生復帰の実施にあたり、遺伝的な側面から問題となる点は数多い。まず取り上げたいのは、生息域外保全集団における「遺伝的多様性の喪失に伴う近交弱勢の発現」及び「生息域外保全環境への適応」である (Frankham et al. 2010)。遺伝的多様性の喪失は繁殖や成長など様々な形質に悪影響を及ぼす。日本国内においても、オガサワラシジミの生息域外保全集団の繁殖が途絶してしまった要因の一つとして近交弱勢が挙げられている (公益財団法人東京動物園協会 2020)。特に集団サイズや集団数の限られる絶滅危惧種の場合は生息域外保全集団の遺伝的多様性の確保が難しく、近交弱勢の発現リスクが大きくなってしまう。
さらに、生息域外保全環境への適応も問題となる。特に本来の生息地と環境が大きく異なった生息域外保全環境では、その環境に適した形質が選択される可能性が高い (Frankham et al. 2010; Crates et al. 2023)。その結果、野生復帰を試みる際に、野生環境に適応できず、うまく定着ができないことがある。飼育環境への適応の結果としては、まず特定の選択圧により遺伝的に固定された形態形質の変化が挙げられる。オウムの一種Neophema chrysogasterでは、野生個体と飼育個体では風切羽の長さに変化が生じており、これは野生環境と飼育環境で選択圧に差があったからであると結論付けている (Stojanovic et al. 2021)。 さらに、天敵から逃避行動をとらなくなり、それにより野生復帰後天敵に捕食されるリスクが増大する可能性 (Harrison et al. 2023) や、野生個体と異なる繁殖行動を生息域外保全個体がとるようになったために、再導入をしても野生個体との繁殖が難しくなった事例も報告されている (Appleby et al. 2023)。
次に、野生復帰による遺伝的撹乱の問題も指摘したい。まず野生個体と遺伝的差異の大きな個体を人為的に野外に放逐することで、その生物本来の集団遺伝構造を乱す、つまり遺伝的撹乱が生じる可能性である。これまで知られている遺伝的撹乱としては、種苗放流、またはペットや園芸個体由来と考えられる個体による報告が多い (キタノメダカOryzias sakaizumii 及びミナミメダカO. latipes, 中尾 2017; サギソウPecteilis radiata (Thunb.) Raf., Nakahama et al. 2021) が、一方、保全目的で野外の生息地に導入したものが遺伝的撹乱をもたらしたケースも報告されている (ゼニタナゴ Acheilognathus typus, Saitoh et al. 2016)。遺伝的撹乱によって、その生物がこれまでに辿ってきた分布変遷や遺伝的分化にかかわる歴史が破壊されることや (河村ほか 2009)、外交配弱勢 (outbreeding depression, 遺伝的に離れた個体同士が交配すること) による適応度の低下 (Huff et al. 2011) が生じうることから、遺伝的撹乱の影響を可能な限り最小限にすべきである。
最後に、野生復帰後のモニタリングの問題である。野生復帰が実施された後においても、再導入した集団が野生環境に定着したかどうかを確認するためのモニタリングが推奨、実施されている (Marshall et al. 2022; 照井ほか 2022)。こうしたモニタリングにおいては、遺伝的多様性の維持や遺伝的組成の偏りの防止のために遺伝的多様性や遺伝構造のモニタリングも実施される必要がある (Maschinski and Albrecht 2017)。しかし、遺伝情報のモニタリングが実施され始めたのはほとんどが2010年以降であり (Van Rossum and Hardy 2022)、モニタリングの実施例自体が非常に少ないのが現状である。特に野生復帰時の創立個体数が少ない、もしくは創立集団の遺伝的多様性が低く、近親交配が見込まれる場合、野生復帰前後での遺伝情報のモニタリングの必要性は特に大きいと考えられる(Maschinski and Albrecht 2017)。
一連の問題点に対処するために、多くの保全遺伝学的研究が実施され、保全現場に提言がされてきた (Frankham et al. 2010)。従来のような少数遺伝子座を用いた保全遺伝学から保全ゲノミクスに転換することで、ゲノムレベルでの遺伝的多様性や近親交配の進行状況など、モニタリングに不可欠な情報も得ることができることから、今後特に推進されるべきだろう (Mueller et al. 2022; Paez et al. 2022)。
生息域外保全及び野生復帰に必要な遺伝情報及び遺伝解析手法
これまで多くの保全遺伝学及び系統地理学的研究には、オルガネラや核の一部のDNA配列が使用されてきた。しかし、オルガネラDNAの場合は母系遺伝 (ごく一部が父系遺伝) であり、両性遺伝である核DNAと遺伝様式が異なることや、個体識別ができるほどの解像度がないなどの問題があった。その後マイクロサテライト解析が登場し、さらに2010年代以降、RAD-seq、MIG-seq、GRAS-Diなどのゲノム情報を縮約解読した大量の一塩基多型 (SNP) に基づく解析などの個体識別が可能な手法が一般的になってきた (Wachi et al. 2018; 中濵ほか 2022)。その結果、集団の遺伝的多様性や集団遺伝構造など、生息域外保全及び野生復帰に必要な高解像度の遺伝情報をより効率的に得られ、多くの絶滅危惧種において保全遺伝学的な研究が進展している (中濵ほか 2022)。
また近年では、多数の個体から全ゲノム配列を決定する手法も一般的となりつつある。全ゲノムリシーケンスによって、数十万座を超えるSNPを得ることができ、上述の遺伝的多様性及び集団遺伝構造のほか、近親交配の程度、また全ゲノム中の塩基置換における非同義置換の割合から有害突然変異の量も推定できるようになってきた (Dussex et al. 2021; von Seth et al. 2022; Yang et al. 2023)。しかし、全ゲノム決定及びリシーケンスのコストは依然として高く、日本国内では全ゲノムレベルでの研究例は多くない (中濵ほか 2022)。参考までに、筆者がゲノムサイズ約1.0 GBの昆虫の新規ゲノム決定を外注した際には、ライブラリー作成から de novoアッセンブリまででおよそ90万円程度の費用であった (中濵, 私信)。しかしゲノムシーケンシングのコストは著しく低下しつつあるので、今後、より多くの絶滅危惧種に適用されるものと思われる。
また全ゲノム解析などにより、環境や気候の変動に関わる遺伝子の積極的な探索も可能となる (Funk et al. 2019)。アメリカ大陸における絶滅危惧種のヒキガエルの一種Catharus puttatusでは、気候変動によって細胞応答に関与するMAP3K5などいくつかの遺伝子座が選択を受けていたことが分かった (Maier et al. 2023)。こうした研究例も、生息域外保全の創始・存続及び再導入・補強の成功に大きく影響すると考えられることから、これらの事業の実施の際に応用できると期待される。
生息域外保全集団の創始
生息域外保全は、原則的に野外集団と同程度の遺伝的多様性を保持することが推奨される。Valbuena-Ureña et al. (2017) では、イモリの一種Calotriton arnoldi (野外集団の推定個体数は1,500頭未満) について、野生集団の97.5%の遺伝情報を維持するためには、生息域外保全集団の創始個体は少なくとも20-25個体必要だったと推定している。またFrankham et al. (2010) においても仮想的な集団における数理解析の結果、異系交配種では30個体を用いることでヘテロ接合度の98%をカバーできると示している。ただし、野生集団が持つ遺伝的多様性や有効集団サイズの多寡などから、遺伝的多様性の保持に必要な上記の個体数が変化する可能性は大いにある。また植物をはじめクローンを形成する生物の場合、空間的に離れた個体でも同一クローンである可能性もある。そのため、上記の個体数を最小創始個体数として用いて必要な遺伝的多様性が確保する場合は、予め遺伝情報などにより個体識別を実施しておく必要がある。このように、上記で示された20-30個体という値はあくまでクローンを形成しない動物に限られることに注意されたい。また動物や雌雄異株植物の場合は、性別が偏らないようにする配慮も必要だろう。このように、野生集団の創始個体数の設定にはまだまだ課題が多く、今後様々な絶滅危惧種における検証が必要といえる。
なお、生息域外保全集団の創始においては、事前に遺伝的多様性や集団遺伝構造の空間パターンを調べておき、保全単位を認識した上で生息域外保全集団を構成することが望ましい (IUCN 2014; Maschinski and Albrecht 2017)。この場合、前述の個体数を上回り、かつ遺伝的多様性が高くなるように生息域外保全個体を選択することが必要となるが、予算や絶滅リスクの大きさ、飼育・繁殖の容易さなどに応じて個々に検討していく必要があるだろう。一方で、野生集団の個体数が非常に限られている場合には、野生集団の個体数と、生息域外保全集団の創始のために採集する個体数とのバランスを考慮する必要がある (IUCN 2014)。原則として、野生集団の生存・繁殖・遺伝的多様性の保持に支障をきたさない手法での生息域外保全集団の設置が望ましい。
また、生息域外保全の創始のタイミングについても留意しておく必要がある。すでに野生集団において遺伝的多様性の低下や集団サイズの縮小がみられる場合は、野生集団を創始個体として生息域外保全を開始しても近交弱勢が生じるリスクが大きくなる (Frankham et al. 2010)。生息域外保全の創始のタイミングは実際の保全事業の体制や合意形成、予算などにもよるので一概には言えないものの、野生集団の個体数や遺伝的多様性が十分に保たれているうちに生息域外保全の創始個体の確保が重要であるといえる。
生息域外保全集団の存続
生息域外保全集団は、創始元となる野生集団と同程度の遺伝的多様性を維持する必要がある (Frankham et al. 2010)。生息域外保全集団では創始時に遺伝的多様性を保持できたとしても、生息域外保全個体の予期せぬ大量死や繁殖の失敗によって、遺伝的多様性が喪失するリスクが付きまとう。また、個体数が一定に保たれていたとしても、集団サイズが小さい場合は世代の経過に伴い遺伝的多様性が喪失してしまう(Frankham et al. 2010; 井鷺・陶山 2013)。例えば、有効集団サイズ10個体からなる集団がランダム交配で20世代経過した場合、当初の遺伝的多様性の約65%が失われる。こうした遺伝的多様性の喪失を防ぐため、循環交配 (分集団間で交配をすることによりの近親交配を避ける交配手法) 、集団中の個体間の血縁度の最小化、集団サイズの最大化、有効集団サイズ/実際の集団サイズの最大化などが推奨されている。ただし、集団サイズの最大化といっても、単一の生息域外保全施設で個体数を増加させると、維持や繁殖のためのコストが大きくなってしまう (Frankham et al. 2010)。また、仮に遺伝的多様性が維持されたとしても、飼育栽培環境への適応によって、野生復帰の際に野生環境に適応できなくなるリスクが伴う。
これらに対する方策の一つとして、複数施設で生息域外保全を実施し、施設間で定期的に個体を交換することが効果的である。これらの方策により、繫殖途絶や個体数減少のリスク軽減だけでなく、飼育環境への適応の軽減などの効果が期待される (Frankham et al. 2010)。また、シミュレーション研究 (Lacy 1987) からも実証研究 (加藤ほか 2021) からも、集団を複数に分けて分散飼育栽培することで遺伝的多様性の喪失を抑制できることが示されている。
野生復帰に適した地域の選定
野生復帰の際に最も大きな問題となるのが、遺伝的撹乱である。野生復帰に際して起こりうる遺伝的撹乱は、野生個体と遺伝的差異の大きな個体を人為的に野外に放逐することで、その生物本来の遺伝的構造が撹乱されることである。このような遺伝的撹乱には、まず外交配弱勢 (outbreeding depression) により適応度が低下してしまうリスクがある。カジカの一種 Cottus cognatusの他集団との交雑個体では、体長、体重、成長速度ともに非交雑個体と比較していずれも低かったことが示されている (Huff et al. 2011)。さらに、種のゲノムに刻まれた進化的歴史が撹乱されてしまうリスクがある。野生復帰の事例ではないものの、遺伝典的撹乱の例としては、ニッポンバラタナゴRhodeus ocellatus kurumeusが挙げられる。ニッポンバラタナゴの生息地にタイリクバラタナゴRhodeus ocellatus ocellatusが侵入した結果、多くの生息地で交雑してしまい、純系のニッポンバラタナゴの生息地はごく少数となってしまった (河村ほか 2009)。これらの問題を回避するためには、保全単位を遺伝情報に基づいて設定することが必要となる。保全単位とは、遺伝的にも適応的にも異ならないと考えられる種内の集団を示しており、保全単位内では遺伝構造を撹乱せずに生物の野生復帰が可能となる。同一の保全単位である集団の分布域内における個体の移動であれば、遺伝的撹乱のリスクを大きく低下させることができる。保全単位の設定には系統地理学や集団遺伝解析による情報が非常に有用であり、木本植物ではすでに多くの種で研究例の取りまとめがされている (津村・陶山 2015)。しかし、絶滅危惧種全種のうち、保全単位の設定に有用な系統地理学・集団遺伝学研究が実施された絶滅危惧種の割合は低い。国内希少野生動植物種に限っても18.5%に留まり、特に無脊椎動物で研究例が非常に少ない (中濵ほか 2022)。また、解析手法に用いたマーカーの種類や遺伝子座数によって、解像度が大きく異なる問題もあり、どの程度の解像度に基づいて保全単位を設定すべきかについては議論・検討が必要である。さらに、保全単位の設定には中立遺伝子だけでなく機能遺伝子も用いるべきであるという指摘もある (Funk et al. 2012)。同一種内でも、他集団と継続的に異なる選択圧を受けてきた集団については、特定の機能遺伝子の頻度が他集団と異なっていることがあるためである。例えば、Bazzicalupo et al. (2023) はユーラシア大陸に広く分布するオオヤマネコLynx lynxについて局所適応に関与する機能遺伝子を特定するとともに、それら機能遺伝子に基づいた保全単位を提案している。
ただし、仮に保全単位内での移動であったとしても、生息環境、餌資源、共生生物などがもともとの生息地と野生復帰候補地で異なっていることから、野生復帰に失敗してしまうケースも多い。日本国内の道路開発に伴うラン科植物の移植事例では、移植後4年でおよそ60%が生育を確認できなくなっている (長谷川ほか 2014)。このように、本格的な野生復帰の前に遺伝的な要因以外についても考慮し、定着可能かどうかを検討する必要がある。
野生復帰と遺伝的多様性のモニタリング
野生復帰を実施する際には、十分な個体数と遺伝的多様性の確保が必要である。野生復帰時の個体数が少なければアリー効果によって、遺伝的多様性が低ければ近交弱勢によって再度絶滅してしまう可能性が高くなるからである。野生復帰に用いる際の最小存続個体数 (Minimum viable population, MVP) に関しては、数理解析や過去の文献調査に基づき、Frankham et al. (2010) では、有効集団サイズ500個体以上、またFrankham et al. (2014) では、有効集団サイズ1,000個体を、適応可能性を保持する最小存続個体数としている。一方で、1970年以降に実際に最小存続個体数を推定した先行研究のメタ解析の結果 (212種から287の最小存続個体数を推定)、最小存続個体数は数十~数十万個体と大きくばらつき、中央値は4,169個体であった (Traill et al. 2007)。こうしたばらつきが示す通り、最小存続個体数は対象種や対象集団によって大きく異なっていることから、個別に慎重に判断する必要がある (矢原・鷲谷2023)。
野生復帰事業の後には、対象集団が無事に定着、世代交代ができているかどうか、個体数や生息環境の調査が実施されることが多い。もし野生復帰後に集団がボトルネックを経験した場合、外部からの移入がなければ遺伝的多様性は減少し、近交弱勢や環境変化への脆弱性が高まるリスクが増加してしまう。実際に、野生復帰後に遺伝的多様性が減少し、近親交配が進行している例は少なくない (Brzeski et al. 2014; Mueller et al. 2022)。そうした問題に迅速に対処するために、可能であれば個体数とともに遺伝的多様性についても定期的にモニタリングをしておく必要がある。また、モニタリング自体が5年以内で終了してしまうことがほとんどであるが、少なくとも個体数のモニタリングについては、野生復帰集団の存続可能性を評価するために数十年間実施したほうが良いという指摘もある (Albrecht et al. 2011; Maschinski and Albrecht 2017)。
野生復帰の遺伝的なモニタリング事例は海外で多くの研究例がある。例えば、絶滅危惧種の魚類の一種southern pygmy perch (Nannoperca australis) では1350匹を再導入に用いたところ、11年間にわたり個体数が増加傾向にあり、遺伝的多様性も高い水準で維持されていた (Marshall et al. 2022)。一方、アメリカアカオオカミ Canis rufusは再導入に68頭が用いられたものの、近親交配が進行し、成獣の体サイズが小さくなるなどの近交弱勢の兆候が見られた (Brzeski et al. 2014)。
保全ゲノミクスがもたらす知見
上述の通り、全ゲノムデータやゲノム縮約データ、トランスクリプトームデータに基づく保全ゲノミクスが、2010年代以降に一般的となってきた (Paez et al. 2022)。これにより、従来の保全遺伝学では難しかった知見がもたらされるようになってきた。特に2020年代以降、こうした研究が飛躍的に増加しており、今後、保全現場にも研究成果が活用されることが強く期待される。遺伝的多様性や空間遺伝構造などは従来の手法と同様に検証可能であるため、保全ゲノミクスで明らかにできる内容についてここでは議論したい。
まず、近交弱勢の生じるリスクの検証である。一般的に生物のゲノム中に膨大な数の有害遺伝子が蓄積されており、栽培植物であるジャガイモSolanum tuberosum L.を例にとると、有害と推定される塩基置換が344,831か所発見されている (Zhang et al. 2019)。近交弱勢のリスクや原因となる有害変異は対象生物や集団によって異なるため、現時点で個別の有害遺伝子を特定し、発現メカニズムを解明することで近交弱勢リスクを予測するのは、コストや労力の面からあまり現実的ではない。そこで近年は全ゲノム解析のコストが低下したことにより、近親交配の強さや有害突然変異の蓄積程度を推定することが一般的になっている (Dussex et al. 2021; von Seth et al. 2022; Yang et al. 2023)。また、トランスクリプトーム解析 (細胞内で発現する遺伝子の配列や量を網羅的に把握する解析手法) によって、絶滅危惧種のゲノム内に蓄積された有害変異の量や、重複遺伝子の比率から環境適応能力を近縁普通種と比較し、絶滅危惧種の本質的な脆弱さを生息域外保全を行う前に予測することも可能になっている (Hamabata et al. 2019)。しかし、有害突然変異量と近交弱勢の発現リスクの関係性についてはまだ知見が不足している。今後、近交弱勢の発現リスクをより詳しく解明するためには、有害突然変異量と、繁殖形質などの適応度との関係性を詳細に調べる必要があるだろう。
次に、集団動態 (過去の有効集団サイズの変化、交雑や分化の年代など) の推定である。集団動態を推定することで、その種がこれまでにたどった歴史だけでなく、絶滅危惧種の保護増殖における目標個体数など、保全戦略を検討するうえで非常に有用な情報が得られる。推定できる年代や必要なデータ量などはソフトウェアによって大きく異なっていることから、詳細は、Bourgeois and Warren (2021) やNadachowska-Brzyska et al. (2022) を参照いただきたい。国内外で多くの絶滅危惧種において集団動態が推定されており (Patton et al. 2019; Dussex et al. 2021)、近年は国内でも、アカガシラカラスバトColumba janthina nitens (Tsujimoto et al. 2023) やニホンウナギAnguilla japonica (Faulks et al. 2022) などの絶滅危惧種でこうした研究が実施されている。
選択に関連する遺伝子領域や近親交配の大きさなどもゲノムレベルのデータから推定でき、保全ゲノミクスは、生物多様性保全に多大な貢献をすることが期待されている。一方で保全ゲノミクス研究や全ゲノム決定がされている絶滅危惧種は全体のうちごくわずかであることから、今後より多くの種で研究を蓄積する必要がある (中濵ほか 2022; Paez et al. 2022)。さらに、将来的にはこれらの研究事例を総括したうえで、生物多様性保全のガイドラインに保全ゲノミクスの知見を活用することが重要だろう。
さらに、保全ゲノミクス研究は前述のような生物多様性保全事業だけでなく、自然史の理解、人と自然の関わりの歴史およびその価値の再考にも大きな力を発揮することが期待されている (佐藤・木下 2020; Araki and Sota 2023)。こうした知見は生物多様性や自然史の理解だけでなく、絶滅危惧種や生物多様性の保全活動の動機づけにも有用であるだろう。
推奨事項と保全現場への適用
本稿における推奨事項を図1及び図2に示した。本稿では生息域外保全及び野生復帰の推奨事項として保全遺伝学的な側面に焦点を当てたが、先述の通りこれまでに国際機関や学会などから生息域外保全もしくは野生復帰に関するガイドラインが公表されており(表1)、保全遺伝学的な観点にとどまらず、生息域外保全や野生復帰の基本的な考え方や計画策定、実施の是非や手順、実施の後のモニタリングなどの配慮事項などが主に掲載されている。生息域外保全や野生復帰事業の実施の検討する際には、本稿とともにこれらのガイドラインも参照されたい。また、津村・陶山 (2015) や 森林総合研究所 (2015, 2017) では、各対象植物の空間遺伝構造のデータを示すとともに、種苗の移動範囲を示している。
しかし、残念なことに日本国内では、絶滅危惧種の保全に際して遺伝情報が十分に利活用されているとは言い難い。各絶滅危惧種の遺伝的多様性や遺伝構造のモニタリングがされている例自体が多くなく、また保全単位を設定するための各絶滅危惧種の空間遺伝構造などは不明な種が多いのが現状である (中濵ほか 2022)。表1で挙げたガイドラインにおいても、実際の空間遺伝構造が示されているのは一部の木本植物にとどまっている (津村・陶山 2015; 森林総合研究所2015, 2017)。今後は、絶滅危惧種の生息域外保全や野生復帰の保全遺伝学・保全ゲノミクス研究を個別に進めることが重要となるだろう。また近年進展している保全ゲノミクスに基づいたガイドラインは現時点でまだ作成されていない。保全ゲノミクスに基づいた絶滅危惧種の保全ガイドラインの策定は喫緊の課題ともいえるだろう。
さらに、絶滅危惧種の保全活動における活動主体との連携推進も課題といえる。絶滅危惧種の保全活動においては、予算が確保できない限り、高額の保全遺伝学・保全ゲノミクスを取り入れることが難しい。このため、保全遺伝学分野の専門家が保全現場の活動主体と積極的な情報共有をするとともに、遺伝的多様性から個体数、生息環境までを含めた保全活動の協働を進めることで、遺伝子レベルの多様性も含めた、より包括的な保全活動の実践につなげていくことが可能となるだろう。
本研究は環境省・(独)環境再生保全機構の環境研究総合推進費(JPMEERF20224M02)により実施した。
引用文献
|
表 1.生息域外保全及び再導入のガイドライン。国内に適用できるもののみを、またシリーズとなっているものは最新版のみ列挙した。 リストは「分類群を定めていない」、「動物」、「植物」に類別し、それぞれ年代ごとに並べている。 |
|||
|---|---|---|---|
| ガイドラインのタイトル | 分類群 | 出版者及び年 | URL |
| 絶滅のおそれのある野生動植物種の生息域外保全実施計画作成マニュアル | 定めていない | 環境省 (2013) | https://www.env.go.jp/nature/yasei/ex-situ/manual.pdf |
| Guidelines for Reintroductions and Other Conservation Translocations first edition (再導入と保全的移動のためのガイドライン 第1版) | 定めていない | IUCN (2013) | https://www.iucn.org/resources/publication/guidelines-reintroductions-and-other-conservation-translocations (日本語訳は環境省が作成 https://www.env.go.jp/content/900491553.pdf) |
| IUCN Species Survival Commission guidelines on the use of ex situ management for species conservation (国際自然保護連合 種保存委員会 種保全のための生息域外管理利用ガイドライン) | 定めていない | IUCN (2014) | https://portals.iucn.org/library/node/44952 (日本語訳は https://portals.iucn.org/library/node/46235) |
| 生物多様性の保全をめざした魚類の放流ガイドライン | 魚類 | 日本魚類学会 (2005) | https://www.fish-isj.jp/iin/nature/guideline/2005.html |
| 日本野生動物における再導入ガイドライン | 哺乳類及び鳥類を中心とした野生動物 | 野生動物医学会 (2007) | https://www.jjzwm.com/guideline/ |
| 保全のための放蝶に関するガイドライン | チョウ類 | 日本鱗翅学会 (2013) | https://lepi-jp.org/lsj-releasing-butterflies/ |
| IUCN guidelines for amphibian reintroductions and other conservation translocations : first edition (両生類の再導入と保全的移動のためのIUCNガイドライン 第1版) | 両生類 | IUCN (2021) | https://www.iucn.org/resources/publication/iucn-guidelines-amphibian-reintroductions-and-other-conservation |
| 地図でわかる樹木の種苗移動ガイドライン | 木本植物 | 津村・陶山 (2005) | |
| 小笠原諸島における植栽木の種苗移動に関する遺伝的ガイドライン | 木本植物 | 森林総合研究所 (2015) | http://www.ffpri.affrc.go.jp/pubs/chukiseika/documents/3rd-chuukiseika25.pdf |
| Center for Plant Conservation's Best Practice Guidelines for the reintroduction of rare plants (植物保護センターによる希少植物の再導入のためのベストプラクティスガイドライン) | 植物 | Maschinski and Albrecht (2017) | https://doi.org/10.1080/13416979.2022.2040096 |
| 小笠原諸島における植栽木の種苗移動に関する遺伝的ガイドライン2 | 木本植物 | 森林総合研究所 (2017) | https://www.ffpri.affrc.go.jp/pubs/chukiseika/documents/4th-chuukiseika3.pdf |
| Genetic guidelines for tree species and perspectives on the conservation and sustainable use of forests (木本植物の遺伝的ガイドラインと、森林の保全と持続的利用の展望) | 木本植物 | Tsumura (2022) | https://doi.org/10.1080/13416979.2022.2040096 |
| Guidelines for genetic monitoring of translocated plant populations (移植した植物集団の遺伝的モニタリングのガイドライン) | 植物 | Van Rossum and Hardy (2022) | https://doi.org/10.1111/cobi.13670 |
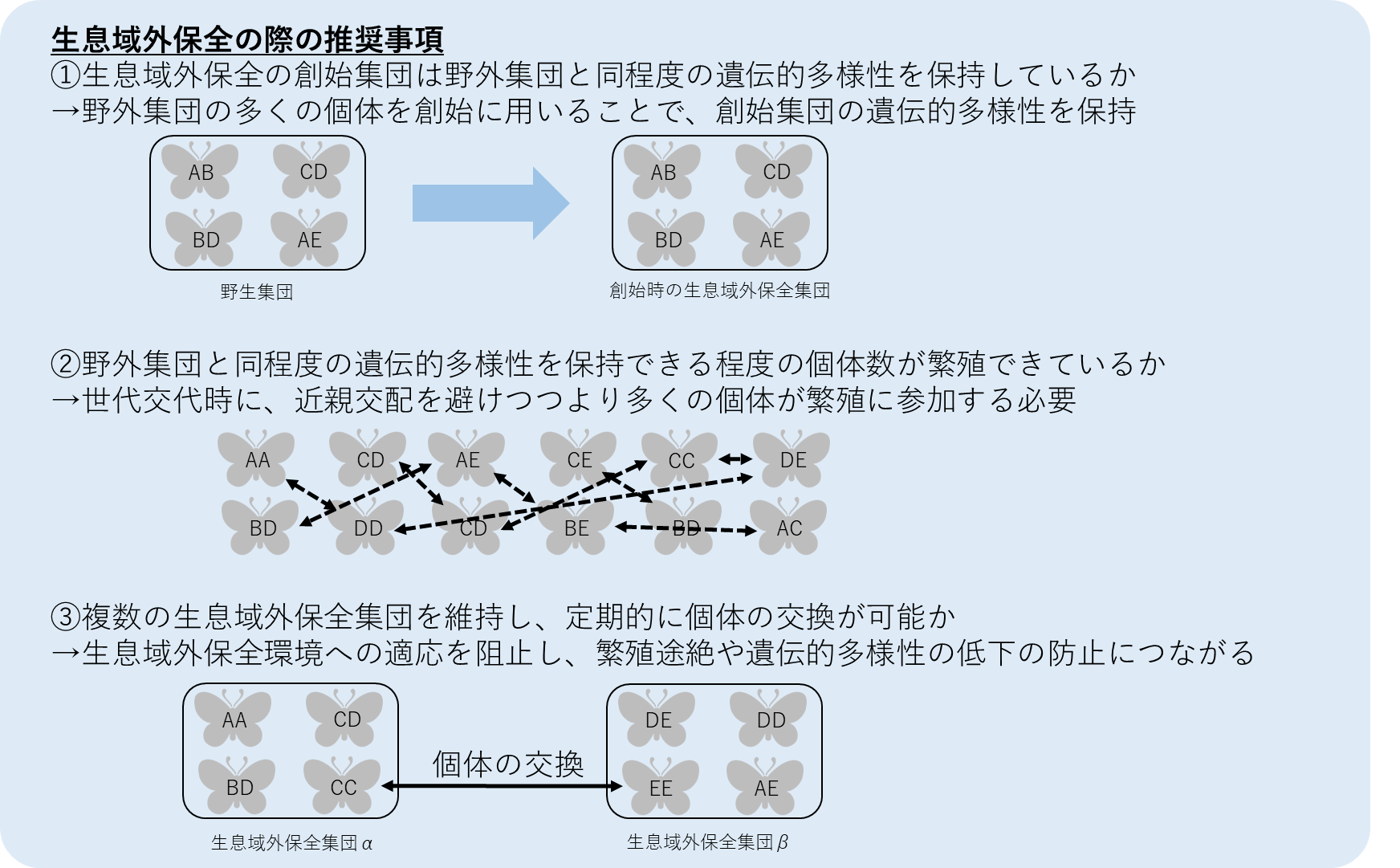
図1.保全遺伝学的な視点に基づく、生息域外保全事業の開始及び存続時の推奨事項。

図2.保全遺伝学的な視点に基づく、野生復帰 (再導入及び補強含む)実施時の推奨事項。