2013 Volume 30 Issue 1 Pages 32-35
2013 Volume 30 Issue 1 Pages 32-35
原発性アルドステロン症(PA)は,副腎組織からのアルドステロン過剰産生に伴い高血圧や重症な合併症を引き起こす病態である。通常,PAのうち術前にアルドステロン産生副腎皮質腺腫(APA)と診断された症例において手術が行われ,その後病理学的診断がなされる場合がほとんどであるが,時に腫瘍径が非常に小さいためその病理学的診断が困難なケースも決して稀ではない。その場合,免疫組織化学的検討による病変の同定が有用となる。また,APAとの鑑別診断ではアルドステロン過剰産生を伴う原発性副腎皮質過形成,すなわち特発性アルドステロン症(IHA)の病理学的診断についても十分理解しておくことが重要である。
原発性アルドステロン症(PA)は,病的副腎組織からのアルドステロン過剰産生による二次性高血圧の1つである。近年の報告では,スクリーニングによるPA患者検出の割合は全高血圧患者の5~20%程度とされている[1~5]。近年,選択的副腎静脈サンプリング(AVS)などによりPAの検出感度が上昇してきている。アルドステロン過剰は,腎尿細管を介したNa貯留に伴う血管volumeの増大に加え,心血管組織,腎糸球体,脳組織に対する直接作用により,高血圧,動脈硬化症,慢性腎疾患,脳血管障害などの発症や進展に関与している[6]。そのため,PA患者では同等の血圧の本態性高血圧患者と比較して心筋梗塞,狭心症や心房細動などの心疾患,脳出血や脳梗塞などの脳心血管障害の危険度が高く,腎障害も起こしやすいとされている[7]。以上の如く,頻度が決して少なくないことに加え臓器障害の可能性の高さから,PAスクリーニングの重要性が提唱される。PAの要因は,病理組織学的にアルドステロン産生副腎皮質腺腫(APA)とアルドステロン過剰産生を伴う原発性副腎皮質過形成,すなわち特発性アルドステロン症(IHA)の2つに大きくわけられる[8]。治療方針は,前者では手術による病変の切除が必要で,後者では原則薬物療法が適応とされる。したがって,PAとくにAPA手術検体では正確な病理学的診断が大切と考えられるが,APAの微小腺腫症例とIHAとの組織診断の鑑別は形態所見のみでは時に困難である。その場合,両者の鑑別には免疫組織化学的検索が有用である。本稿では,PAにおける病理学的診断について記述する。
APAはPAの約7~8割を占めるとされる。APAは通常片側であるが,稀ではあるが両側症例の報告もある[9]。肉眼的には,典型的なAPAは境界明瞭で割面は均一な黄色調(いわゆるgolden yellow)な腫瘍である。腫瘍径は,術前画像診断で同定される症例では10~20mmであることが多い一方で,術前画像診断では同定困難でAVSではじめてAPAが疑われる症例に対する手術例が近年増えてきている。後者では肉眼的に腺腫を同定することは不可能なため,病理側は提出された副腎組織を2mm程度の厚さで全割し,全て標本として病変を検索することが必要である。それらの腫瘍径は,1~10mm程度である。
組織学的には,典型的なAPAは主に類円形の核と淡明な細胞質を有する腫瘍細胞(いわゆる淡明細胞)の索状ないし胞巣状増殖で構成されていることが多い(図1)。症例によっては,種々の程度に好酸性の細胞質を有する緻密細胞が混在している。ここでは,正常副腎皮質でみられる球状層(ZG),束状層(ZF),網状層(ZR)といった副腎皮質に特異的な極性および配列の保持,いわゆるzonationの消失が重要である。APAを含む副腎皮質腺腫では,他臓器の腫瘍と異なり腫瘍辺縁と周囲の付随副腎皮質との間に明瞭な被膜形成はみられない。副腎皮質腫瘍では,良悪性を鑑別すべくWeissのcriteriaが用いられることが一般的である[10]。Weiss criteriaでは,副腎皮質腫瘍内で増殖している細胞の種類(淡明細胞 or 緻密細胞),核異型度,脈管侵襲,核分裂像,被膜への浸潤を含む9項目の有無について点数化を行い評価される(0~9点)が(表1),APA症例では通常0点のことがほとんどで時に1点相当の症例に遭遇する程度である。また,Cushing症候群の原因となるコルチゾール産生性副腎皮質腺腫(CPA)でみられるような,腫瘍内の炎症性細胞浸潤や脂肪変性はAPAではほとんどみられないのも特徴である。
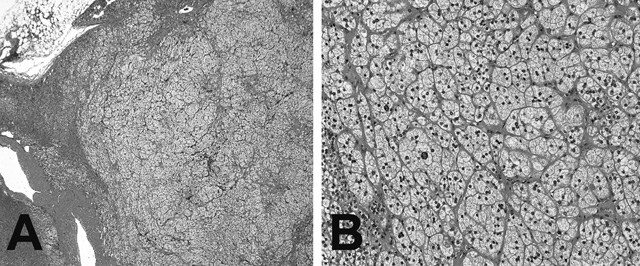
アルドステロン産生副腎皮質腺腫(APA)の組織像。主に軽度腫大した類円形核と淡明細胞質を有する腫瘍細胞の索状ないし胞巣状増殖からなる(A:低拡大,B:強拡大)。

Weiss criteriaによる副腎皮質腺腫と副腎皮質癌の鑑別
APAの付随副腎皮質では,多発性に副腎皮質結節がみられることが多い(図2)[8]。これは,APAに限らず高血圧や糖尿病などの動脈硬化性疾患を有する高齢者の副腎皮質でみられることが少なくない。その発症機序は,副腎皮質内の血管病変に伴う副腎皮質内血流の変化に伴う皮質細胞の代償性変化と考えられている。すなわち,副腎皮質内血流の低下によりその血流支配領域が萎縮する一方で周囲の副腎皮質が代償性に肥大するためと考えられている[8]。この非腫瘍性副腎皮質結節は,時としてAPA,とくに腫瘍径が10mm未満の微小APA症例との鑑別が困難な場合がある。したがって,APAの組織学的診断においては,増殖する腫瘍細胞間で軽度の核の大小不同やzonationの消失などの所見を丹念に検索することが重要である。

アルドステロン産生副腎皮質腺腫(APA)症例の付随副腎皮質組織像。結節が複数みられるが形態上副腎皮質のzonation消失は明瞭ではなく,非腫瘍性結節と判断される。
免疫組織化学的検索では,副腎組織における各ステロイドホルモン合成・代謝酵素の発現を理解することが重要である。とくに,3β-hydroxysteroid dehydrogenase(HSD3B)および17α-hydroxylase/17,20-lyase(CYP17)の発現パターンが病態を理解するうえで重要である。正常副腎皮質ZFでは両者が発現しているためコレステロールからコルチゾールが産生されるが,ZGではHSD3Bのみが発現しているためアルドステロン産生が行われる。APAでも,腫瘍細胞ではびまん性にHSD3B陽性であるがCYP17陽性像は腫瘍の全域~部分的に消失しており,結果的に腫瘍はアルドステロン産生過剰となる(図3)。APA周囲の非腫瘍性副腎皮質過結節では,両者の染まりのパターンに明らかな差は認められない。また付随副腎ZGでは,球状層が過形成性変化を呈しながらもHSD3Bの陽性像が低下・消失している(paradoxical hyperplasia)(図3)[11]。

アルドステロン産生副腎皮質腺腫(APA)症例の免疫組織化学的検討。腫瘍部では,HSD3Bがびまん性に陽性像を呈する(A)一方で,CYP17はほとんどの領域で陽性像が減弱・消失している(B)。付随副腎皮質球状層(ZG)では過形成性変化がみられるが,免疫組織化学的には同部でのHSD3B陽性像は減弱・消失している(C)。
IHAは,PAの約2~3割を占めるとされ,通常両側性である。IHAと診断された場合,薬物療法が治療方針の基本となるため近年はIHAの副腎組織を病理学的に検索することは稀であり,若年の重症高血圧症例などの特殊な症例でかつ患者本人の強い希望があった場合のみ手術検体を用いた病理学的検索が可能となる[12]。組織学的には,球状層全体に及ぶZGの過形成性変化が特徴とされる。免疫組織化学的には,IHAでは過形成性変化を呈するZGにおいてHSD3Bの強陽性像がみられる(図4)。このことは,APAの付随副腎でみられるparadoxical hyperplasiaとの大きな差となっており,とくに臨床的に微小APAが疑われるものの腫瘍部の同定が困難な症例ではこの部位のHSD3Bの陽性/陰性パターンがIHAとの鑑別診断に非常に有用である。

特発性アルドステロン症(IHA)の組織像。副腎皮質球状層(ZG)では過形成性変化を呈しており(A),かつ免疫組織化学的にはHSD3Bの強陽性像がみられる(B)。
上記の如く,PA副腎組織ではHE染色による形態学的所見に加え,免疫組織化学的検討が有用と考えられる。副腎皮質での免疫組織化学的検討の対象は,産生されるステロイドホルモンではなくそれらを合成・代謝する酵素,すなわちステロイドホルモン合成・代謝酵素である。異なるisoformの間のhomologyが非常に高いなどの理由から,これらの酵素に対する特異的抗体の作製は困難とされてきた。近年,アルドステロン産生に重要な働きをすると考えられているaldosterone synthase(CYP11B2) および11β-hydroxylase (CYP11B1)に対する特異的抗体の作製が報告された[13]。しかし,筆者らの経験ではAPAおよびIHAでのそれらの陽性像は症例間で異なり,また病変部にてHSD3Bのような陽性所見は明瞭でないことが多い。そのため,現時点でのこれらの抗体のPA病理診断における有用性は今後の検討課題である。
以上PA副腎検体における病理診断について述べたが,提出された検体の組織学的所見のみではなく,術前・術後の臨床情報,とくにAVSの結果や画像所見などを含む総合的な情報を加味しての診断が大切であると考えられる。