2014 Volume 31 Issue 4 Pages 284-289
2014 Volume 31 Issue 4 Pages 284-289
膵・消化管神経内分泌腫瘍(gastroenteropancreatic neuroendocrine tumor:GEP-NET)の罹患数の増加に伴い,病理医が組織診断を行う頻度も必然的に増加している。GEP-NETは,比較的典型的な組織像を呈するが,一部は他の外分泌系腫瘍に類似し診断に注意を要する。非典型的組織像を呈する症例の多くは,適切な免疫組織化学法により鑑別可能であるが,日常診療で遭遇する頻度は極めて少なく,未だ十分な理解が得られているとは言い難い。加えて近年では,超音波内視鏡の普及により,少ない組織量での診断を求められる機会が増加している。また,GEP-NETのWHO分類は,核分裂数とKi67 indexによって決定されるが,これは,その後の治療方針や予後予測に極めて重要な因子であるため,より再現性の高く客観的な評価方法が求められる。病理組織診断の注意点と最近のトピックスを解説する。
膵・消化管神経内分泌腫瘍(gastroenteropancreatic neuroendocrine tumor:GEP-NET)は,一部の例外的症例を除き,いずれの発生部位においても共通の組織像を呈し,病理診断が困難な場合は他の悪性腫瘍に比して比較的少ない。しかし,一部のGEP-NETでは例外的な組織像を示し,外分泌系腫瘍との鑑別が難しい場合がある。従って,典型的組織像に加えて,例外的な組織像を認識しておくが重要である。加えて,近年では,超音波内視鏡下穿刺吸引術(endoscopic ultrasonography guided fine needle aspiration biopsy:EUS-FNA)が普及し,小さな検体での適切な病理診断をすることが望まれる。
GEP-NETのうち,gastrointestinal NET(GI-NET)は,肉眼的に粘膜下腫瘍の形態を示す。腫瘍は粘膜固有層の最深部から粘膜下層にかけて境界明瞭な結節を形成し,表面には伸展し菲薄化した粘膜が被覆することが多い。Pancreatic NET(P-NET)の場合には,多くは充実性で灰白色調の割面を示すが,被膜の有無などは症例によって様々であり,周囲との境界が不明瞭な場合や,内部が空洞化する場合,腹腔側に突出する場合など,肉眼的所見は多彩である。
組織像と細胞像組織学的には,腫瘍細胞が索状胞巣や充実胞巣状,腺管状などの多彩な上皮様配列を示して増殖する(図1A)。組織構築は同一腫瘍の内部でも多彩性を示す場合が多いが,個々の細胞形態は概ね一様にみられる場合が多い(図1A,B)。胞巣間には細血管や細血管性間質が編み目状に多数介在する。腫瘍細胞は細胞質に内分泌顆粒を有するため,淡好酸性細顆粒状にみられる(図1B)。核は類円形~楕円形で核縁は平滑で,核膜が明瞭に観察される。“Salt-and-pepper pattern” と呼ばれる,粗い核クロマチンが核内に均等に分布する特徴的な核所見を呈する(図1B)。このような核所見は,内分泌細胞に特徴的であるが,核の詳細な観察は組織診標本よりも細胞診標本が優れており,EUS-FNAによって採取される細胞診標本の診断的価値は高い(図2D)。EUS-FNAについては後述する。加えて,細胞診標本では,腫瘍細胞が緩い結合性を示して上皮様に配列し,腺癌や悪性リンパ腫との鑑別に有用な場合が多い(図3A)。
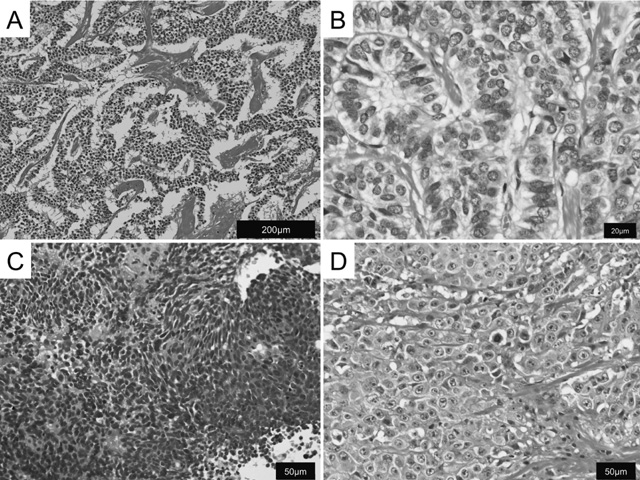
膵・消化管神経内分泌腫瘍の典型的組織像(Hematoxylin-Eosin染色)。A)高分化型神経内分泌腫瘍の弱拡大像。索状/リボン状配列を示し,均質な類円形核を有する細胞が増殖する。胞巣間に細血管性間質が介在する。B)高分化型神経内分泌腫瘍の強拡大像。核は類円形で核クロマチンは粗造に分布する。核小体は目立たない。細胞質は淡好酸性で顆粒状を呈する。C)小細胞型神経内分泌癌の強拡大像。N/C比の高い小型細胞がびまん性に増殖する。D)大細胞型神経内分泌癌の強核大像。大型で異型の強い細胞がびまん性に増殖する。明瞭な核小体を有する。

神経内分泌腫瘍の免疫組織学的所見。A)Chromogranin Aは細胞質に顆粒状に染色され,高い特異性を示すが,染色性が弱い症例や陰性も存在する。B)Synaptophysinは感度が高く多くの症例でびまん性に陽性を示す。C)NET G1におけるKi67。腫瘍細胞では陽性細胞がほとんど認められない。染色されている細胞の多くは,血管内皮細胞と考えられる。D)大細胞型神経内分泌癌におけるKi67。ほとんどの腫瘍細胞で染色性が認められ,Ki67 index 98%と判定された。
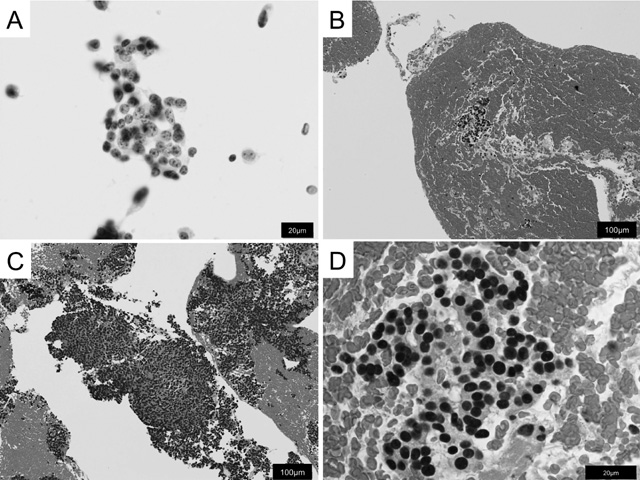
膵神経内分泌腫瘍の超音波内視鏡下穿刺吸引術標本。A)細胞診検体のPapanicolau染色。類円形で均質な核を有する細胞が緩い上皮様配列を示す。クロマチンは粗大で核小体は目立たない。B)組織診検体のHematoxylin-Eosin染色標本の弱核大像。組織は多量の血液を含み,少量の腫瘍組織が浮遊するように観察される。C)多量の腫瘍細胞が血液に混じて観察される。採取される組織量は症例によって異なる。D)類円形~楕円形で均質な核を有する細胞が索状に配列する。
形態的に神経内分泌腫瘍が疑われた場合,免疫組織学的に内分泌分化を確認することが必須である。内分泌マーカーの中で,特異性と感度の両者が高い抗体として,chromogranin A(ChA)とsynaptophysin(SYN)が推奨される(図3A,B)[1,2]。このうち,ChAは特異性が極めて高いが,感度はやや低く,特に低分化型NETでは陰性症例も多い(図2A)[3]。SYNは感度が高いが特異性はChAに劣るため,SYNのみが陽性である場合には,他の腫瘍とさらに鑑別を要する(図2B,鑑別疾患については後述)。
WHO分類上記の組織学的特性に加えて免疫組織学的に内分泌分化が確認された場合は,NETと診断され,次にWHO分類を行う[2]。GEP-NETのWHO分類は,核分裂像とKi67 indexを算出し,NET G1,NET G2,neuroendocrine carcinoma(NEC)の3つのグレードに分類する(表1)[2]。核分裂像,Ki67 indexのいずれも,まず弱拡大で広い範囲を観察して,最も多い視野(hot spot)で計測を行う[1,2]。核分裂像は強視野(400倍)で10視野,Ki67 indexは2,000個以上の腫瘍細胞を観察する(図2C,D)。NET G1とNET G2は上記のような組織学的特性を有し,高分化型NET(well-differentiated NET)と呼ぶ。一方で,増殖能の極めて高いNECでは,上記のような組織学的特性が認められず,強い核異型や多形性,びまん性増殖,壊死などを伴い,内分泌腫瘍に特徴的な所見が乏しく,低分化型NEC(poorly differentiated NEC)と呼ぶ。低分化型NECは,組織学的にsmall cell NECとlarge cell NECに分類される(図1C,D)[2]。しかし,実際には細胞増殖能が高くWHO分類でNECに分類される腫瘍の中にも,“高分化型NET” に相当する組織形態を示す腫瘍も存在し,現行の “NEC” は組織学的特性によって細分化される可能性も考えられる[4]。

WHO分類[1];核分裂数とKi67 indexによってNET G1,NET G2,NECに分類される。
組織学的に,NETの成分と外分泌腫瘍が混在し,両者とも30%以上の領域で認められる場合,mixed adenoneuroendocrine carcinoma(MANEC)に分類される。MANECではNET成分の占める割合や細胞増殖能は様々であるが,NET成分の細胞増殖能は予後に密接な関係を有するため,MANECのNET成分のWHO分類を評価する必要がある[5]。MANECは圧倒的に消化管に多い。一方,膵臓では,腺房細胞癌の成分に内分泌分化を伴うmixed acinar-endocrine carcinomaのように内・外分泌両者の分化を有する腫瘍が存在するが,その頻度は極めて低い[6]。
近年では,EUS-FNAの普及により,膵管との連続性のない膵腫瘍においても,経腸管的に組織の採取が可能となった。EUS-FNAで採取される検体は,液体成分と固体成分からなり,このうち液体成分は細胞診標本やセルブロック法により観察する(図3A)。固体成分はホルマリン固定後に組織診標本として観察する(図3B-D)。組織診標本では,組織片が血液中に浮遊するように観察されるが,組織量は症例により様々である(図3B,C)。一般的に,ホルマリン固定後に細胞は種々の程度に収縮するが,収縮の程度は生検組織などの小さい検体でより強く,核が濃染し,細胞質が狭くみられることがあるため,高分化型NETにおいてもsmall cell NECや悪性リンパ腫などと類似することがある(図3C,D)。膵腫瘍の中でNETと組織学的特徴の類似する疾患としては,solid-pseudopapillary neoplasm(SPN)やacinar cell carcinoma(ACC),一部にductal adenocarcinomaが挙げられる。特に,SPNは小型で類円形の核を有し多数の細血管が観察される点でNETと組織学的な共通性が強い。加えて,SPNは免疫組織学的にChAを除く内分泌マーカーが陽性となる点やprogesteron receptorを発現する点などの共通性があり注意を要する[2,7]。SPNにおいては,血管に対して細胞が垂直な配列を示す偽乳頭状構造や,介在血管壁の硝子化,コレステリン結晶,石灰化,壊死などの多彩な変性像が特徴とされる。現時点でP-NETとSPNの鑑別に最も有用な所見はSPNにおけるβ-cateninの核内発現である[2,7]。ACCは髄様で境界明瞭な腫瘤を形成し,しばしば壊死や出血を伴う。P-NETに比して核異型は強く明瞭な核小体を有し,小管腔構造が密在し腺房に似た細胞配列を特徴とする。細胞が好酸性顆粒状にみられるため,oncocytic NETでは組織像が類似し鑑別が難しい場合がある。細胞が全体に均質である点や時に索状配列を示す点などはP-NETの組織学的特徴と類似しており,慎重な鑑別を要する。ACCでは,細胞質内にdiastase抵抗性のzymogen顆粒が観察される。またACCでは,BCL10,chymotrypsin,trypsin,lipaseが種々の程度に発現する[8]。ACCでは,腫瘍の一部でChAを含む内分泌マーカーの発現をみる場合がある。内分泌マーカーの陽性が広い範囲(25%以上)で見いだされる場合には組織学的にmixed acinar endocrine carcinomaと診断される[6]。NETは,時に強い核異型や多形性を示す。この場合,large cell NECや退形成癌(anaplastic carcinoma),低分化型腺癌(poorly differentiated adenocarcinoma)などの悪性度の高い腫瘍との鑑別を有する。NETの場合には,核異型の程度が必ずしも悪性度を反映しないことが知られており,EUS-FNAのように少ない組織量においても,Ki67 indexを必ず測定する必要がある。
EUS-FNA検体におけるKi67 indexKi67 indexは,EUS-FNA検体のように腫瘍の一部のみ観察している場合には,腫瘍内のheterogeneityによって必ずしも全体の悪性度を反映していない場合が想定される[9]。Hasegawaらは,同一症例のKi67 indexを,EUS-FNAで評価されたWHO分類は,評価可能な腫瘍細胞が十分量(2,000個以上)採取されている場合には,手術検体で評価されたWHO分類と90%の高い再現性が得られることを報告した[10]。従って,EUS-FNAの診断では,Ki67 indexの評価とともに,腫瘍の組織量にも注意を払う必要がある[10]。ただし,特にKi67 indexが低い場合には,NET G1とNET G2の再現性は低いとの報告もあり,WHO分類の確定は手術検体で行うことが推奨される[1,9]。近年では客観性の高い評価方法として,画像解析装置を用いたKi67 index自動計測方法の有用性に注目が集まっている[11]。しかし,画像解析装置は,形状や色などのパラメーターから,腫瘍細胞のみを正確に認識させるため,観察者の判断でパラメーターの閾値を設定する必要があるため,厳密な意味では客観的な手法とは言い難い。
Multiple endocrine neoplasia type 1(MEN1)を背景に発生するGEP-NETの場合,下垂体や副甲状腺などの他内分泌臓器の腫瘍に加え,膵・消化管にも複数の病変が観察され場合が多い[12]。特に,画像的で描出されない小さな病変が病理標本上で認められることがある。MEN1を背景とするGEP-NETは,機能性NETと非機能性NETが混在し,またinsulinomaやgastrinomaが同一症例中に存在するなど,多機能性NETである場合が多い[12]。特に,臨床的に機能性NETと診断がなされている場合には,通常よりも切片を多く作製し,責任病巣を免疫組織学的に確認する必要がある。また,von Hippel Lindau病(VHL)は,VHL gene変異により中枢神経や網膜の血管芽腫の他,腎細胞癌や膵腫瘍など,多臓器に腫瘍が発生する。このうち膵腫瘍ではserous cystic neoplasm(SCN)とP-NETが,それぞれ10~20%程度の頻度で生じる[13]。VHLは,clear cell NETと呼ばれる淡明な細胞質を有するP-NETがしばしば生じるが,SCNや腎細胞癌も,細胞質が淡明である点で,clear cell NETと組織像が極めて類似する場合がある。Clear cell NETやlipid rich NETは細胞質に脂質を含有するが,SCNや腎細胞癌では主として糖原の含有により細胞が淡明にみられる点で異なる。免疫組織学的に,SCNは低分子サイトケラチンを強く発現する他,MUC6やinhibinが陽性となる点でP-NETとは異なる。しかし,SCNでは,しばしばSYNやneuron-specific enolase(NSE)が陽性となるため注意を要する[14]。また,clear cell NETは,VHLに特異的とする報告もみられるが,sporadicに発生するNETやMEN1症例においても腫瘍細胞の一部が淡明にみられる場合もある。
Somatostatinは視床下部や腸管や膵臓に分布する内分泌細胞において産生され,血中に分泌されるペプチドホルモンである。Somatostatinは全身に分布する内分泌細胞にsomatostatin receptor(SSTR)を介して作用し,様々なホルモン分泌を抑制する。Somatostatin analog(SA)製剤は,somatostatinと同様に,SSTRに結合することでNET細胞におけるホルモン分泌を抑制し,機能性NETの症状を改善する。また,SA製剤はホルモン分泌抑制作用に加え,細胞増殖抑制効果を示し高分化型NETにおける腫瘍の進行を抑制する[15,16]。SA製剤はSSTRに結合することで効果を発揮するため,治療方針の決定のためにSSTRの発現状況の検索が必要となる。SSTRの発現状況は,欧米では一般的にsomatostatin receptor scintigraphy(SRS)によって評価されるが,本邦では現在までにSRSが未承認であるため,SSTRの発現状況は免疫組織学的に検索する。Volanteらは,免疫組織化学法とSRSにおけるSSTR検出の再現性を検討した所,免疫組織化学法では腫瘍細胞の細胞膜に陽性である場合,SRSとの結果に相関が認められることを報告しており,SSTRの評価には細胞膜発現を重視すべきである[17]。
EUS-FNAによる診断は組織量が少ない場合や組織の収縮や挫滅がみられる点などから観察が難しい場合があるが,細胞診標本の観察や免疫組織化学法と組み合わせることで,適切な診断を得ることができる。稀に例外的組織像を呈する症例が存在するため,想定される組織像を知っておくと適切に他疾患との鑑別を行うことが可能となる。また,新しいWHO分類は核分裂数とKi67 indexのみからなる簡便な分類方法であるが,同一腫瘍内にheterogeneityがあることを前提に臨床医に報告する必要がある。加えて,SSTR発現の有無は,特に機能性NETや進行性高分化型NETにおいて治療法の選択に関わる重要な因子であり,免疫組織化学法により適切に評価する必要がある。