2014 Volume 31 Issue 4 Pages 298-302
2014 Volume 31 Issue 4 Pages 298-302
外科治療によって切除不能な膵神経内分泌腫瘍に対する治療法について,
①機能性神経内分泌腫瘍の内分泌症状の薬物療法
②抗腫瘍薬による薬物療法
③肝転移に対する外科治療以外の局所療法
④集学的治療
⑤放射線療法
に分け,多くは膵・消化管神経内分泌腫瘍(NET)診療ガイドラインに準拠して説明する。
非切除膵NETに対する治療法を選択する際には,組織学的grade,肝転移の程度,内分泌症状の有無,患者の全身状態,使用可能な治療法などから見た総合的な判断が必要である。
膵・消化管NETの内分泌症状は患者のQOLの低下と多くの患者で予後の悪化につながるため,複数の薬物療法が用いられている。ソマトスタチンアナログと,その他の疾患特異的な薬物療法がある。
ソマトスタチンアナログソマトスタチンはほとんどの膵消化管ホルモンの分泌を抑制する生理的な調節因子であり,内分泌症状の治療に適切であるが,その半減期が短い。それを克服するために,ペプチダーゼによる分解を起こりにくくしたソマトスタチンアナログが開発されている。現在使用可能な薬剤は,オクトレオチドであるが,月一回の注射で効果を発揮する徐放製剤が使用できる[1]。その有効性は,ガストリノーマ,カルチノイド症候群では高いが,インスリノーマでは症例によって効果の弱い場合がある。この場合には,ソマトスタチンアナログによってグルカゴン分泌も抑制されるため,低血糖発作が増悪する場合もあるので注意が必要である。オクトレオチドの徐放剤を用いる場合は,初回注射後の2週間は血中濃度上昇か不十分であるので,皮下注製剤の一日3回注射を併用する。また,徐放製剤でコントロール不十分になった場合に,皮下注製剤を追加使用してコントロールを図る場合がある。
特異的治療ガストリノーマによる消化性潰瘍の治療,下痢などの内分泌症状に対しては高用量のPPIが推奨される。
VIPオーマによる急激な下痢による脱水症状に対して,電解質液の大量の補液が推奨される[2]。
インスリノーマによる急性期低血糖に対して高濃度のブドウ糖補充が有効であるが,低血糖発作の頻度の抑制にジアゾキシドやエベロリムスが有効なことがある[3,4]。
グルカゴノーマによる遊走性壊死性紅斑にアミノ酸と脂肪酸の定期的輸注が有効である。
カルチノイド症候群の下痢に対してロペラミドなどの止痢薬が有効である[5]。消化器症状に対してオンダンセトロンの有用性が報告されている(この目的では本邦未承認)。稀に消化管以外の神経内分泌腫瘍でカルチノイド症候群が起こることがある。ソマトスタチンアナログや症状に応じた特異的治療が行われる。カルチノイドクリーゼが手術,麻酔,生検,腫瘍の触診,ストレスなどによって引き起こされることがあり,その際は血漿製剤の輸注とソマトスタチンアナログによる治療が用いられる。手術や麻酔,生検を予定しているカルチノイド症候群患者にはソマトスタチンアナログの術前使用が推奨される。
進行期の膵NETに対して抗腫瘍効果を目指して用いられる抗腫瘍薬は,G1/G2の腫瘍とG3の腫瘍で異なる。
G1/G2の膵NETに対してmTOR阻害薬のエベロリムス,チロシンキナーゼ阻害薬のスニチニブが用いられる。一方,G3の腫瘍に対しては白金製剤を中心とした化学療法が用いられる。
化学療法剤としてG1/G2の進行期内分泌腫瘍に対してストレプトゾトシンの治験が行われ,保険承認申請されている。現在,広範囲の進行期の神経内分泌腫瘍に対してソマトスタチンアナログのランレオチドの単独治療が進行中である。
膵NET(G1/G2)に対する抗腫瘍効果を目指した全身薬物治療は,切除不能例のうち腫瘍が増大する症例や,腫瘍量が多く,腫瘍増大が起こると臓器機能や生命にかかわる恐れのある例が適応となる。ランダム化比較試験では最近エベロリムス[6],スニチニブ[7]がそれぞれプラセボと比較して,有意な無増悪生存期間の延長を示し保険承認された。ストレプトゾシン+ドキソルビシン[8]も他の治療レジメンに比べて有意な生存期間延長を示す(表1)。

膵NET(G1/G2)に対するランダム化比較試験の成績
その他の抗癌剤(ダカルバジン,テモゾロミド±カペシタビンなど),インターフェロン,ソマトスタチンアナログ,なども一定の抗腫瘍効果が報告されている(いずれも保険未承認)が,膵NETを対象としたランダム化比較試験の報告はない。膵および消化管NETを対象としたソマトスタチンアナログ単独,インターフェロン単独,2剤併用の3群を比較するランダム化比較試験では,抗腫瘍効果や無増悪生存期間は各群間に明らかな差はなかった[8]。
膵NEC(G3)に対しては病理学的・臨床的に類似である小細胞肺癌でのエビデンスに準じ小細胞肺癌の治療に準じ,白金製剤をベースとする併用療法(エトポシド+シスプラチン[9],イリノテカン+シスプラチン[10]:いずれも保険未承認)が用いられ,高い奏効割合が報告されているが,ランダム化比較試験は実施されていない(表2)。小細胞肺癌と同様にNECは化学療法の感受性は高くいずれの治療でも高い奏効率が得られるが,治癒が得られることは極めて稀であり,増悪後の腫瘍進展速度は早く予後不良である。推奨される有効な二次治療はない。
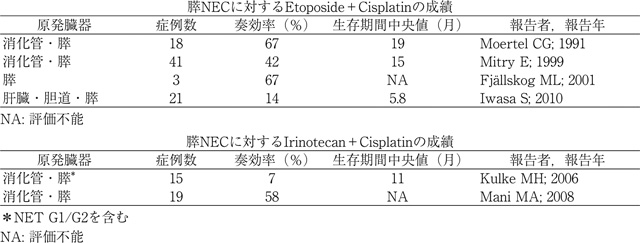
膵NECに対するランダム化比較試験の成績
膵消化管NETの切除不能肝転移に対して用いられる局所療法はTAEとTACE,腫瘍焼灼術である。TAEおよびTACEが,高腫瘍量の肝転移の局所治療として推奨される。また,切除不能の肝転移巣を有するが,数が限られている場合には,腫瘍焼灼術が推奨される[11,12](図1)。
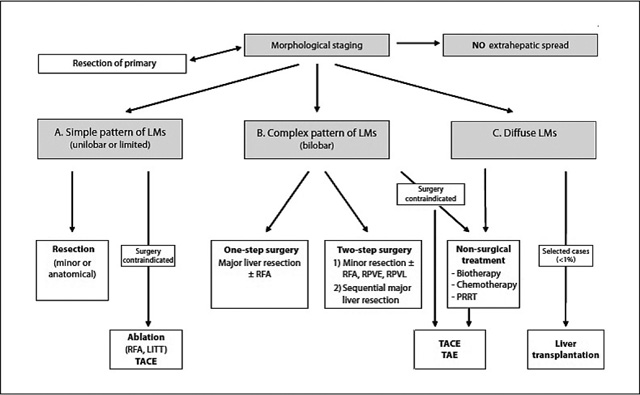
肝転移に対する治療法の選択(肝外転移のない場合)
Steinmuller T, et al, Neuroendocrinology 84:46, 2008より引用
NETの肝転移は疼痛や腫瘍浸潤による症状,もしくは内分泌症状が認められるまで気付かれないことも多く,肝転移を伴った症例の80~90%は診断時,既に治癒切除が困難である。膵・消化管NETのQOLや5年生存率の向上には肝転移巣の制御が重要であり,内分泌症状のコントロールにも寄与する。NETの肝転移は血流が豊富であり,腫瘍への血流は90%以上肝動脈から供給されており,肝細胞癌と同様にTAEやTACEがNETの肝転移(特に高腫瘍量)の局所治療として有用である。門脈腫瘍塞栓や腹水の存在は当治療の積極的な適応としない。周術期の抗生物質投与は少なくとも3日間は肝膿瘍の形成予防目的に行うことが推奨される。TAEの症状緩和効果については,部分的に改善した症例も含めると90%のresponseがあり,効果は6~27カ月持続し,TACEでは症状緩和効果が50~90%の症例で認められ,6~53カ月持続すると報告されている。TAE,TACE後のTTPは消化管原発を含むNETで12~24カ月,膵NETで10~19カ月である。TAE後の生存率に関する報告は様々で,5年生存率が0~71%(中央値50%),生存期間中央値も20~80カ月と幅がある。一方,NECのTAE後の生存期間は15カ月との報告がある。TACE後の5年生存率は40~80%,生存期間中央値は32~50カ月と報告されている。カルチノイド症候群をきたすNETでは塞栓術中や術直後にカルチノイドクリーゼをきたす例があり,術前のソマトスタチンアナログの投与が重要である。
切除不能の肝転移巣を有するが,数が限られている症例では,腫瘍焼灼が有用なことがある[1,2,8]。実際には,焼灼法にはラジオ波焼灼術(RFA)が用いられることが多く,経皮的もしくは開腹下/腹腔鏡下に施行される。RFAに適した腫瘍径については3cmが予後を規定する重要な因子とされている。また,腫瘍径が<3cm,3~5cm,>5cmの各群におけるRFA後の局所再発を比較すると<3cm群が有意に低かった。NET肝転移巣に対する腹腔鏡下RFAは,腫瘍が両葉にわたり14個以下の個数で,腫瘍総ボリュームが全肝の20%以下にとどまっている患者が良い適応とする報告がある。
NET肝転移巣への単独治療としての肝動注化学療法の報告は稀で,NCCNおよびENETSガイドラインでも抗癌剤の肝動注療法についての記載はない。最近,5-FUの肝動注療法を先行し,その後TACEを組み合わせる報告もある。
腫瘍減量手術により症状や予後の改善が見込める場合,あるいは消化管・胆道通過障害に対するバイパス術の適応がある場合には,外科医との連携による集学的治療が推奨される。
膵・消化管NETの肝転移は生命予後に影響を及ぼす因子であり,その多くが切除不能多発肝転移で発見される。後ろ向きの解析ではあるが,完全切除不能肝転移に対する減量手術を含む集学的治療の有効性が報告されている。その際,90%以上の腫瘍減量が望める場合に肝切除術やRFAによる減量手術の適応があると述べているものが多い。切除不能局所進行NETあるいは播種病変による消化管通過障害や閉塞性黄疸がある場合には,消化管切除術やバイパス術,胆道バイパス術,人工肛門造設などを考慮する。
切除不能転移巣が制御可能と思われる膵・消化管NETでは,原発巣を切除した方が生命予後を延長するとの報告があるが,膵切除などは侵襲が大きく合併症率も高いため,原発巣切除術に関しては原発巣の部位や患者の全身状態,期待される予後などを考慮した上で,慎重に適応を決定する必要がある。
転移性脳腫瘍に対して姑息的切除術や放射線治療が適応となる場合がある。転移性骨腫瘍が手術適応となることはほとんどないが,高カルシウム血症に対するビスフォスフォネートの投与,疼痛コントロールや病的骨折予防を目的とした放射線治療などを考慮する。また転移性骨腫瘍全体に対して,ビスフォスフォネート製剤,デノスマブなどの有用性が治験で明らかになり,保険適応となっている。デノスマブなどの骨吸収抑制作用の強い薬剤では,治療により著名な低カルシウム血症を生じ重大な問題を生じることがあるため,治療開始前の血清カルシウム濃度の測定による対処と治療後の頻回の血中カルシウム測定とカルシウム低下時の迅速な治療が重要である。高カルシウム血症や腎機能低下がない場合は,経口の天然型ビタミンDと経口カルシウム製剤の併用が必要である。
原発巣に対する外照射治療については,治療の有効性に対する十分なエビデンスがない。骨転移に対する疼痛緩和目的で外照射が有用である。骨シンチ陽性の多発骨転移に対し89Srによる疼痛緩和目的の内照射が有用であるが,いくつか注意点がある。
骨転移に対する外照射,89Srによる内照射膵・消化管NETからの骨転移のみに対する疼痛緩和についてのまとまった報告はないが,骨転移に対する疼痛緩和目的の放射線治療は,多くの固形癌にて有効性が示されている。放射線治療の疼痛緩和に関しての有効率は75~90%と高く,8Gy/1回照射,20Gy/5分割,30Gy/10分割,35Gy/14分割といった複数の線量分割が有効である。ただし,1回照射と分割照射では,寛解率や完全寛解率に差が見られないが,1回照射において同一部位への再照射率が高いことが複数のメタアナリシスで一致しているため,予後予測に基づいた線量,線量分割の選択が必要である。
放射線同位元素の89Srは造骨性骨転移病巣のみならず,混合型あるいは溶骨性骨転移病巣の周囲に存在する骨形成部位にも集積し,放出されるβ線が周辺の細胞を照射する。投与数時間後には帰宅可能で外来治療可能であり,3カ月程度の効果の持続がある。疼痛緩和は40%から95%と高く,外照射では対応が困難な多発骨転移の疼痛緩和や,脊髄線量の制限がないため外照射後の骨転移などに特に有用である。無作為化比較試験の対象疾患は乳がん前立腺がんが多くNETについての成績が少ないことと,腫瘤形成性の骨転移巣や骨折リスクの高い溶骨性病変に対しては外照射のような骨折回避や脊髄圧迫症候群を回避する効果は期待しにくいことに留意する必要がある。
Peptide receptor radionuclide therapy(PRRT)について膵・消化管由来のNETがSSTRを高率に発現していることから,ソマトスタチンアナログに放射線同位元素を標識した薬剤を用いるPRRTが開発され,海外の一部の施設で臨床応用されている。海外において,[90Y-DOTA0,Tyr3]-Octreotideや[177Lu-DOTA0,Tyr3]-Octreotateなどを用いた複数の第Ⅰ相試験,第Ⅱ相試験にて良好な抗腫瘍効果,およびQOLの改善が報告されているが,ランダム化比較試験はない。わが国においては,放射性同位元素に対する法的規制の問題もあり,現時点では臨床試験も含めて使用されていない。