2014 Volume 32 Issue 1 Pages 8-13
2014 Volume 32 Issue 1 Pages 8-13
悪性腫瘍に対する薬物療法は,分子標的薬を軸とした戦略に急速に移行しつつある。進行再発甲状腺癌も例外ではなく,本邦でも2014年にソラフェニブが放射性ヨウ素治療抵抗性分化癌に対して保険収載され,進行再発甲状腺癌の治療も大きな転換点を迎えている。しかし,分化癌の放射性ヨウ素治療抵抗性の判断も含め,分子標的薬を「どのような症例」に,「いつから」導入するべきかの判断には,慎重であるべきと考えられる。患者に最大の利益を提供するためにも,甲状腺癌のbiologyを熟知した上での適応患者の選択と,治療によるbenefitとharmを十分に考慮した分子標的薬の適正使用が肝要である。また,放射性ヨウ素治療を適切に行うためには,適切な手術が施行されていることが大前提であり,甲状腺外科専門医の果たすべき役割は重要である。一方,進行甲状腺分化癌の治療では,腫瘍の局所での進行や未分化転化する可能性を念頭に治療を行うことも必要であり,診療にあたるチームが協力して,新規治療薬を「適切」な症例に「安全」に使用し,エビデンスを構築していくことが必要と考えられる。
これまで甲状腺癌の薬物療法でエビデンスレベルの高いものは,分化癌術後の高リスク症例に対する甲状腺ホルモン補充によるTSH抑制療法の予後向上効果(2010年版本邦ガイドライン推奨グレードB,NCCNガイドライン2014 Ver.2,category 2A)以外にはない[1,2]。薬物療法以外では,甲状腺全摘術を施行した分化癌高リスク症例に対する術後の放射性ヨウ素によるアブレーションによる局所制御率や無病生存率の向上が示されているが[3],アブレーションが生命予後の向上に貢献するかという点は議論の残るところである。
一方,分化癌の遠隔転移や切除不能な再発に対しては,放射性ヨウ素の大量内用療法が標準的な治療として行われてきた。しかし,放射性ヨウ素に耐性となった分化癌に対する薬物療法はなかなか進歩が得られず,未分化癌や進行再発髄様癌と同様に,本邦ではこれらの症例に対しては,甲状腺外科を専門とする施設毎に様々な化学療法や放射線外照射が試みられてきたと考えられる。
悪性腫瘍の分子生物学的解析が進み,悪性腫瘍に対する薬物療法は,腫瘍に特異的な増殖に関与する分子やシグナル伝達経路を標的とした分子標的薬を中心とした戦略に急速に移行しつつある。進行再発甲状腺癌も例外ではなく,既に米国では再発または遠隔転移を有する髄様癌に対するバンデタニブ,カボザンチニブと放射性ヨウ素抵抗性進行分化癌に対するソラフェニブがNCCNガイドラインに記載されており[2],本邦でも2014年にソラフェニブが保険収載されるに至り,進行再発甲状腺癌の治療は大きな転換点を迎えている。
さらに,髄様癌は発生母地が分化癌と異なりヨウ素取り込み能がないことから,遠隔転移を生じた場合には分化癌とは異なる治療戦略がこれまではとられていたが,いずれの腫瘍においても,RET,VEGFR,PDGFRなどの受容体型チロシンキナーゼから始まるMAP kinase経路とPI3K/AKT/mTOR経路が重要だということがわかり,分化癌,髄様癌でシグナル伝達を抑える共通の治療戦略の開発が始まっている。さらに,分子標的薬は未分化癌に対しても抗腫瘍効果が得られる可能性が期待されており,これから数年で進行再発分化癌だけてなく,髄様癌,未分化癌も含めた進行甲状腺癌全体の治療が大きく変わることが期待される。
しかし,髄様癌,分化癌ともに,転移再発後も比較的緩徐な経過を示す症例も多く,副作用が少なくない分子標的薬を,「どのような症例」に,「いつから」使用を開始するべきか,その判断には慎重であるべきと考えられる。米国のNCCNガイドラインにおいても,進行が緩徐で無症状である場合には,分子標的薬の導入と併記する形で慎重な経過観察(watchful waitingまたはobserve)が提示されており,髄様癌や分化癌の進行には個体差があるので,進行のペースを考慮した治療の選択が必要と考えられている[2]。また,NCCNガイドライン,英国のBritish thyroid associationのガイドラインのいずれでも,kinase inhibitorのような分子標的薬の使用ではQOLを阻害することが予測されるので,有害事象のモニタリングと適切なマネジメントが施行できる施設で行われるべきことも明記されており[4],進行再発甲状腺癌に対する分子標的薬の適応の判断に際しては,甲状腺外科,放射線科,腫瘍内科,内分泌内科などで充分な検討を行うことが必要と考えられる。また,分子標的薬は非常に高額でもあり,医療費の補助制度を利用したとしても,長期間内服する場合の患者の医療費負担は無視できない場合もあると考えられる。患者に最大の利益を提供するためにも,分子標的薬の使用に際しては甲状腺癌のbiologyを熟知した上での適応患者の選択と,治療による恩恵(benefit)と有害事象(harm)を十分に考慮した分子標的薬の適正使用が肝要である。
本邦における甲状腺癌に対する分子標的薬治療は,国際共同第Ⅲ相臨床試験(14925試験)の結果をもとに[5],2014年6月に放射性ヨウ素治療抵抗性の分化癌に対するソラフェニブの適応拡大から始まった。海外においても放射性ヨウ素治療抵抗性の判断に際しては慎重な検討が求められているが[6],上述したような背景から,日本内分泌外科学会,日本甲状腺外科学会,日本核医学会は協力して「放射性ヨウ素治療抵抗性の局所進行性,再発・転移性分化型甲状腺癌に対する分子標的薬治療の適応患者選択の指針」を作成し[7],日本臨床腫瘍学会とも連携して,適正使用に向けた活動に取り組んでいる[8]。現在の指針に鑑み,過去に当科で経験した症例の中から,現時点でのソラフェニブの適応と考えられる症例を考察してみた。
67歳,女性。多発肺転移を伴う低分化濾胞癌の診断で,2011年5月,甲状腺全摘と頸部郭清(D1)を施行。手術から5カ月後の2011年10月に放射性ヨウ素(100mCi)内用療法を施行(図1)。甲状腺床と両肺に著明な集積が認められた。2012年7月と2013年4月にも同療法を行い,良好な多発肺転移への集積を認めていたが,TSH抑制下でのサイログロブリン値は徐々に上昇傾向を認め(図2),肺転移の一部にstable disease(SD)の範囲内だが増大傾向を認めていた。2014年1月に4回目の治療を行った際に,腰椎と右大腿骨にも集積を認め,その後に行ったCTで溶骨性変化を認め多発骨転移と診断した(図3)。また,多発肺転移も増大傾向が明らかとなった(図4)。

131Iシンチグラフィ所見(症例1)。1回目治療後は甲状腺床,両肺の転移巣に集積あり。2回目と3回目治療後も多発肺転移への集積は持続。4回目の治療後,腰椎と右大腿骨に新規集積の出現を認めた(黒丸)。

血中サイログロブリンとTSH値の推移(症例1)。TSH抑制下,放射性ヨウ素投与日のTSH上昇時ともに,サイログロブリン値の持続的な上昇が認められる。

腰椎CT所見(症例1)。放射性ヨウ素の集積が認められた腰椎に,溶骨性転移が出現している(矢印)。

胸部CT所見(症例1)。放射性ヨウ素治療中に多発肺転移巣の増加増大を認める。
この症例では,多発肺転移への放射性ヨウ素の集積は良好であったが,肺転移の進行と新規病変(骨転移)の出現を認め,放射性ヨウ素抵抗性と考えられる。今後,このような症例では,サイログロブリン値の上昇傾向を認めた時に短い間隔で画像診断での評価を行い,病勢の進行が明らかであれば,新規病変の出現の前に分子標的薬の導入を考慮すべきと考えられる。
【症例2】57歳,男性。局所進行低分化濾胞癌の診断で,2011年3月に甲状腺全摘と頸部および上縦隔リンパ節郭清(D3c)を施行。リンパ節転移を多数認め,転移リンパ節の前斜角筋前脂肪織への浸潤も認められたため,術後に入院による放射性ヨウ素内用療法を予定していた。しかし,治療を待つ間の術後7カ月目に胸椎転移が出現した(図5)。2012年1月に放射性ヨウ素治療を施行。2012年8月に2回目の治療を行い,治療後のシンチグラフィで多発肝転移が認められた(図6)。その後3回目の治療を行ったが,多発肝転移は急速に進行し(図7),手術から3年後に死亡された(図8)。

症例2の脊椎CT所見(左):放射性ヨウ素治療を待つ間に胸椎に溶骨性転移が出現(術後7カ月)。1回目の放射性ヨウ素治療後の131Iシンチグラフィ所見(右):甲状腺床に著明な集積が認められる。肝臓の集積は明らかではない。

症例2の2回目治療後の131Iシンチグラフィ所見(左):SPECT画像では肝臓に多結節性の集積が認められる。3回目治療後の所見(右):肝臓の結節状集積は持続。新たに複数のリンパ節に集積が出現。

肝臓MRI所見(症例2)。多発肝転移は短期間に急速に増加増大を認めた。
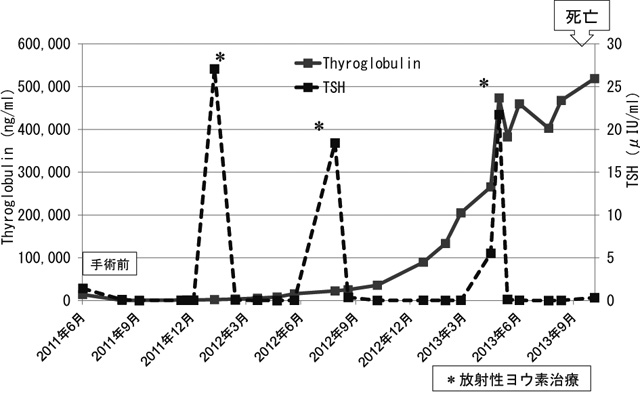
血中サイログロブリンとTSHの推移(症例2)。放射性ヨウ素治療中も持続的なサイログロブリンの上昇が続き,途中から急速に上昇した。
この症例では,放射性ヨウ素治療中に短期間で多発肝転移が出現した。肝転移への集積も認められたが,急速に病状は進行した。肝転移に対する放射性ヨウ素治療の効果は充分でない場合が多く,今後このような症例では,肝転移が確認された時点で,分子標的薬の導入を行うべきと考えられる。
以上,分子標的薬の適応と考えられる症例をこれまでの自験例から提示した。
放射性ヨウ素治療未実施の患者に対する分子標的薬の効果は臨床試験で検証されていないので,このような患者に対する分子標的薬の適応については,今後臨床試験を行い検討していくことが必要である。また,未分化癌や髄様癌に対する適応に関しても,現在行われている臨床試験や,適応拡大に向けた臨床試験の結果を待つ必要がある。
また,放射性ヨウ素治療の効果を適切に評価するためには,甲状腺は全摘されていることが大前提であるが,患者に不利益を与えないためには,分化癌に対する手術が初回治療から適切に行われていることが望ましく,切除可能なリンパ節転移や局所再発に対しては,外科的切除が優先されるべきである。放射性ヨウ素治療や分子標的薬治療を適切に行っていくためにも,甲状腺外科専門医の果たすべき役割は,今後さらに大きくなると考えられる。
一方で,進行甲状腺分化癌の治療では,頸部や縦隔での進行再発症例では,腫瘍の局所での進行に伴い生じる気管狭窄や食道狭窄,腫瘍からの出血や腫瘍の大血管への穿破による大出血などを念頭においた管理が必要である。腫瘍が静脈内や気管内に進展した症例では,分子標的薬が奏効した場合に起こりうる合併症を念頭において,慎重に適応を判断し管理することが必要であろう。また,進行分化癌では,治療中に未分化転化する可能性を念頭において治療を行うことも必要である。未分化転化を起こした際には,窒息を回避するための緊急気管切開術などoncologic emergencyとしての対応が必要になり,分子標的薬による治療中であっても甲状腺外科医の継続的な関与が必要と考えられる。これからの進行甲状腺癌の治療では,診療にあたるチームが,非常にindolentな状態からaggressiveなものまで個体差が大きい甲状腺癌のbiologyに対し理解を深め,協力して新規治療薬を「適切」な症例に「安全」に使用し,エビデンスを構築していくことが必要と考えられる。
本論文の要旨は第47回日本甲状腺外科学会学術集会(2014年10月30~31日,福岡市)にて発表した。