2022 Volume 39 Issue 3 Pages 190-193
2022 Volume 39 Issue 3 Pages 190-193
多くの甲状腺分化癌の予後は良好とされるが,少数の症例は再発・転移をきたし,さらに放射性ヨウ素治療,分子標的薬にも耐性となり,治療に難渋するものがある。本稿では分子生物学的予後因子として,遺伝子変異,とくに腫瘍の発症・進展に重要とされるドライバー変異について解説する。乳頭癌において,欧米を中心としてBRAF変異が癌の悪性度・予後と関連するという多くの報告があるが,我が国ではこれは否定的である。なぜこのような違いがあるのかについては良く分かっていない。濾胞癌では,RAS変異が悪性度・予後と相関するという報告がある。年齢と非常に強い相関があり,主に高齢者にみられるTERTプロモーター変異は,乳頭癌,濾胞癌,いずれも悪性度・予後と強い相関を示し,現時点で最も強力で有用な分子マーカーである。
甲状腺分化癌とは,甲状腺濾胞細胞から発生する癌のうち,乳頭癌と濾胞癌を合わせた分類で,その名の通り比較的に分化度が保たれ,TSH刺激による反応性,ヨウ素トランスポーターの発現によるヨウ素取り込み能,サイログロブリンの発現などがある程度みられるタイプの組織型であり,低分化癌や未分化癌と比較し予後が良い。しかし,一部の腫瘍は再発や遠隔転移をきたし,放射性ヨウ素治療や分子標的薬に不応となり,最終的には癌死する症例もある。本稿では分子生物学的予後因子として,遺伝子変異,とくに腫瘍の発症・進展に重要とされるドライバー変異を中心として紹介する。
まず,甲状腺分化癌においてドライバー変異によって活性化される細胞内シグナル伝達経路について述べる。甲状腺分化癌のうち,乳頭癌は主としてmitogen-activated protein kinase(MAPK)経路が,濾胞癌ではPI3K-AKT経路が,何らかの遺伝子異常によってそれぞれ恒常的に活性化されているとされる[1]。PI3K-AKT経路と比較して,MAPK経路の活性化は,甲状腺細胞の脱分化とより関連すると考えられている。各シグナル伝達経路とそれを構成する主要な分子を図1に示す。通常これらは,受容体型チロシンキナーゼなどによって制御されているシグナルであるが,これらの分子が遺伝子変異により変化すると,上流からのシグナルなしに恒常的に活性化して下流を刺激し続けると考えられている。乳頭癌,濾胞癌でみられる主要なドライバー変異とその頻度を表1に示す。原則的に,遺伝子変異は相互排他的で重複はみられない。これも,それぞれのシグナル伝達経路が分化癌の発症に重要な役割を果たしている証左とされる。TERTプロモーター変異は上記のシグナル伝達経路上の分子ではないが,極めて重要なドライバー変異・分子マーカーであり,詳細に後述する。以下,乳頭癌と濾胞癌に分け,主要なドライバー変異と悪性度・予後との関連を解説する。
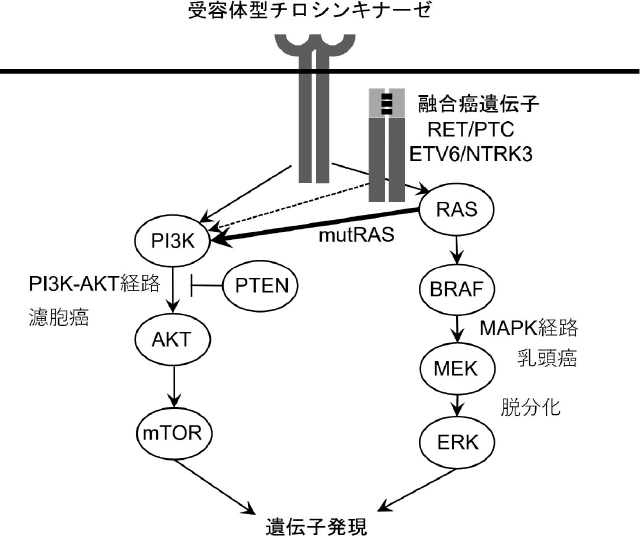
甲状腺分化癌に重要なシグナル伝達経路とその構成分子
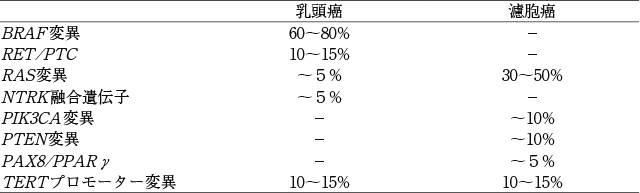
甲状腺分化癌における主なドライバー変異とその頻度
BRAF変異は,乳頭癌で最も頻度の高い遺伝子異常であり,乳頭癌の約60~80%に検出される。甲状腺乳頭癌でみられるBRAF変異は,そのほとんどが点突然変異によるp.V600Eであり,この変異によりRASからのシグナルなしに常に下流のMEKを活性化する。欧米からの報告を中心として,BRAF変異は乳頭癌の悪性度・予後と関連するという論文が数多く出された[2,3]。しかし,筆者らのグループのものを含む日本人症例を解析した結果では,関連に否定的なものが多い[4,5]。なぜこのような違いがあるのか,はっきりとした原因は不明だが,欧米,特に米国では乳頭癌の診断根拠となる核所見に関して,軽微な所見であっても乳頭癌と診断しているため,という可能性がある[6]。すなわち,日本では良性の濾胞性腫瘍や過形成による結節と診断されているものが,米国では乳頭癌に含まれている可能性である。これらにはBRAF変異はないし,予後も良好であろう。これを支持するデータの一つとして,欧米ではBRAF変異の頻度は40~60%であるが,本邦では60~80%と高いことが挙げられる。しかし,これだけでは理由を説明はできないようで,何からの人種差や地域差がある可能性もある。少なくとも本邦では,BRAF変異がある腫瘍は,変異がないものと比較して悪性度が高く予後が悪いとはいえず,このBRAF変異は予後因子としては有用ではなさそうである。ただ,後述するRAS変異などと違い,BRAF変異は癌でしか検出されず,この変異がある場合は,癌と診断することができる。またBRAF変異は,甲状腺濾胞細胞特異的な遺伝子の発現抑制に関連するとされ,これは臨床的にはヨウ素トランスポーターの機能が低下し,放射性ヨウ素治療への抵抗性につながると考えられる。しかし,これも本邦の症例での検討結果はない。もう一つ注意が必要なのは,これも後述するがTERTプロモーター変異との共存である。これはTERTプロモーター変異の項で説明する。
RET/PTCやETV6/NTRKなどの融合遺伝子これら融合遺伝子は,染色体の再配列,つまり染色体上の二箇所でDNA二重鎖切断が起き,間違った方と再結合した時に生じるものである。通常,受容体型チロシンキナーゼのC末端にあるチロシンキナーゼドメインをコードした領域と,全く別のパートナー遺伝子のN末端側が融合してできる。N末端側のプロモーターによって融合遺伝子の転写がなされ,またN末端側の部分には,通常coiled-coilドメインなど二量体形成を促進する部分があり,そのためリガンドの結合なしに二量体を形成し,自己リン酸化によって常にチロシンキナーゼが活性化した状態となる。RET/PTCとは,甲状腺乳頭癌(papillary thyroid carcinoma:PTC)においてみられるRET融合遺伝子という意味である。相手側のパートナー遺伝子によって15種類以上が同定されているが,RET/PTC1(CCDC6-RET)が最も多く,ついでRET/PTC3(ELE1-RET)であり,これら二つで90%を占める。成人乳頭癌での頻度は10~15%程度である。RET/PTCの次に頻度の高い融合遺伝子がETV6/NTRK3である。成人乳頭癌での頻度は5%程度である。その他,STRN/ALKなどの融合遺伝子もあるが,頻度は低い。これら融合遺伝子は,PI3K-AKT経路も活性化するとされるが,甲状腺細胞では主にMAPK経路を活性化するようで,乳頭癌のドライバー遺伝子と考えられている。また,融合遺伝子は年齢が若いほど頻度が上昇し,小児では30~50%とする報告もある。また,放射線誘発甲状腺癌でも頻度が高いといわれている。これら融合遺伝子と悪性度,予後との関連については,総じて確立されたものはない。ただし,低分化癌や未分化癌での頻度は低く[7],逆に融合遺伝子を持った癌は低分化癌への進行,未分化転化を起こしにくいのかもしれない。
RAS日本人乳頭癌におけるRAS変異の頻度は低く,自験例では5%未満である。欧米では15%程度はあり,これは上述したように,病理診断における核所見のとり方が異なっている可能性がある。変異RASは,甲状腺細胞ではMAPK経路よりPI3K-AKT経路を強く活性化するようで,濾胞癌で頻度の高い遺伝子変異である。濾胞癌の項で詳述する。
TERTプロモーター変異TERTは染色体のテロメア末端を伸長させる機能を持ち,細胞の無限増殖能の獲得に関わっている。TERTプロモーター変異とは,TERT遺伝子のプロモーター部位に二か所ホットスポットがあり,通常どちらか一方にのみ変異がみられる。この変異により,転写因子ETSファミリーの結合領域が作られ,TERTの転写を亢進させるといわれている。成人乳頭癌での頻度は約10~15%である。人種差,地域差などはなさそうである。また,年齢と非常に強い相関があり,自験例では45歳未満にはほとんどみられず,年齢とともに急増する。70歳以上では約半数にみられた。このTERTプロモーター変異は,癌の臨床病理学的な悪性度,予後と強い相関があり,現在のところ,甲状腺乳頭癌において最も強力な予後予測分子マーカーである[5,8]。上述したように,臨床病理学的な指標と相関するため,このTERTプロモーター変異が独立した予後因子かどうかについては,自験例では症例数が少ないため統計学的な有意差にはわずかに至っていないものの,効果量をみるに症例を蓄積すれば有意差がみられる,つまり独立した因子になりうると予想する。また,放射性ヨウ素治療抵抗性と関連するという報告もある[9]。
BRAF変異の項でも述べたが,乳頭癌ではTERTプロモーター変異を持つ腫瘍のほとんど全てにBRAF変異があり,多くの進行した症例を対象とする場合,TERTプロモーター変異を調べずにBRAF変異だけを調べた場合,間違った結論を導く可能性があることに注意したい。癌の悪性度,予後との相関を検討するには,このTERTプロモーター変異の解析が必須であろう。上で年齢との強い相関に言及したが,筆者は個人的には甲状腺分化癌のステージ分類に年齢が大きな役割を果たしている原因は,このTERTプロモーター変異にあると考えている。
TERTは,テロメア伸長以外にもNF-κBやβ-カテニン分子との相互作用によって癌の悪性度を高めているという報告があるが[10],どの作用が高度悪性化に効いているのか,未だ検証が必要であると感じている。
また,筆者らはTERTプロモーター変異がない乳頭癌でもTERTを高発現しているものがあり,これらも再発率が高いことを明らかにした[11]。これらは比較的若年者にもみられることがTERTプロモーター変異との大きな違いである。また,これらの腫瘍は臨床病理学的な悪性度とはあまり相関せず,TERTプロモーター変異と分子機序が異なっている可能性がある。こちらはmRNAの定量による相対的なものであり,分子マーカーとしての利用にはハードルが高い可能性がある。
RASには,NRAS,HRAS,KRASの三つのアイソフォームがあり,変異の種類もいくつか存在する。甲状腺癌ではNRAS,HRAS,KRASの順に頻度が高い。甲状腺細胞では変異RASはPI3K-AKT経路を強く活性化するようで,濾胞性腫瘍のドライバー変異と考えられている。ただし,RAS変異は濾胞癌だけではなく,頻度は低いものの濾胞腺腫にも検出されるとされ,必ずしも癌の指標とはいえない。濾胞腺腫,濾胞癌での頻度はそれぞれ10~30%,30~50%程度である。このRAS変異を持つ腫瘍は,遠隔転移などが多く予後不良とする報告がある[12,13]。ただし,上述したようにこの変異は濾胞腺腫にもみられ,濾胞腺腫と濾胞癌の病理診断が難しい症例があることを考えると,その意義にはやや慎重になる必要がありそうである。
その他RAS変異同様,PI3K-AKT経路を活性化する変異としてPTENの欠失やPI3Kのサブユニットをコードする遺伝子であるPIK3CAの変異や増幅も検出されることがある。また,PAX8/PPARγの融合遺伝子も検出されるが,その機能には不明な点が多い。これら濾胞癌でみられる遺伝子異常は,一般的に頻度は低いながらも濾胞腺腫でも検出される。いずれも現時点で確立した予後因子とはいえそうにない。
TERTプロモーター変異乳頭癌同様,濾胞癌でもTERTプロモーター変異と癌の悪性度,予後との関連が報告されている[14,15]。RAS変異の有無との関連や独立した予後因子かどうかには,解析症例数が少なく,十分な結論は出ていないようである[16]。また,乳頭癌同様,TERTプロモーター変異のない腫瘍でもTERTを高発現しているものがあり,これらも予後との関連があるとする報告がある[15]。いずれにしても,乳頭癌と比較して解析症例数や論文の数が少なく,予後因子であることは間違いなさそうであるが,さらなる解析が必要と思われる。また,多数の日本人症例を用いた報告もない。
以上,乳頭癌と濾胞癌について,分子生物学的な予後因子としてドライバー変異とその意義について解説した。上述したように,日本人症例では特にだが,TERTプロモーター変異が現時点で明らかになっている最も強力な予後予測分子マーカーである。ただし,その理由や治療のターゲットとなりうるかなどまだ不明な点が多い。筆者らは,この変異は甲状腺腫瘍の臨床で頻用される穿刺吸引細胞診に用いた針の洗浄液でかなりの率で検出できることを報告しており[17],術後のみならず術前にも予後予測マーカーとして利用できると考える。