2017 Volume 66 Issue 1 Pages 60-67
2017 Volume 66 Issue 1 Pages 60-67
本邦において主に用いられている液状化検体細胞診(LBC)法はThinPrep(TP)法,SurePath(SP)法,TACAS(TAC)法であるが,標本作製原理や試薬などが異なっているため,各標本での細胞の塗抹量や形態における差異が予測される。そのため,各々のLBC法について7つの細胞材料(肺,甲状腺,乳腺,子宮頸部,子宮内膜,尿,体腔液)を使用し,細胞学的所見を比較した。その結果,細胞の採取量と診断に値する目的細胞の出現量について,肺,甲状腺,子宮頸部,子宮内膜ではSPはTACおよびTPよりも,TACはTPよりも,有意に高値であった。乳腺,体腔液ではSPおよびTACはTPよりも有意に高値であった。尿ではSPはTACおよびTPよりも有意に高値であった。核クロマチンの状態と細胞質の保持について,尿では3法間で有意差を認めなかったが,他の材料ではSPおよびTACはTPよりも有意に保持されていた。背景の炎症所見について,尿ではSPはTACおよびTPよりも,他の材料ではSPおよびTACはTPよりも,有意に軽減していた。判定の可否について,尿では3法間で有意差を認めなかったが,他材料でTPはSPおよびTACよりも判定不可が有意に高率であり,全材料の比較においても同様の結果であった。以上のことより,同じLBC法でも標本作製原理や固定液等が異なると,細胞の塗抹量や形態に差異が生じることが明らかになった。
現在,世界中で子宮頸癌スクリーニング検査を中心に液状化検体細胞診(liquid-based cytology; LBC)化が進んでおり,米国で90%以上,英国で100%が従来法(採取材料をスライドガラスに直接塗抹する方法)からLBC法(採取材料を一度,固定保存液中に浮遊させ,均一化した状態からスライドガラスに薄層塗抹する方法)に短期間で移行している。本邦においてはLBC法の普及率は20%程度であるが,子宮頸部以外に子宮体部,尿,体腔液,穿刺材料,気管支擦過等様々な材料1)~3)でLBCによる細胞診検査を行い,補助診断から確定診断にまで貢献している。そのLBCには世界的に代表的なものとして,米国食品医薬品局で認可されたThinPrep®(TP;Hologic社)とSurePathTM(SP;BD Diagnostics社)がある。また,その後本邦で開発されたTACASTM(TAC;医学生物学研究所)などがある。しかしながら,それらLBC法は標本作製原理や使用する試薬などが異なっているため,出来上がる標本において細胞の塗抹量や形態に差異が生じ,評価も異なることが予測される。
今後,本邦においてLBC法を使用した種々の細胞診検体での実施が予測されるため,我々は,各LBC間での比較検討が必要と考え,TP法,SP法およびTAC法について,種々の細胞診材料を使用し,その細胞学的所見を比較したので報告する。
2012年6月から9月の期間の四国がんセンターにおいて,日常業務に影響を与えず利用可能な肺,甲状腺,乳腺,子宮頸部,子宮内膜,尿,体腔液の7材料について,それぞれ10症例(正常,良性病変および悪性病変を種々の割合で含む)を対象とした。尿,体腔液については,ルーチン検査後の残余材料を,子宮頸部,子宮内膜,肺,乳腺,甲状腺については,手術材料を擦過ないし穿刺吸引した材料を使用した。なお,本研究は四国がんセンター研究倫理委員会の承認を得ている(承認番号H24-No. 7;承認日2012年4月23日)。
2. 標本作製法採取した材料は三等分し,TP法,SP法,TAC法での細胞固定保存液(固定液)が入ったバイアルの中に各々回収し,固定後,各々の方法にて標本を作製した。
1) TP標本作製固定保存液であるPreservCyt®より,ThinPrep 5000オートメーションスライド・プロセッサ®において作製した。その手順を要約すると,バイアルが回転して細胞を分散した後,陰圧によって細胞を均等にメンブランフィルターの膜に収集し,次にフィルター上の細胞を陽圧によりスライドガラス(スライド)上に転写(塗抹)して標本を作製した。
2) SP標本作製固定保存液であるCytoRich RedTMより,PrepStainTMシステムにおいて作製した。その手順を要約すると,バイアル中の細胞溶液を遠心沈殿し,得られた沈渣成分に,精製水を混和した後,再度遠心沈殿し,得られた沈渣に精製水を混和した。その後,それらの細胞溶液スライド上に設置したセトリングチャンバー内に分注し,細胞を塗抹した。
3) TAC標本作製固定保存液であるTACASTM GYNより,自動塗抹装置 TACAS 9600TMで作製した。その手順を要約すると,遠心管を兼ねるバイアル中の細胞溶液を遠心沈殿し,得られた沈渣成分に,精製水を混和した後,再度遠心沈殿し,得られた沈渣に精製水を混和した。その後,それらの細胞溶液をスライド上に滴下し,塗抹した。
各標本は細胞塗抹後,ただちに95%アルコールにて固定し,パパニコロウ染色を実施した。
3. 検討方法LBC 3法で作製した標本は細胞評価票を使用し,10名の評価者(病理医2名,細胞検査士8名)で,1材料(10症例)につき1週間程度の期間で順番に標本を回覧した。
標本の評価項目は,①細胞の塗抹量,②診断に値する目的細胞の出現量,③核クロマチンの状態,④細胞質の保持,⑤背景の炎症所見,⑥判定の可否の6項目とした。評価項目①~⑤の評価について,5段階評価とした。評価者はそれぞれの標本について,細胞の「量」(①,②)に対する評価は1(少)→5(多),細胞の「質」(③~⑤)に対する評価は1(悪)→5(良)とし,1つ選択し,LBC 3方法それぞれにつき,評価者10名の平均 ± SD値を算出した。⑥については診断可または診断不可を選択し,評価者10名の割合を算出した。
統計学的有意差の検討はStatView system(Abacus, Berkeley, CA)を使用し,「診断の可否」についてはChi-squared test およびFisher’s exact testを,他の項目はScheffe testを行い,p値が0.05未満を有意差ありとした。

細胞の塗抹量

診断に値する目的細胞の出現量
肺,甲状腺,子宮頸部,子宮内膜について,SPはTACおよびTPよりもそれぞれ有意に高値であった。また,TACはTPよりも有意に高値であった。乳腺,体腔液では,SPおよびTACはTPよりもそれぞれ有意に高値であった。尿ではSPはTACおよびTPよりもそれぞれ有意に高値であった。
2. 核クロマチンの状態(Figure 3)および 細胞質の形態保持(Figure 4)
核クロマチンの状態

細胞質の形態保持
尿では3法の間で有意な差はそれぞれ認めなかったが,他の材料では,SPおよびTACはTPよりも有意に高値であった。
3. 背景の炎症所見(Figure 5)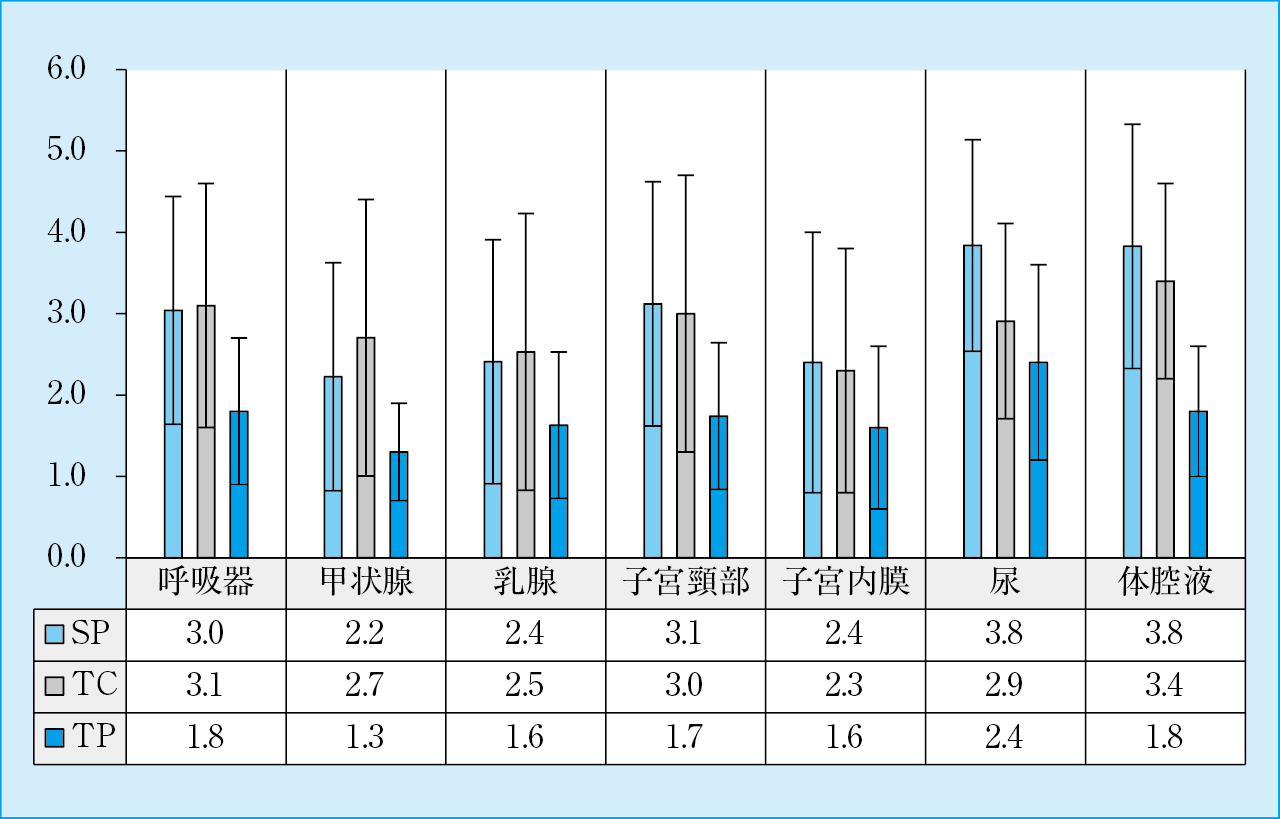
背景の炎症所見
尿ではSPはTACおよびTPよりもそれぞれ有意に高値であった。他の材料では,SPおよびTACはTPよりもそれぞれ有意に高値であった。
4. 判定の可否肺(99件)について判定不可であった割合は,SPは2件(2.0%),TACは2件(2.0%),TPは13件(13.1%)であった。同様に甲状腺(98件)は6件(6.1%),5件(5.1%),36件(36.7%)。乳腺(100件)は0件(0%),0件(0%),5件(5.0%)。子宮頸部(116件)は7件(6.0%),8件(6.9%),35件(30.2%)。子宮内膜(100件)は5件(5.0%),6件(6.0%),19件(19.0%)。尿(87件)は1件(1.1%),2件(2.2%),1件(1.1%)。体腔液(96件)は4件(4.2%),3件(3.1%),13件(13.5%)であった。全材料(696件)では,SPは24件(3.4%),TACは26件(3.7%),TPは122件(17.5%)であった。尿では3法の間で有意な差はそれぞれ認めなかったが,他の材料では,TPはSPおよびTACよりも判定不可が有意に高率であったとともに,全材料の比較でも同様であった。
細胞の塗抹量および診断に値する目的細胞の出現量について,TP法はSP法やTAC法よりも有意に低値であり,スライドへの細胞接着能力が劣っていることが明らかとなった(Figure 6)。その原因として,いくつかの理由が推測された。まずLBC 3法における固定液の溶血能力の差である。LBC 3法の固定液はともにアルコール緩衝液である。アルコールの固定機序は,蛋白質の水分がアルコールに置換・除去されると,分子内結合(疎水結合,水素結合,他)をしていた官能基が分子間相互で親和して蛋白質が凝固することである4),5)。川西ら6)は以前,培養細胞を使用したSP法での3種類の固定液の検討において,アルコール濃度が約50%の固定液は,25~30%のものよりも高濃度であるため,固定作用は強いが,溶血作用が弱い。そのため,蛋白質の水分が除去されて凝固し,凝集・沈殿する。一方,アルコール濃度の低い25~30%の固定液では,浸透圧の作用により赤血球は完全に溶血するが,固定作用が弱く蛋白質の水分を充分に除去できないので,凝固が起こりにくいと述べた。本検討において,TP法固定液のアルコール濃度は約50%,SP法やTAC法では25~30%と,川西らの検討した固定液のアルコール濃度と類似していることより,TP法はSP法やTAC法よりも固定作用は強いが,溶血作用が弱いため,蛋白質の水分が除去されて凝固し,凝集・沈殿する。一方,SP法やTAC法ではTP法と逆の作用が起こったと考えられた。則松ら7)はSP法とTP法での固定液の溶血能力検討において,固定液10 mLに対し,血液100 μLの添加では両法ともに溶血し,ゴースト赤血球(細胞の輪郭のみを認めるもの)を認めなかったが,血液200 μLの添加ではTP法で多数認めたと報告している。以上のことより,TP法固定液の溶血能力はSP法やTAC法と比べて,弱いことが明らかとなった。鈴木ら8)はSP法でのアルコール濃度が約50%の固定液(Blue)と約30%の固定液(Red)を使用し,甲状腺検体の標本背景について検討した結果,Blueは蛋白成分・赤血球が残り,汚い症例が多いが,Redは背景が清明であったと報告している。また,平ら9)はBlueとRedを使用し,尿検体での腫瘍細胞数について検討した結果,BlueはRedより有意に低値であった。その理由について,Blueは溶血作用がRedより弱いため,蛋白凝集や溶け残った血球成分で混濁・ゲル化し,腫瘍細胞が塗抹されなかったためと推測している。 したがって,TP法固定液はSP法やTAC法よりも溶血能力が弱いために,血液は完全に溶血せず,ゴースト赤血球や血液残渣となり,それらが標本全体に塗抹されるため,目的とする細胞の塗抹量が十分でない場合があることが考えられた。

甲状腺(腺腫様甲状腺腫)
TP法は細胞の採取量および診断に値する目的細胞の出現量が,SP法やTAC法よりも有意に低値であるため,9名中5名が判定不可とした。SP法やTAC法は判定可であった。(パパニコロウ染色,×4)
次に,LBC 3法の標本作製原理の違いである。TP法ではフィルターに陰圧をかけ,不必要な物質を吸引廃棄し,必要な細胞を均質にフィルター上に収集する。次に,フィルター膜に収集された細胞はフィルターへの陽圧によって非コーティングスライドに圧着転写(塗抹)される。細胞のフィルター上への収集に関して,Bentzら10)およびSweeneyら11)は,材料中に血液などを多く含む場合,これらの成分がフィルターに付着し,結果として観察対象となる上皮細胞がスライドに塗抹されないことを報告している。一方,SP法やTAC法では細胞収集を遠心操作にて上清を廃棄することにより,炎症細胞等の背景物質の割合を軽減し,目的とする上皮細胞を優位に塗抹している12)。スライド上へのフィルターの細胞転写に関して,Belsleyら13)は子宮頸部上皮内腺癌および浸潤腺癌での検討において,細胞密度が高く,重積した20個以上の細胞から構成される大型細胞集塊群がTP標本ではSP標本より少数であったと報告している。則松ら14)も子宮内膜腺癌を用いたLBC 3方法の細胞集塊数を比較した結果,TP法はSP法やTAC法よりも有意に低値であったと報告し,その原因として,重力に反した細胞塗抹,さらに非コーティングスライドの使用を指摘している。SP法やTAC法では細胞材料は重力によってコーティングスライドへ自然沈降し,次いで電気的に結合する。しかし,TP法での細胞転写の際のフィルターとスライドの位置関係は,スライドガラスがフィルターの上側に位置し,重力に反した形で非コーティングスライド上へ塗抹が行われる。以上のことより,メンブランフィルターを用いた濾過吸引法であるTP法は,コーティングスライドを用いた重力沈降法であるSP法やTAC法よりもスライドへの細胞接着能力が劣ることが考えられた。
また,肺,甲状腺,子宮頸部,子宮内膜,尿材料について,TAC法はSP法よりも細胞の塗抹量および診断に値する目的細胞の出現量が,それぞれ有意に低値であった。両法は標本作製原理がほぼ同じであり,差異があるとすれば,スライドのコーティング剤の違い(TAC法はカチオン系細胞吸着ポリマーであり,SP法では成分が明らかにされていない)が推測された。土田ら15)は尿での細胞集塊数について,SP法とTAC法を比較したところ,SP法が有意に多かったと報告し,その理由について,スライドのコーティング剤の違いによる細胞のスライドへの吸着(塗抹)の差を指摘している。したがって,SP法で使用しているコーティングスライドはTAC法よりもスライドへの細胞接着能力が強いものと考えられた。
核クロマチンの状態および細胞質の保持について,尿以外の材料では,TP法はSP法やTAC法よりも有意に低値であり,細胞形態保持能力が劣っていることが明らかとなった(Figure 7)。その原因として,TP法での標本作製過程における細胞への圧力に起因するものと推測された。SP法やTAC法は細胞がそのまま塗抹される重力沈降法であるため,細胞集塊はより立体的に塗抹される。一方,TP法では陰圧でフィルター膜に収集された細胞はフィルターへの陽圧によってスライドに圧着転写(塗抹)されるため,細胞や細胞集塊が平面的に見えるとともに膨化する傾向がみられる12),14),16)。そのため,核染色性の淡染化や細胞質の破損が起こり,核クロマチンの不良状態および細胞質保持の不良につながったと考えられた。

甲状腺(腺腫様甲状腺腫)
Figure 6と同一症例である。SP法やTAC法での濾胞上皮集塊はシート状で核クロマチンが顆粒状の円形核であることが明瞭である。一方,TP法は細胞質が壊れているとともに,核クロマチンも不明瞭である。(パパニコロウ染色,×60)
背景の炎症所見について,TP法はSP法やTAC法よりも有意に低値であり,標本上での背景物の除去能力が劣っていることが明らかとなった。このことは上述したLBC 3法の固定液の溶血能力や標本作製原理の違い,すなわち,SP法やTAC法の固定液は溶血能力を有し,標本作製過程での遠心操作による背景物の軽減に起因していると考えられた12)。
判定の可否について,尿以外の材料では,TP法はSP法およびTAC法と比較して判定不可が有意に高率であったとともに,材料全体の比較でも同様であり,TP法は約20%(122/696件)と高率であった。そのTP法での判定不可122件において,細胞の採取量および診断に値する目的細胞の出現量について評価点を調べたところ,前者は1.8,後者は1.5と非常に低値であり,TP法での判定不可標本は,判定できないレベルの細胞塗抹量であったことを示していた。TP法での標本不適正率の検討結果からも同様のことがうかがえ,Nanceら17)は10万件中のSPおよびTPでの標本不適性率が SP; 0.17% vs. TP; 0.64%と,両者の間で決して小さいとは言えないレベルの差異が認められたと報告している。その原因としては,先に述べた標本品質の違い(固定液の溶血能力の差,標本作製原理の違い)が大きく関わっていることが考えられた。
今回の検討において,同じLBC法でもその標本作製原理や使用する固定液等が異なるため,細胞の塗抹量や形態に違いが生じることが明らかになった。今後ますます,本邦の細胞診検査業務においてLBC法を実施する施設が増えてくると考えるが,LBC選定にあたっては各製品の原理や特徴を理解し,実際に標本を作製して,入念な調査検討を行うことが必須であると考えられた。
本研究において,標本の作製と評価を担当してくださった,愛媛県立中央病院 木下幸正氏,愛媛県総合保険協会 佐伯健二氏,標本の評価を担当してくださった,愛媛大学医学部附属病院 片山英司氏,松山赤十字病院 坂本真吾氏,松山市民病院 松家由紀氏,神戸大学大学院保健学研究科 大崎博之氏に深謝いたします。
本論文に関連し,開示すべきCOI 状態にある企業等はありません。