2018 Volume 67 Issue 2 Pages 178-183
2018 Volume 67 Issue 2 Pages 178-183
当施設では約50%濃度のアルコールを含む保存液を添加した検体を日常的に取り扱っているが,血液成分を多く含んだまま保存液が添加された検体に遭遇することがある。通常,血液成分が多く含まれる液状の検体を遠心分離した場合,沈渣上部にBuffy coatと呼ばれる有核細胞層が肉眼的に観察され,この有核細胞層が細胞学的検査の対象となる。しかし,保存液が添加された検体は有核細胞層の形成が不明瞭で,肉眼的な観察が困難であった。そのため,偽陰性の結果となる恐れもあり,有効なサンプリングの確証を得る必要があると考えた。そこで,保存液を添加した検体の有効なサンプリング方法を明らかにすることを目的として,有核細胞層が不明瞭な沈渣15例を対象にセルブロックを作製し,沈渣の細胞分布を検証した。その結果,当施設で使用している保存液を添加した場合,白血球や腫瘍細胞などの有核細胞は沈渣の下部に分布しやすく,特に集塊を形成する悪性細胞は最下部に集まる傾向を認めた。したがって,保存液を添加した細胞診検体は,沈渣の下部からサンプリングすることが有効であることが明らかとなった。今回の検証では,約50%濃度のアルコールを含んだ保存液を使用したが,保存液には様々な種類があり,固定作用,溶血能なども理解して検体を取り扱うことが重要であると考える。
当施設は上尾中央医科グループに所属する登録衛生検査所のためグループ施設からの受託検査を行っている。依頼元は1都5県と広域にわたり,検体の運搬距離が長く時間を要することもあり,検査への影響を及ぼす時間経過による細胞変性などを低減する必要が生じ,検体への保存液の添加を日常的に行っている。そのため,血液成分を多く含んだまま保存液を添加した検体に遭遇することがある。
血液成分を多く含む液状検体を遠心分離すると有核細胞が集まったBuffy coatと呼ばれる層が肉眼的にみられ,この層がサンプリングの対象となる。しかし,未固定の検体と異なり,保存液を添加した検体は低濃度のアルコールで固定された検体である。この保存液を添加した検体では有核細胞層が肉眼的に不明瞭となるため(Figure 1),適正なサンプリングも困難となり,検査そのものや形態学的判定が偽陰性になる恐れがある。

沈渣の肉眼像
A:未固定Buffy coatがみられる。
B:保存液添加後Buffy coatが不明瞭である。
そこで今回,検査に有効なサンプリング方法の検証を目的として,保存液を添加した血液成分を含む液状検体における遠心分離後の有核細胞の分布について調査を行った。
血液成分が多く含まれる全量約8 mLの体腔液を採取後48時間以内に遠心分離し,得られた沈渣に保存液8 mLを添加,転倒混和したものを検証対象とした。
保存液はYM式液状検体固定液(武藤化学)を主として検証し,補助的検討として種類の異なる保存液の液状化検体細胞診(liquid based cytology; LBC)で使用されているPreservCyt®(Hologic)も検証した。
細胞診にて悪性と判定された2例を含む15症例でセルブロックを作製し,その内訳は胸水8例,腹水7例である。その15症例の中で沈渣の多い5例に対してPreservCyt®を使用したセルブロック作製を行った。
また異なる症例を追加して塗抹標本作製を行った。細胞診にて悪性と判定された1例を含む13例で,内訳は胸水8例,腹水5例である。
2. 標本作製法未固定の体腔液約8 mLを遠心(1,500 rpm 5分)し,その沈渣に保存液8 mLを添加,転倒混和後,約12時間経過した沈渣を以下の方法で標本作製し,顕微鏡下で観察した。
1) セルブロック標本作製1.遠心分離して保存液である上清を取り除き,沈渣に生理食塩水8 mLを添加し転倒混和する。
2.遠心分離後,上清を取り除き,20%血清アルブミン1 mLを添加し混和する。
3.遠心分離後,上清を取り除き,沈渣に10%中性緩衝ホルマリン8 mLを静かに重層し約12時間固定する。
4.固定後にホルマリンを取り除き,100%エタノール8 mLを重層して脱水する。
5.100%エタノール8 mLの重層操作を2時間ごとに3回繰り返す。
6.固形物となった沈渣物をティシュープロセッサーにてパラフィン浸透させる。
7.包埋ブロックを作製し,薄切,ヘマトキシリン・エオジン染色を行う。
2) 塗抹標本作製1.遠心分離して保存液である上清を取り除き,沈渣を上部,中部,下部の3つに分ける。
2.それぞれの沈渣をスライドガラスに20 μL滴下し,3 cmの幅で1回すり合わせして塗抹する。
3.乾燥後,パパニコロウ染色を行う。
3. 検証方法セルブロック標本にて有核細胞が沈渣の上部,中部,下部のどの位置に分布しているかを検証した。
また,塗抹標本でも同様の分布となるのか,白血球,腫瘍細胞の2種類の細胞数をカウントし追加検証を行った。カウント方法は,塗抹標本上から無作為に3 mm × 3 mmの範囲を5か所マークし,5か所の細胞数をそれぞれ合計した。
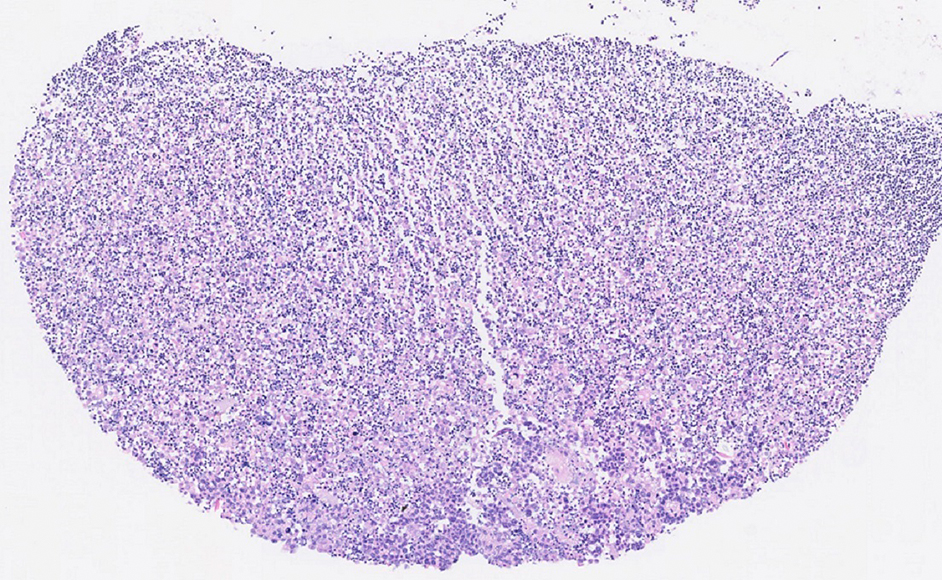
有核細胞は下部に多く分布していた(Figure 2, 3, 4)。細胞診にて悪性と判定された検体のうち1例では,腫瘍細胞が沈渣の最下部に分布していた(Figure 5, 6)。その腫瘍細胞は集塊を形成し,白血球に比べてサイズが大きくN/C比が高い傾向がみられた。

YM式液状検体固定液使用 セルブロック標本 ルーペ像

Figure 2の上部拡大像
殆どが赤血球であり,有核細胞は少数である。

Figure 2の下部拡大像
有核細胞の割合が高い。
YM式液状検体固定液使用 セルブロック標本 ルーペ像

Figure 5の最下部拡大像
悪性細胞の集塊がみられる。
対照として未固定の検体でセルブロックを作製したが,有核細胞は沈渣の上部に分布していた(Figure 7)。

未固定検体のセルブロック標本
ルーペ像沈渣の上部に有核細胞がみられる。
別の保存液としてPreservCyt®についても検証したが,YM式液状検体固定液と同様に下部に有核細胞が多く分布していた(Figure 8)。
PreservCyt®使用 セルブロック標本 ルーペ像
塗抹標本を作製した13例について,上部,中部,下部のそれぞれの標本中,無作為5か所の合計細胞数を計測した(Table 1)。
| 採取部位 | 炎症細胞(13例の平均) | 腫瘍細胞(1例) |
|---|---|---|
| 上部 | 63 | 12 |
| 中部 | 315 | 26 |
| 下部 | 920 | 90 |
13例において白血球数の平均個数は,上部63,中部315,下部920であった。悪性と判定された症例は1例のみであったが,腫瘍細胞数は上部12,中部26,下部90であった。
したがって,有核細胞の多くが下部に認められる結果となった。悪性と判定された症例では,上部,中部にも腫瘍細胞が出現していたが,細胞数は下部に最も多く認められた(Figure 9)。

YM式液状検体固定液使用 沈渣の塗抹標本(対物20倍)
A:上部 B:中部 C:下部
細胞診検体を取り扱う上で,目的細胞のサンプリングが行われることが必要であり,塗抹する検体の性状や保存液の有無も重要な要因となる。
細胞検査士会では血液成分の多い未固定の検体では沈渣の上部を採取することとしており1)~3),実際セルブロックにて確認すると有核細胞が沈渣の上部に存在していた。しかし,保存液を添加した検体の沈渣では白血球,腫瘍細胞等の有核細胞は下部に存在した。
アルコール固定では細胞内の水分がアルコールに置換され,分子間結合していた官能基が分子間相互で親和してタンパク質が凝固する4)。YM式液状検体固定液はエタノールが主成分5),PreservCyt®はメタノールが主成分6)の保存液であり,両者に含まれるアルコール濃度は約50%である。
また,香川ら7),川西ら8)が保存液における溶血作用についてアルコール濃度が50%の固定液は溶血作用が弱く溶け残った血球成分で混濁・ゲル化すると述べている。よって,保存液中の赤血球は本来の赤血球の形態が保持されず凝集した状態であり,液体の中を浮遊できない状態であると考えられた。そのため,岡庭9)の述べた比重による血球の遠心分離の原理に合わず,有核細胞の分布が異なったと推測する。
さらに,セルブロックの観察にて下部に確認できた有核細胞が塗抹標本上でも同様の分布を示すか追加検証した。上部,中部,下部の細胞数をカウントした結果,白血球,腫瘍細胞は下部に圧倒的に多く見られ,セルブロックで得られた結果と一致した。
今回行った塗抹標本作製での細胞採取方法の手順は次の通りである。血液成分を含む保存液を添加した検体の沈渣から上清を取り除いた後,上部から沈渣の3分の1取り別のスピッツへと移し,同様に中部から同量取り別スピッツへ移す。残った沈渣を下部とした。
追加検討した陽性1例の塗抹標本で上部~下部すべてに腫瘍細胞などの有核細胞がみられた。セルブロック標本を確認すると,有核細胞の割合が高く,下部のみではなく中部と上部の境界部分まで有核細胞が占めており,そのため上部や中部でも腫瘍細胞が採取されたと考えられる。
また,腫瘍細胞は孤立散在性の粘液を産生する大型の細胞であったため,保存液によってゲル化した蛋白質8),9)に阻まれた細胞が上部までみられたと考えられた。
沈渣の全量が少なければ,撹拌して塗抹を行うが,標本上に塗抹されたもののほとんどが赤血球では適正標本ではないため,沈渣の全量が多い検体はサンプリングする部分の選択が必要になる。
約50%のアルコール濃度の保存液を使用する場合は,腫瘍細胞などの有核細胞は上部より下部に多く分布する傾向があるため,サンプリングは沈渣の下部から行うことが望ましいと考えられる。
しかし,保存液としてPreservCyt®を使用する場合は,CytoLyt® solutionによる前処理(溶血処理)で今回のような問題は解消されるかもしれない。
今回の検証により,血液成分を多く含む場合の未固定と保存液を添加した検体における細胞分布の違いが確認できた。約50%のアルコール濃度の保存液を添加した検体は,沈渣の下部から採取することが有効なサンプリング方法と考える。
今後,液状化検体細胞診の普及が進み保存液を使用した検体が多くなっていくと,検体処理の方法によっては溶血が十分できなかった検体に遭遇することも予想される。今回の検証で明らかになった特性やアルコール濃度による溶血能の違いなども十分に理解し,適切な検査につなげていきたい。
本論文の内容は,第52回関甲信支部医学検査学会(2015年10月,長野)にて報告した。
本研究は施設運営委員会の承認を得て実施した。
本論文に関連し,開示すべきCOI 状態にある企業等はありません。