2018 Volume 67 Issue 2 Pages 189-195
2018 Volume 67 Issue 2 Pages 189-195
免疫血清検査項目の外部精度評価調査では,試料のマトリックス効果の影響により機器,試薬間差の現状が充分には解明されていない。今回,試薬間差の要因分析と,調査試料の適正性の評価を目的として検討を行った。検討は日臨技精度管理調査で対象項目としている前立腺特異抗原(prostate specific antigen; PSA),フェリチン(ferritin),αフェトプロテイン(α-fetoprotein; AFP),癌胎児性抗原(carcinoembryonic antigen; CEA)を調査項目とし,機器メーカー4社を対象として検討を行った。試料はパネル血清30検体と,調査試料16検体を用いた。総平均値を基準としてパネル血清の測定値を回帰分析で評価した結果,PSA,フェリチン,AFPでは各法の測定値に比例系統を認めたが,解離する値は認めなかった。しかし,CEAでは各法での測定値が異なり一定の傾向を認めなかった。パネル血清での回帰分析により求めた95%信頼区間を基準として調査試料の反応性を評価した。その結果,プール血清より作製した試料が評価基準を満たし,外部精度評価調査試料として有用であると考えられた。
免疫血清検査項目では,基準測定操作法や標準物質は存在せず,測定体系の標準化が達成されていない。このような標準化が困難な測定項目ではハーモナイゼーション(調和化)により臨床的に混乱を生じない測定値を提供することが求められているが,その実現には至っていない。一方,各団体が外部精度評価調査を実施し,機器および試薬間差の要因を報告しているが,調査によりその評価は異なっており問題点は解決されていない1)~3)。この要因の一つとして,調査に用いた試料の反応性の違い(マトリックス効果)による影響が推定されている。今回,前立腺特異抗原(prostate specific antigen; PSA),フェリチン(ferritin),αフェトプロテイン(α-fetoprotein; AFP),癌胎児性抗原(carcinoembryonic antigen; CEA)を調査項目とし機器メーカー4社を対象として調査を行った。試料はパネル血清30検体と,調査試料16検体を用いて,試薬間差の解明と調査試料の反応性の評価を試みた。
アーキテクトi2000SR(アボットジャパン),モジュラーアナリティクス〈E〉(ロシュ・ダイアグノスティックス),AIA-2000(東ソー),ルミパルスPresto II(富士レビオ)の4機種を対象とし,各機器メーカーに測定を依頼した。なお,本調査は岩手医科大学医学部倫理審査委員会の承認(H25-112)のもと,日臨技検査値標準化委員会が実施した。
2. 試料今回の調査に当たり,参考試料と調査試料を準備した。参考試料は,項目毎に重複しない患者を選別し,1患者1採血の試料より作製したパネル血清30検体とした。調査試料は,項目毎に作製したプール血清6検体,平成25年度日臨技精度管理調査試料2検体,市販コントロール8検体とした(Table 1)。
| 種類 | 試料名称 | 試料の詳細 |
|---|---|---|
| 参考試料 | パネル血清P | 患者試料30検体 PSA測定用 |
| パネル血清F | 患者試料30検体 フェリチン測定用 | |
| パネル血清A | 患者試料30検体 AFP測定用 | |
| パネル血清C | 患者試料30検体 CEA測定用 | |
| 調査試料 | プール血清P1~P6 | PSA測定用 |
| プール血清F1~F6 | フェリチン測定用 | |
| プール血清A1~A6 | AFP測定用 | |
| プール血清C1~C6 | CEA測定用 | |
| 日臨技精度管理調査試料1,2 | 平成25年度調査試料 | |
| 市販コントロール1,2 | アーキテクトコントロール(アボット) | |
| 市販コントロール3,4 | プレチコントロールTM(ロシュ) | |
| 市販コントロール5,6 | 東ソーマルチコントロール(東ソー) | |
| 市販コントロール7,8 | イムノアッセイTMJコントロール(富士レビオ) |
患者試料はPSAでは前立腺癌および前立腺肥大患者,AFPは肝癌および肝硬変患者,CEAは各臓器癌患者由来としたが,フェリチンは特定の疾患を限定出来なかった。また,各試料の選択は各試薬の直線性の範囲を網羅出来る濃度を考慮して行った。調査試料のプール血清はそれぞれ単項目専用とし,他の試料は4項目測定用試料である。参考試料及びプール血清作製用試料は−20℃で保存し溶解後,孔径0.8 μmのメンブレンフィルターでろ過し,測定時まで冷蔵保存した。
参考試料の測定結果より,総平均値を基準として線形関係式を求め,ブートストラップ法により各方法の系統誤差を検定した4),5)。また,残差標準偏差(Syx)を求め,総平均値と各方法の測定値の差異を評価した。さらに,各方法の測定値の変動係数(CV)を求め,各試料の方法間差の評価を行った。尚,統計計算はバリデーション算出用プログラム(日本臨床化学会)で行った。
2. 調査試料での評価参考試料の結果より得られた関係式の95%信頼区間を求めて評価を行った。95%信頼区間を許容限界とし,調査試料の測定値が許容限界内の場合を適正,許容限界外の場合は不適正として評価し,各方法ともに適正となった調査試料を適合と判断した。尚,統計計算はエクセル(マイクロソフト社)で行った。
参考試料を測定した結果より求めた散布図をFigure 1に示した。また,回帰分析で得られた関係式,系統誤差の検定結果,SyxをTable 2に示した。尚,検定結果はブートストラップ法により系統誤差を認めた関係式の傾きと切片の95%信頼区間のみを示した。
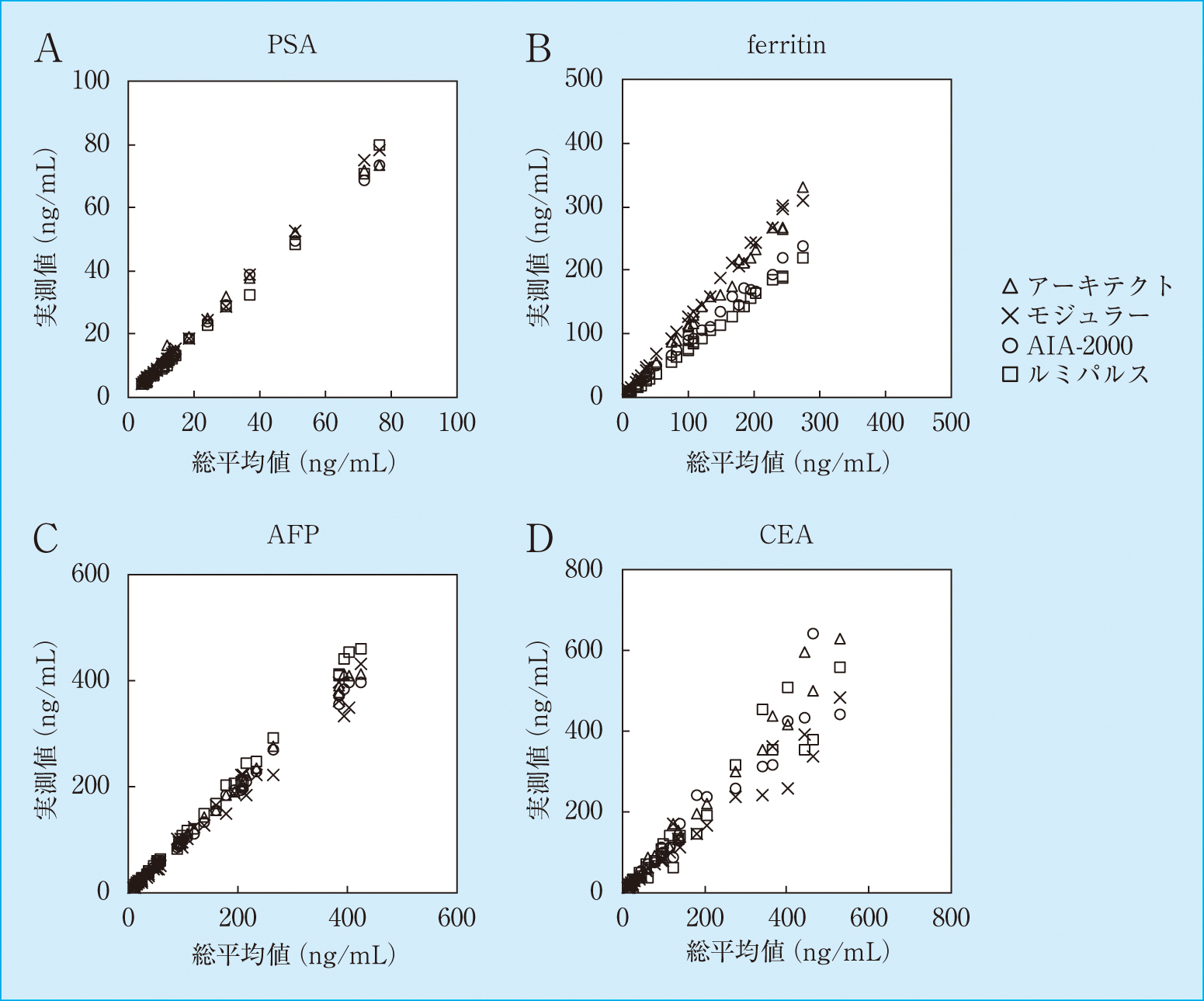
Scatter plots of measurement results of reference samples
| 測定機器 | 相関係数 | 線形関係式 | 一定誤差 | 比例誤差 | Syx(ng/mL) | |
|---|---|---|---|---|---|---|
| PSA | アーキテクト | 1.00 | y = 0.90 + 0.98x | — | — | 1.23 |
| モジュラー | 1.00 | y = −0.23 + 1.03x | −0.50~−0.05 | 1.02~1.06 | 0.54 | |
| AIA-2000 | 1.00 | y = 0.50 + 0.96x | — | — | 0.74 | |
| ルミパルス | 1.00 | y = −0.51 + 1.00x | — | — | 1.16 | |
| ferritin | アーキテクト | 1.00 | y = −3.07+1.12x | — | 1.08~1.20 | 9.43 |
| モジュラー | 1.00 | y = 4.23 + 1.15x | 1.47~6.89 | 1.13~1.19 | 5.94 | |
| AIA-2000 | 1.00 | y = 3.01 + 0.84x | 0.09~6.05 | 0.81~0.88 | 6.27 | |
| ルミパルス | 1.00 | y = −2.69 + 0.79x | −3.99~−1.38 | 0.77~0.80 | 2.57 | |
| AFP | アーキテクト | 1.00 | y = 1.24+ 0.99x | 0.21~2.42 | — | 3.93 |
| モジュラー | 1.00 | y = −2.89 + 0.96x | — | — | 13.05 | |
| AIA-2000 | 1.00 | y = 1.24 + 0.95x | 0.03~2.42 | 0.93~0.98 | 4.81 | |
| ルミパルス | 1.00 | y = −0.73 + 1.08x | — | 1.06~1.09 | 3.21 | |
| CEA | アーキテクト | 1.00 | y = −7.35 + 1.12x | — | 1.07~1.29 | 24.43 |
| モジュラー | 0.98 | y = 4.14 + 0.83x | — | 0.72~0.91 | 28.18 | |
| AIA-2000 | 0.97 | y = −3.23 + 1.06x | — | — | 42.65 | |
| ルミパルス | 0.97 | y = −4.91 + 1.05x | — | — | 42.25 |
PSAでの各方法の関係式の系統誤差を検定した結果,モジュラーアナリティクスで一定,比例系統誤差を認めた。各方法のSyxは0.54~1.23 ng/mLであった。フェリチンでの各方法の関係式の系統誤差を検定した結果,モジュラーアナリティクス,AIA-2000,ルミパルスPresto IIで一定系統誤差を認め,4法で比例系統誤差を認めた。各方法のSyxは2.57~9.43 ng/mLであった。AFPでの各方法の線形関係式の系統誤差を検定した結果,アーキテクトi2000SR,AIA-2000で一定系統誤差を認め,AIA-2000,ルミパルスPresto IIで比例系統誤差を認めた。各方法のSyxは3.21~13.05 ng/mLであった。CEAでの各方法の関係式の系統誤差を検定した結果,アーキテクトi2000SR,モジュラーアナリティクスで比例系統誤差を認めた。各方法のSyxは24.43~42.65 ng/mLであった。
各方法で測定した参考試料の総平均値とCVの関係をFigure 2に示した。各項目でのCVは,PSAでは1.5~24.0%,フェリチンでは18.4~30.7%,AFPでは3.2~13.4%,CEAでは7.4~46.3%あった。

Relationship between the total average and CV of reference samples
各方法の参考試料の結果より得られた関係式の95%信頼区間を許容限界とした。各方法別に調査試料の実測値を評価し,許容限界内の値を適正,許容限界外は不適正とした。さらに,全ての方法でともに適正となった調査試料を適合と判断し,調査試料と参考試料の反応性は同一であると評価した。評価結果をTable 3に示した。その結果,全ての方法で適合と判断された試料は,PSAでは10試料,フェリチンでは4試料,AFPでは7試料,CEAでは13試料であった。
| 試料 | PSA | ferritin | AFP | CEA |
|---|---|---|---|---|
| プール血清1 | ○ | ○ | ○ | ○ |
| プール血清2 | ○ | — | — | ○ |
| プール血清3 | ○ | ○ | ○ | ○ |
| プール血清4 | ○ | ○ | ○ | ○ |
| プール血清5 | ○ | — | — | — |
| プール血清6 | — | — | — | ○ |
| 日臨技試料1 | ○ | — | ○ | ○ |
| 日臨技試料2 | ○ | — | — | — |
| コントロール1 | — | — | ○ | ○ |
| コントロール2 | — | — | — | ○ |
| コントロール3 | ○ | — | ○ | ○ |
| コントロール4 | — | — | — | — |
| コントロール5 | ○ | — | — | ○ |
| コントロール6 | ○ | — | — | ○ |
| コントロール7 | — | ○ | ○ | ○ |
| コントロール8 | — | — | — | ○ |
○ 適合 — 不適合
PSA,フェリチン,AFP,CEAを調査項目とし,4社の測定機器を対象として試薬間差の評価と調査試料の適正性の検討を行ったところ,検討項目により測定結果にそれぞれの特徴が認められた。
PSAでは,参考試料の測定結果を評価した結果,回帰式の傾きの係数は0.96~1.03であった。各測定法の基準は全てWHO 96/670に準拠していたが,検定の結果,モジュラーアナリティクスの結果に比例系統誤差を認めた。Syxは0.54~1.23であることから,各機器の測定値と総平均値はほぼ一致したと推定される。また,参考試料の測定値のCVを評価した結果,乖離した1例を除いたCVは1.5~12.7%,平均5.4%であったことから,測定値の差は各試薬の基準に由来するものと推定された。
フェリチンでは,回帰式の傾きは0.84~1.15となり,検定の結果,全ての方法で比例誤差を認めた。測定法の基準はアーキテクトi2000SR,モジュラーアナリティクス,AIA-2000がWHO 1st IS 80/602,ルミパルスPresto IIがWHO 3rd IS 94/572であったが,測定値の比例系統誤差との関係は明確ではなかった。Syxは2.57~9.43であり,方法により総平均値と実測値の差の程度は異なった。参考試料の測定値のCVを評価した結果,CVは18.4~30.7%,平均22.4%であったが,乖離する試料は認めなかったことから,測定値の差は各試薬の基準に由来するものと推定された。
AFPでは,回帰式の傾きは0.95~1.08であり,検定の結果,AIA-2000,ルミパルスPresto IIで比例系統誤差を認めたが,各方法の基準は全てWHO 1st IRP 72/225に準拠していた。Syxは3.21~13.05であり,他の方法と比較しモジュラーアナリティクスの測定値と総平均値に差を認めた検体が存在した。パネル血清の測定値のCVを評価した結果,CVは3.2~13.4%,平均8.1%となり,CVが約5%と10%に集約する2群が存在したことから,各試薬の抗体と患者試料の反応性が均等ではないと推察された。
CEAでは,回帰式の傾きは0.83~1.12であり,検定の結果,アーキテクトi2000SR,モジュラーアナリティクスで比例系統誤差を認めた。各方法の基準はアーキテクトi2000SR,モジュラーアナリティクス,AIA-2000がWHO 1st IRP 73/601,ルミパルスPresto IIが自社基準としていた。参考試料を測定したSyxは24.43~42.65であり,測定値のCVは7.4~46.3%となり各方法の測定値は試料により異なった。ルミパルスPresto IIはCEAのみを測定対象とするが,他3社の試薬はCEAファミリーでnonspecific cross reacting antigen(NCA)の一種であるNCA-2も測定することから,測定値が乖離することが報告されている6),7)。しかし,NCA-2測定の有無と各方法の測定値の差には一定の関係性は認めなかった。
免疫血清検査項目では基準分析法は存在しないが,一部の項目ではWHOの標準物質が存在し,各試薬メーカーのキャリブレーターの値付けに利用されている。しかし,各メーカーの基準とその測定値の関係性は明確ではない。米国臨床化学会(American Association for Clinical Chemistry; AACC)は基準分析法が存在しない検査項目のハーモナイゼーションの実施案を検討し,2011年にロードマップを示しているが,その作業は進行していない8)。また,新エネルギー・産業技術総合開発機構は平成17~19年にかけて免疫血清検査項目の現存する標準物質の評価と,その候補品の作製の可能性について,国内で販売されている測定機器,試薬を対象として検討を行っている9)~11)。その結果,PSAはトレーサビリティー体系が確立できること,フェリチンは標準物質が存在しないが,その作製によりメーカー間差の改善が可能であると報告している。一方,AFPとCEAは現存する標準物質はヒト実試料と反応性が異なることから,その作製方法の確立が必要であると報告している。
ハーモナイゼーションによる測定値の収束程度の評価には,様々な方法が提案されている。ヒト実試料より作製したパネル血清を用いて各メーカー間における互換性を評価することが望ましいが,その実現は困難である。したがって,加工された調査試料の測定によるメーカー間差の評価が現実的である。今回の検討で我々は,16種類の参考試料を測定し,調査試料としての反応性の評価を行った。その結果,評価を満たした試料は,PSAは10試料,フェリチンは4試料,AFPは7試料,CEAは13試料であった。項目により適合した試料は異なったが,日臨技試料,市販コントロールはいずれも基準を満たさなかった。これは調査試料のマトリックス効果により,その反応性がヒト実試料とは異なったことによるものと推定された。プール血清はヒト実試料と同等の反応性を示すと考えられたが,今回の調査で作製したプール血清でも評価基準を満たさない試料が存在した。
今後,調査試料としてプール血清を作製するにあたり,原血清の選択基準などの作製方法をさらに検討する必要性が示唆された。
免疫血清検査項目のハーモナイゼーションに際し,その結果を検証する必要があるが評価方法は確立されていない。その評価はパネル血清等のヒト実試料の測定による方法が望ましいがその実施は困難である。今回の検討により調査試料としてプール血清の適正性が確認されたが,その作製方法にはさらに検討が必要であると考えられた。
なお,本論文の要旨は第65回日本医学検査学会で発表した。
今回論文作成に際し,ご高閲を賜った岩手医科大学医学部臨床検査医学講座の諏訪部章教授に深謝します。
本論文に関連し,開示すべきCOI 状態にある企業等はありません。