2018 Volume 67 Issue 3 Pages 321-327
2018 Volume 67 Issue 3 Pages 321-327
リパーゼは急性膵炎の診断に用いられる指標であり,カラーレート法と合成基質法の2法が普及しているが,未だ常用基準法は定められていない。今回我々は,合成基質1,2-o-ジラウリル-rac-グリセロ-3-グルタル酸-(6-メチル-レゾルフィン)エステル(DGGMR)を用いた新規試薬であるシグナスオート LIPの性能評価を行ったので報告する。市販精度管理用試料にて再現性を確認した結果,同時再現性はC.V.:1.0~1.4%,日差再現性はC.V.:0.8~2.1%と良好であった。常用参照標準物質にて正確さを確認した結果,参考値の中央値からのBias は,シグナスオート LIPでは+2.6%,ネスコートVNリパーゼでは−53.5%であり,標準物質の値付けに起因すると考えられる試薬間差を認めた。直線性上限は460 U/L,検出限界は4.0 U/Lであり,十分な測定範囲を有すると考えられた。共存物質の影響を確認した結果,検討したすべての物質で±3%を超える影響は認められなかった。試薬開封後30日間は安定していたが,アジ化ナトリウムの添加により,開封後20日間で20%以上の低下が認められた。一方,改良試薬では測定値の変動は認められなかった。対照試薬との相関を確認した結果,測定値は大きく異なるものの良好な相関が得られた。シグナスオート LIPは検討した全ての項目で良好な成績が得られ,日常検査において有用であると考えられた。
リパーゼは膵臓に特異性の高い逸脱酵素である1)。膵疾患のマーカーとして臨床的意義が高く,急性膵炎診療ガイドライン2015には,血中リパーゼの測定を推奨すると明記されている2)。また,リパーゼはアミラーゼに比し,急性膵炎に対する感度や特異度が高く,異常高値が長期間持続するという特徴を持つ。そのため,慢性膵炎を背景とするアルコール性急性膵炎や,発症後から長期間が経過し,血中アミラーゼが基準範囲内に低下している場合の経過観察にも有用である2)。
リパーゼの測定には,日常検査法としてカラーレート法と合成基質法の2法が普及しているが,常用基準法は検討段階であり,最大で約2倍の試薬間差が認められている3)。
今回我々は,合成基質1,2-o-ジラウリル-rac-グリセロ-3-グルタル酸-(6-メチル-レゾルフィン)エステル(DGGMR)を用いたリパーゼ測定試薬である「シグナスオート LIP」の性能評価を行ったので報告する。
検討には,市販精度管理用試料スイトロールI・II EX(日水製薬)およびLIPコントロール(シノテスト)を使用した。患者検体については,当院検査部に提出された検体のうち,リパーゼ検査が依頼された96例の血清を用いた。なお,本検討は徳島大学臨床研究倫理審査委員会の承認後(承認番号1919),匿名化し,実施した。
2. 試薬および測定機器試薬はシグナスオート LIP(シノテスト:DGGMR法),測定機器は日立7180形自動分析装置(日立ハイテクノロジーズ)を用い,メーカー指定パラメータにて検討を行った。比較対照試薬としてネスコートVNリパーゼ(アルフレッサファーマ:MGLPレート法)を用いた。
また,シグナスオート LIPはアジ化ナトリウムの影響が指摘されており,その影響を軽減したとされる改良試薬についても検討を行った。本研究は改良前試薬にて行い,アジ化ナトリウムの影響についてのみ,改良試薬も同様に評価した。
3. 測定原理リパーゼは基質のDGGMRに作用し,1,2-o-ジラウリル-rac-グリセロールとグルタル酸-(6-メチル-レゾルフィン)エステルに分解する。グルタル酸-(6-メチル-レゾルフィン)エステルはアルカリ条件下で加水分解し,グルタル酸及びメチルレゾルフィンに分解する。メチルレゾルフィンの遊離による580 nm付近の吸光度の増加を測定することにより,リパーゼの活性を求める。
スイトロールI・II EXおよびLIPコントロールを連続20回測定し,同時再現性を確認した。
2. 日差再現性スイトロールI・II EXおよびLIPコントロールを5日間(n = 2)測定し,日差再現性を確認した。
3. 正確さ常用参照標準物質JCCLS CRM 001c(日本臨床検査標準協議会)を連続10回測定し,正確さを確認した。
4. 希釈直線性高濃度血清試料を生理食塩水にて10段階に希釈,各2重測定し,希釈直線性を確認した。
5. 検出限界低濃度血清試料を生理食塩水にて6段階に希釈,各10重測定し,2.6SD法を用いて検出限界を確認した。
6. 共存物質の影響スイトロールI・II EXに干渉チェックAプラス(シスメックス)およびアスコルビン酸(シノテスト)を添加し,共存物質の影響を確認した。
7. 試薬開封後安定性初回キャリブレーション実施以降,キャリブレーションを実施せず,スイトロールI・II EXを30日間(n = 2)測定し,試薬開封後の安定性について確認した。
8. アジ化ナトリウムの影響第2試薬にアジ化ナトリウムを0.0001%の終濃度となるよう添加したシグナスオート LIP改良前試薬,シグナスオート LIP改良試薬およびネスコートVNリパーゼを用いて,スイトロールI・II EXを20日間(n = 2)測定し,アジ化ナトリウムの影響を確認した。
9. 相関当院倫理委員会の承認が得られた患者血清残余検体96例を用い,ネスコートVNリパーゼとの相関を確認した。
スイトロールI・II EXおよびLIPコントロールを連続20回測定した平均値および変動係数は,シグナスオート LIPではMean:28.0~43.0 U/L,C.V.:1.0~1.4%,ネスコートVNリパーゼではMean:12.6~20.4 U/L,C.V.:1.4~4.0%であった(Table 1a)。
| a) Within-run (n = 20) | Cygnus-auto LIP | Nescauto VN lipase | ||||
|---|---|---|---|---|---|---|
| Suitrol I | Suitrol II EX | LIP Control | Suitrol I | Suitrol II EX | LIP Control | |
| Mean (U/L) | 28.0 | 35.9 | 43.0 | 12.6 | 16.1 | 20.4 |
| S.D. (U/L) | 0.38 | 0.36 | 0.45 | 0.50 | 0.22 | 0.49 |
| C.V. (%) | 1.4 | 1.0 | 1.0 | 4.0 | 1.4 | 2.4 |
| b) Between-day (Day 5/n = 2) | Cygnus-auto LIP | Nescauto VN lipase | ||||
| Suitrol I | Suitrol II EX | LIP Control | Suitrol I | Suitrol II EX | LIP Control | |
| Mean (U/L) | 28.1 | 36.7 | 44.0 | 12.9 | 16.6 | 21.4 |
| S.D. (U/L) | 0.22 | 0.67 | 0.94 | 0.22 | 0.42 | 0.65 |
| C.V. (%) | 0.8 | 1.8 | 2.1 | 1.7 | 2.5 | 3.0 |
スイトロールI・II EXおよびLIPコントロールを用いた日差再現性(5日間)の平均値および変動係数は,シグナスオート LIPではMean:28.1~44.0 U/L,C.V.:0.8~2.1%,ネスコートVNリパーゼではMean:12.9~21.4 U/L,C.V.:1.7~3.0%であった(Table 1b)。
3. 正確さ常用参照標準物質JCCLS CRM 001cにおける参考値の中央値からのBiasは,シグナスオート LIPでは+2.6%,ネスコートVNリパーゼでは−53.5%であった(Table 2)。
| Cygnus-auto LIP | Nescauto VN lipase | |
|---|---|---|
| Mean (U/L) | 137.5 | 62.3 |
| S.D. (U/L) | 0.67 | 0.46 |
| C.V. (%) | 0.5 | 0.7 |
| Bias (%) | +2.6 | −53.5 |
JCCLS CRM 001c: 134 ± 5 U/L (n = 10)
高濃度血清試料を用いて希釈直線性を確認した結果,シグナスオート LIPでは460 U/Lまで,ネスコートVNリパーゼでは227 U/Lまでの直線性が確認できた(Figure 1)。

Dilution linearity
希釈系列の平均値−2.6SDが試薬盲検の平均値+2.6SDに重ならない最小濃度を検出限界として評価した結果,検出限界値はシグナスオート LIPでは4.0 U/L,ネスコートVNリパーゼでは1.6 U/Lであった(Figure 2)。

Limit of detection
シグナスオート LIPでは,BIL-F・C,ヘモグロビン,乳び,アスコルビン酸のすべての物質において±3%を超える変動は認められなかった。一方,ネスコートVNリパーゼでは,BIL-F(20 mg/dL)で15.6%,BIL-C(20 mg/dL)で9.4%,アスコルビン酸(50 mg/dL)で35.5%の低下,ヘモグロビン(500 mg/dL)で30.0%の増加が認められたが,乳びによる影響は認められなかった(Figure 3)。

Effect of interfering substances
シグナスオート LIPでは,試薬開封後30日までの変動は±5%以内であり,安定していた。ネスコートVNリパーゼでは,20日経過後から測定値の低下傾向が認められ,30日経過時においては,初回値に比し17.9~22.2%の低下がみられた(Figure 4)。
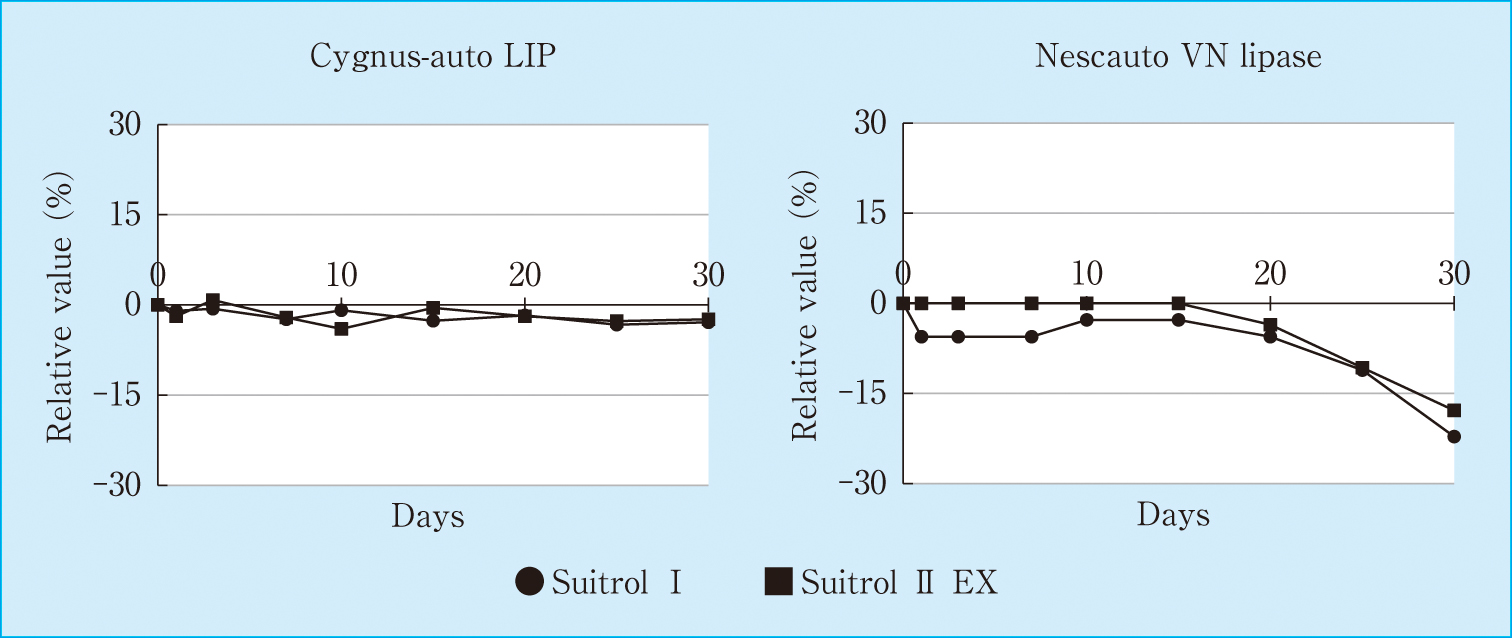
Stability of reagents after opening
シグナスオート LIP改良前試薬では,経時的に測定値が低下し,20日経過時点で初回値に比し20.6~23.0%の低下を認めたが,シグナスオート LIP改良試薬では測定値の変動は認められなかった。一方,ネスコートVNリパーゼでは,20日経過時点で7.1~8.3%の低下が認められた(Figure 5)。

Effect of sodium azide
対照試薬との相関を確認した結果,回帰式はy = 2.21x + 4.6,相関係数はr = 0.975となり,良好な相関が得られた。また,極端な乖離検体も認められなかった(Figure 6)。
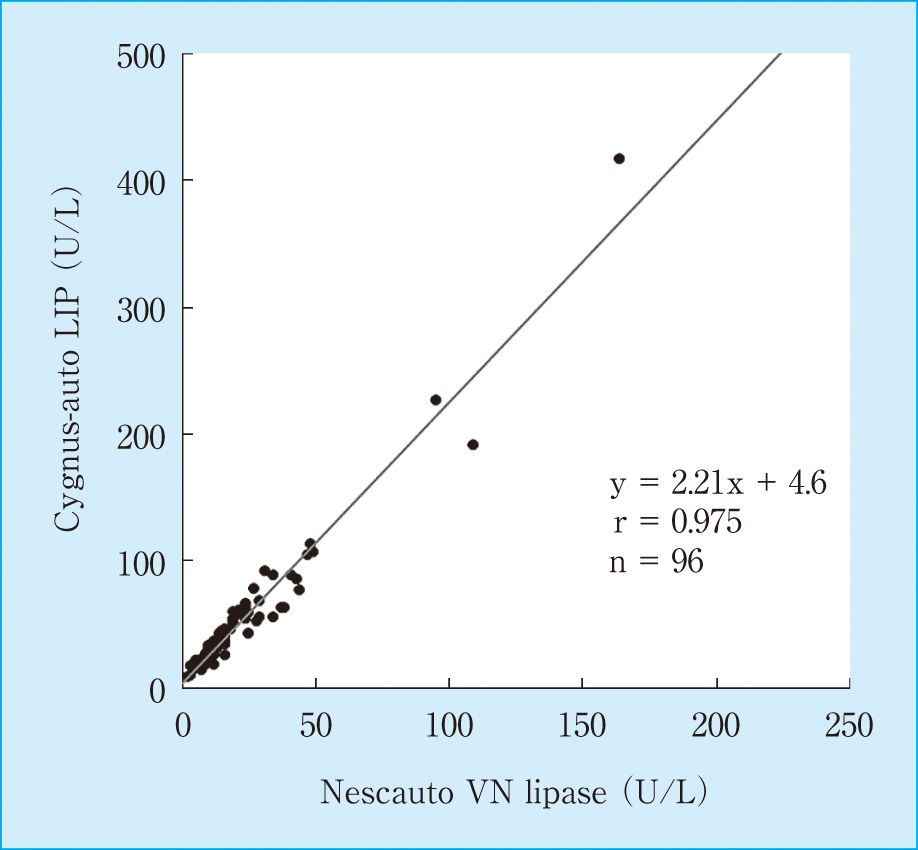
Correlation
同時再現性,日差再現性は良好な結果であった。
正確さの検討結果より,シグナスオート LIPとネスコートVNリパーゼには大きな試薬間差が認められた。この試薬間差は,シグナスオート LIPがJCCLS CRM から値付されているのに対し,ネスコートVNリパーゼでは社内基準標準によって値付がされていることに起因すると考えられた。またネスコートVNリパーゼにおいては,この社内基準標準の上位標準物質も不明確であり,このようなトレーサビリティの差異が試薬間差に繋がったものと示唆された。
直線性と検出限界の検討結果より,シグナスオート LIPの測定範囲は4.0~460 U/Lと判断した。典型的な急性膵炎では,基準範囲上限の2.5倍である140 U/Lに及ぶ活性を示すとされており4),5),本試薬は十分な測定範囲を有しているものと考えられた。
共存物質の影響では,シグナスオート LIPは検討した全ての物質で±3%を超える変動を認めなかったのに対し,ネスコートVNリパーゼでは乳び以外の検討に用いた物質において影響を認めた。ビリルビンとアスコルビン酸については,その還元性により過酸化水素とペルオキシダーゼの反応が阻害されて負誤差になったと考えられた。ヘモグロビンの正誤差については,反応原理を鑑みると色調による影響である可能性は低く,カラーレート法に基づく吸光度変化への干渉を考えたが,現時点において原因は解明できていない。一方,シグナスオート LIPは反応に過酸化水素を利用しないため,還元物質の影響を受けず,また,界面活性剤によりヘモグロビンの影響を回避しているため,変動を認めなかったものと考えられた。
試薬開封後安定性を確認した結果,キャリブレーションを実施せずとも,30日間は大きな変動はなく,安定であった。シグナスオート LIPは分析装置内においてアジ化ナトリウムを含む試薬から発生するアジ化水素ガスによる影響,いわゆる空中コンタミネーションによる影響が指摘されており,この影響を軽減したとされる改良試薬についても検討を行った。アジ化ナトリウムを添加した改良前試薬では経時的に測定値が低下したのに対し,改良試薬では無添加試薬と同様,測定値の変動は認められなかった。また,ネスコートVNリパーゼでも若干の低下が認められたが,無添加時でも同様の傾向であり,添付文書上でも安定性は調整後10日とされていることから,アジ化ナトリウムに起因する低下ではなく,試薬の特性であるものと考えられた。
対照試薬との相関性は良好であり,乖離する検体も認められなかったが,測定値は大きく異なるため,試薬変更時には臨床医への周知が必要である。
本試薬は,基礎的性能は良好であり,正確さや共存物質の影響,開封後安定性に関して,対照試薬に比し優位であった。現在評価が進められている改良試薬においては,当初の問題点であったアジ化ナトリウムの影響もほぼ回避されており,他項目測定試薬との並列設置も可能であると考えられた。
シグナスオート LIPにおける基礎的性能は良好であった。試薬調整が不要で開封後の安定性も満足でき,省力化と効率化が期待できることから,日常検査において有用であると考えられた。
本論文に関連し,開示すべきCOI 状態にある企業等はありません。