2018 Volume 67 Issue 3 Pages 334-339
2018 Volume 67 Issue 3 Pages 334-339
線溶抑制因子の一つであるPAI-1は,炎症性サイトカインにより発現が惹起されるため,PAI-1の増加は主に敗血症に起因する線溶抑制型DICを示唆する所見として重要である。従来,PAI-1測定には専用機器および試薬が必要であったが,汎用機に搭載可能な「ナノピア® PAI-1」が開発されたことから,その基礎的検討を行った。同時再現性のCVは1.29~3.85%と良好だった。オンボードでの試薬安定性を検討した結果,試薬架設後6日目に測定値の低下がみられたが,測定毎に試薬を架設した室内精度のCVは2.32~5.09と良好だった。また,共存物質の影響は認められなかった。希釈直線性は良好であり,実効検出感度は臨床上も十分な値であった。プロゾーン現象もみられなかった。対照試薬との比較においても,良好な相関性が得られた。さらに,試料中の残存血小板による測定値への影響を検討したが,調整直後の試料では残存血小板数増加による測定値の上昇は認められなかった。一方,凍結融解を行った試料では残存血小板数および凍結融解数に依存した測定値の上昇傾向を認めた。このことより,PAI-1を精度よく測定するためには,「凝固検査検体取り扱いに関するコンセンサス」に従った検体調整を行い,凍結融解は1回までとすることが必要と考えられた。本試薬の基本性能は良好であり,汎用機に搭載可能であることから,日常検査および緊急検査に有用であると考えられた。
プラスミノーゲンアクチベータインヒビター1(plasminogen activator inhibitor-1; PAI-1)は組織プラスミノーゲンアクチベータ(tissue plasminogen activator; t-PA)と結合し,線溶反応を抑制するセリンプロテアーゼインヒビターである。PAI-1はインターロイキン6などの炎症性サイトカインによりその発現が惹起されるため1),PAI-1の増加は,主に敗血症から引き起こされる線溶抑制型の播種性血管内凝固症候群(disseminated intravascular coagulation; DIC)を示唆する所見であり,DICの病型分類2),3),および敗血症性DICの予後不良因子として重要とされている4),5)。しかし,従来PAI-1の測定には,専用の機器および試薬が必要であった。今回,我々は,ラテックス免疫比濁法を測定原理とする,汎用機へ搭載可能なt-PA・PAI-1複合体測定試薬「ナノピア® PAI-1」が新たに開発されたことから,その性能評価を行った。
当院で凝固検査目的に提出された3.2%クエン酸Na加血漿(遠心条件:2,330 g・10分)の残余検体を用いて検討を行った。尚,検体は測定まで−80℃で凍結保存し,凍結融解は1回までとした。
2. 方法 1) 測定試薬および機器PAI-1は,「ナノピア® PAI-1」(積水メディカル(株))を用いて全自動血液凝固測定装置「CS-5100」(シスメックス(株))で測定した。対照試薬には「LPIA t-PAIテスト」を使用し,全自動臨床検査システム「STACIA」(いずれも(株)LSIメディエンス)で測定した。
2) 測定原理本試薬はラテックス免疫比濁法を測定原理としている。本試薬に用いられている抗ヒトPAI-1マウスモノクローナル抗体感作ラテックスは,t-PA・PAI-1複合体および活性型,潜在型の遊離PAI-1と結合して凝集する。この凝集による濁度の変化量を分光光度計により測定し,検体中のPAI-1濃度を算出する。
3) 同時再現性2濃度のプール血漿をそれぞれ20回連続測定し,同時再現性を調べた。
4) 試薬安定性試薬を開封後,機器に架設した状態での安定性を調べるため,2濃度のプール血漿を架設直後,および2日毎に測定を行った。
5) 室内精度試薬を測定毎に転倒混和したのち機器に架設し,試薬安定性に用いた試料と同様の2濃度のプール血漿を,30日間中任意の20日において,午前および午後にそれぞれ測定を行い,室内精度を検討した。
6) 共存物質の影響患者プール血漿に5段階希釈した抱合型ビリルビン,遊離型ビリルビン,溶血ヘモグロビン,乳び,およびリウマトイド因子(干渉チェックAプラス,干渉チェックRF;シスメックス(株))を添加し,各系列において3重測定を行い,その影響を検討した。
7) 希釈直線性高濃度のPAI-1試料を生理食塩水で10段階希釈後,3重測定して希釈直線性を調べた。
8) プロゾーン現象理論値2,400 ng/mLの高PAI-1試料を,生理食塩水で10段階希釈し,プロゾーン現象の有無を検討した。
9) 実効検出感度6濃度の試料を5日間2重測定し,実効検出感度を調べた。
10) 対照試薬との相関患者血漿の残存検体60例を対象に,本試薬と対照試薬における相関性を検討した。
11) 残存血小板の影響残存血小板によるPAI-1測定値への影響について検討した。同一患者血液から作製した,多血小板血漿(platelet-rich plasma; PRP)および乏血小板血漿(platelet-poor plasma; PPP)を使用し,血小板数が,0,5,10,20,40および80 × 103個/μLになるよう調整した各試料のPAI-1濃度を測定した。また,各試料を最大3回まで凍結融解を繰り返した後にPAI-1濃度を測定し,凍結融解数による影響についても検討を行った。
3. 倫理的対応本研究は札幌医科大学附属病院臨床研究審査委員会の承認を得て行った(承認番号:282-231)。
同時再現性の変動係数(CV)は1.29~3.85%と良好であった(Table 1)。
| Low | High | |
|---|---|---|
| Mean (ng/mL) | 48.23 | 158.10 |
| SD (ng/mL) | 1.86 | 2.03 |
| CV (%) | 3.85 | 1.29 |
架設直後の測定値を100%とすると,6日経過後に低濃度試料で11.2%,高濃度試料で7.8%の測定値減少がみられた(Figure 1)。
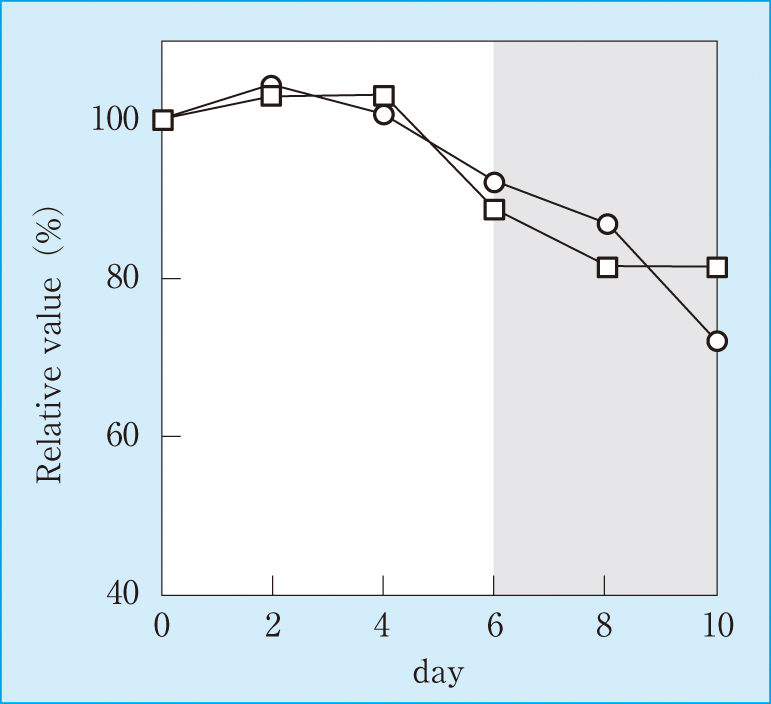
Reagent stability on-board
Circles: high concentration sample
Squares: low concentration sample
測定毎に試薬を架設する条件では,日数経過による測定値の低下はみられず,CVも最大で5.09%と良好だった(Figure 2)。

Between day precision
Circles: high concentration sample
Squares: low concentration sample
Solid line: A.M.
Dotted line: P.M.
未添加時の濃度を100%とし,±5%を連続して超えた場合を影響ありとすると,いずれの添加時においても測定値への影響はなかった(Figure 3)。

Effect of interfering substances
Dotted line: 100 ± 5%
本試薬の測定上限300 ng/mLを超える,360 ng/mLまで良好な直線性が確認された(Figure 4)。

Dilution linearity
検討範囲内において,吸光度および測定値の低下はみられなかった(Figure 5)。

Prozone test
Circles: PAI-1 concentration
Squares: optical density
Precision Profileを作成し,CV 20%以下となる値を実効検出感度とすると,12.2 ng/mLと臨床上十分な検出感度を有していた(Figure 6)。

Quantitation limit
Dotted line: CV 20%
対照試薬との相関性を検討した結果,相関係数(r)は0.99と良好で,回帰式もy = 1.05x − 5.76と近似した値であった(Figure 7)。

Correlation of the PAI-1 concentration between “nanopia PAI-1” and “LPIA PAI-1”
試料調整直後では残存血小板数増加によるPAI-1の測定値変動は認められなかった(Figure 8)。一方,凍結融解を行った試料では残存血小板数および凍結融解数依存性に測定値が上昇する傾向が認められ,最も変化のみられたSample 6では,調整直後の値(3.5 ng/mL)と比べて凍結融解3回目の値は33.9 ng/mLと,約10倍増加した。
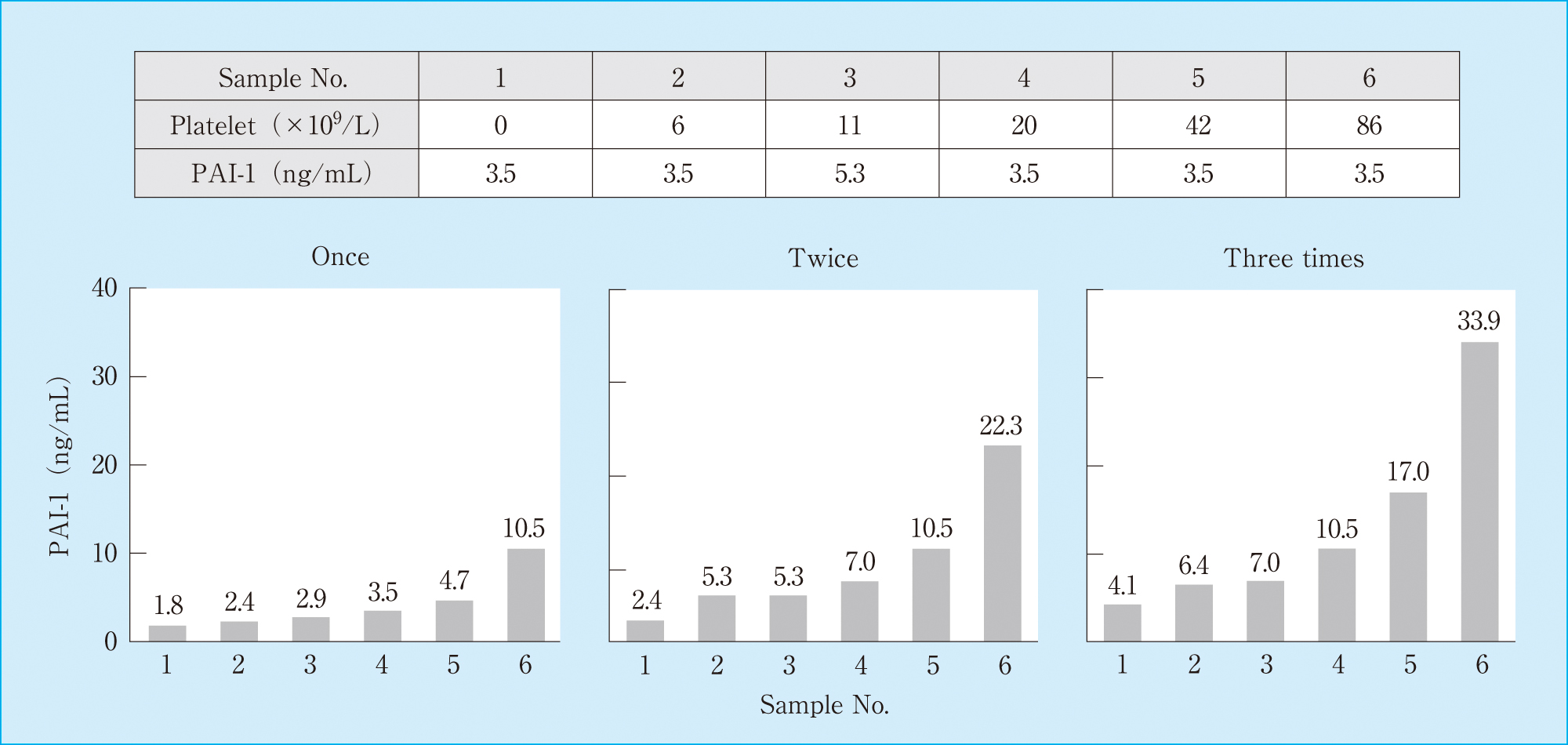
Effect of residual platelets in plasma and freeze-thaw cycle to PAI-1 concentration
t-PA・PAI-1複合体測定試薬「ナノピア® PAI-1」における再現性,および検出感度は良好で,共存物質の影響もみられなかった。直線性は本試薬の測定上限を超える360 ng/mLまで得られ,ラテックス凝集法を用いた他の試薬と比較し向上していた6)。また,対照試薬との相関性も良好であり,測定値の差異はみられなかった。本検討に用いた測定機器「CS-5100」の試薬庫は10℃に保冷されており,経時的な試薬の劣化に対しての措置が講じられている。保冷機能があるにも関わらず,オンボード条件において試薬架設後6日目に測定値が低下した一因として,試薬中のラテックスが日数経過に伴い沈降したことが考えられた。そこで,測定毎に転倒混和した試薬を架設して測定を行ったところ,初回搭載時より30日目まで測定値の低下を認めなかった。このことより,CS-5100に本試薬を搭載する場合は,測定日毎に試薬を転倒混和する必要があると思われた。
PAI-1は血小板内にも存在することから,試料中の残存血小板に由来するPAI-1が,測定値に影響を及ぼすことが知られている7)。そこで,PPPおよびPRPを用い,試料中に含まれる残存血小板,および凍結融解に伴う残存血小板の破壊により生じたPAI-1が本試薬に与える影響を検討した。その結果,調整直後の各試料のPAI-1濃度は残存血小板数の多寡に関わらず同程度であったため,遠心分離直後の検体においては残存血小板数の影響はないと思われる。一方,凍結融解後の試料では残存血小板数および凍結融解数に依存した測定値の上昇が認められた。Boothら7)は,超音波処理して血小板を破壊したPRPにおいて,その血小板数とPAI-1濃度が正に相関をすることを報告している。本検討では,凍結融解による血小板の破壊を直接確認してはいないが,Boothらと同じく血小板の破壊に伴うPAI-1の放出により測定値が上昇したことが推察された。すなわち,PAI-1測定試料の調整,特に凍結保存する場合は,「凝固検査検体取り扱いに関するコンセンサス」8)に従い,血小板数を10 × 103/μL以下とすることが望ましく,凍結融解は1回までとすることが,PAI-1をより精度よく測定するうえで必要と考えられた。
本試薬の基本性能は良好で,汎用機に搭載可能なことから,日常検査および緊急検査に有用で,特に迅速なDICの病態把握に貢献できると思われた。
本論文に関連し,開示すべきCOI 状態にある企業等はありません。