2018 Volume 67 Issue 5 Pages 701-707
2018 Volume 67 Issue 5 Pages 701-707
これまで,血中可溶性インターロイキン2受容体測定試薬は,専用機器を必要とし汎用の自動分析装置では測定できなかった。最近,ラテックス免疫比濁法を原理とした汎用試薬「ナノピアIL-2R」が開発されたので,基本性能について検討した。再現性,希釈直線性と検出限界は良好な結果が得られた。また,プロゾーン現象や共存物質の影響は,認められなかった。対照試薬との相関係数は0.972と高く,回帰式はy = 0.97x + 8.83と近似した値であった。しかし,偽高値と偽低値の非特異反応を呈する検体が1例ずつみられた。偽高値例をDTT処理しIgMを不活化すると,測定値が低下したため患者血清中のIgMが偽高値の原因と考えられた。一方,偽低値例の添加回収試験を行うと回収率は低く,本試薬を用いたsIL-2R測定に干渉する物質が血清中に存在すると考えられた。以上の結果より,本試薬の基本性能は良好で,日常検査に十分な性能を有していた。しかし,偽高値や偽低値を呈する検体には注意を要する。
可溶性インターロイキン2受容体(soluble interleukin-2 receptor; sIL-2R)は,IL-2Rα鎖の一部が細胞膜から血中に遊離したものである。その血中濃度は,成人T細胞性白血病/リンパ腫(adult T-cell leukemia/lymphoma; ATLL)1)や悪性リンパ腫2),3)等の造血器悪性腫瘍,癌4),5),感染症6),自己免疫疾患7)や血球貪食症候群8)で高値となる。血中sIL-2Rは悪性腫瘍の診断,経過観察や予後因子,自己免疫疾患の活動性の判定やウイルス性肝炎の治療モニターに有用と報告されている9)~11)。特に,ATLLと悪性リンパ腫の診断や経過観察に関しては,保険収載されており日常検査として用いられている。また,血球貪食症候群では,診断基準(HLH-2004)の一つにsIL-2R値が含まれている12)。
これまで血中sIL-2R濃度は,酵素結合免疫吸着法(enzyme-linked immunosorbent assay; ELISA)や化学発光酵素免疫法(chemiluminescent enzyme immunoassay; CLEIA)13)で測定されていたが専用機器を必要とし,広く普及している自動分析装置での測定は出来なかった。最近,ラテックス免疫比濁法を原理とした汎用sIL-2R測定試薬「ナノピアIL-2R」が開発されたので,その基本性能を評価した。
当院において,sIL-2R検査が行われた患者血清を用いた。
2. 方法 1) 測定試薬および機器「ナノピアIL-2R」(積水メディカル株式会社)を用い,「自動分析装置7180」(株式会社日立ハイテクノロジーズ)で測定した。対照試薬として,CLEIA法の「デタミナーCL IL-2R」(協和メデックス株式会社)を使用し,「全自動化学発光免疫測定装置CL-JACK NX」(協和メデックス株式会社)で解析した。
2) 再現性3濃度のプール血清を20回連続測定し,同時再現性を検討した。また,同じ試料を−80℃で凍結保存し,初回のみキャリブレーション後,20日間2重測定(午前と午後に1回ずつ)して日差再現性を検討した。
3) 希釈直線性約10,000 U/mLのプール血清を,生理食塩水で10段階希釈後3重測定した。
4) プロゾーン約140,000 U/mLの高濃度試料を,生理食塩水で10段階希釈後3重測定した。
5) 検出限界85 U/mLのプール血清を生理食塩水で5段階希釈後,10重測定し2SD法で解析した。
6) 共存物質の影響干渉チェック・Aプラス(シスメックス株式会社)を使用した。プール血清に5段階希釈した遊離型ビリルビン,抱合型ビリルビン,乳びと溶血ヘモグロビンを添加後3重測定した。
7) 従来法との相関性104例の患者血清を本試薬と対照試薬で測定し,相関係数(r)と回帰式を算出した。回帰式から求めた理論値と実測値との差の平均値を算出し,その4倍以上変動がみられたもの,あるいは測定値が2倍以上や0.5以下の差を認めたものを乖離例とした。
8) 希釈試験乖離例を生理食塩水で2倍,4倍,8倍に希釈し本試薬と対照試薬で測定後,それぞれ希釈倍率を掛けてsIL-2R値を算出した。未希釈検体の±30%以上変動を認めた場合を非特異反応の可能性ありとし,以下の追加検討を行った。
9) ジチオスレイトール(dithiothreitol; DTT)処理によるIgMの不活化乖離例No. 3の血清と0.01MのDTTあるいは生理食塩水を7:3の比率で混和し,37℃で1時間反応させた。その後,sIL-2Rを測定し希釈倍率をかけてsIL-2R値を算出した。対照検体として,IgM値が正常(58 mg/mL)の患者血清を用いた。また,乖離例No. 3を生理食塩水で2倍,4倍,8倍および16倍に希釈したサンプルも同様にDTT処理した。
10) 添加回収試験乖離例No. 1の血清とsIL-2R標準液(約10,000 U/mL)を9:1,7:3,5:5,2.5:7.5,1.25:8.75および0.625:9.375の割合で混合し,sIL-2Rを測定後理論値に対する比率を求めて回収率を算出した。対照検体として,本試薬と対照試薬との間で測定値の乖離がなく,乖離検体とsIL-2R値が近似している(184 U/mL)患者血清を用いた。
11) HPLC法によるIgG分画の分取と添加回収試験カラムはMAbPac SEC-1(サーモフィッシャーサイエンティフィック株式会社)を使用し,血清50 μLを流速0.76 mL/minにて分画した。溶出時間11分30秒~12分にあたる分画を分取した。分取後,BJPコンセントレーター(株式会社ヘレナ研究所)で濃縮した。IgG分画とsIL-2R標準液(約10,000 U/mL)を9:1の割合で混合し,sIL-2Rを本試薬で測定後理論値に対する比率を求めて回収率を算出した。
同時再現性と日差再現性の変動係数(CV)は,それぞれ1.1~2.8%,1.6~4.7%と良好であった(Table 1, 2)。
| Low | Medium | High | |
|---|---|---|---|
| Mean (U/mL) | 466 | 1,964 | 8,764 |
| SD (U/mL) | 13.2 | 20.7 | 132.0 |
| CV (%) | 2.8 | 1.1 | 1.5 |
| Low | Medium | High | |
|---|---|---|---|
| Mean (U/mL) | 525 | 2,003 | 8,963 |
| SD (U/mL) | 24.9 | 32.4 | 197.0 |
| CV (%) | 4.7 | 1.6 | 2.2 |
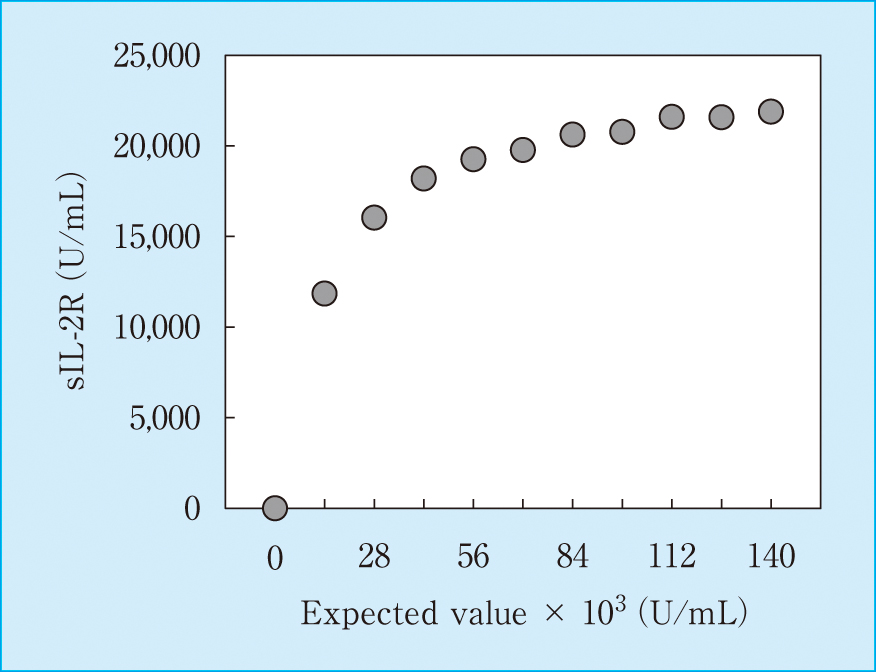
8,852 U/mLまで良好な直線性が確認された(Figure 1)。

Dilution linearity test
検討範囲内でプロゾーンはみられなかった(Figure 2)。
Prozone phenomenon analysis
検出限界は34.9 U/mLであった(Figure 3)。

Detection limit analysis
Dotted line: zero concentration value + 2SD.
未添加時における測定値の±2SD(図中破線)を超えた場合を影響ありとすると,検討範囲内で測定値に変動はなかった(Figure 4)。

Effects of interfering substances on measurement of sIL-2R
Dotted line: untreated value ± 2SD.
本試薬と対照試薬はr = 0.972,y = 0.97x + 8.83と良好な相関性を示したが,乖離例を3例認めた(Figure 5,乖離例:図中①~③)。

Correlation of measured values between Nanopia IL-2R and Detamina CL IL-2R using serum samples
Open circles: samples of discrepancy.
1: IgG4-related disease
2: Malignant lymphoma
3: Juvenile myelomonocytic leukemia
乖離例の希釈試験を行ったところ,対照試薬ではいずれの検体でも明らかな非特異反応を認めなかった(Figure 6左図)。一方,本試薬の乖離例No. 1は希釈率が上がるとsIL-2R値が上昇し,8倍希釈では原液比664%と高値になった(Figure 6右図○)。また,乖離例No. 3は8倍希釈では原液と同程度であったが(Figure 6右図◆),2倍と4倍希釈ではそれぞれ原液比51%,44%と低値になった(Figure 6右図◇)。このことから,乖離例No. 1は偽低値,乖離例No. 3は偽高値の可能性が考えられた。

Dilution analysis in samples of discrepancy
Dotted line: untreated value ± 30%.
乖離例No. 3のIgM濃度が高値(4,479 mg/dL)であったため,DTT処理しIgMを不活化後sIL-2Rを測定した。その結果,乖離例No. 3のsIL-2R値はDTT処理により未処理の45%(1,423 U/mL)に低下し,対照試薬での測定値(1,279 U/mL)と同程度となった(Table 3)。また,乖離例No. 3の希釈検体をDTT処理すると希釈倍率8倍,16倍での偽高値は消失した(Table 4)。
| Sample | DTT− (U/mL) | DTT+ (U/mL) | DTT+/DTT− ratio | |
|---|---|---|---|---|
| Nanopia IL-2R | False high value | 3,177 | 1,423 | 45% |
| Control | 5,757 | 5,479 | 95% | |
| Detamina CL IL-2R | False high value | 1,299 | 1,279 | 98% |
| Control | 4,903 | 4,470 | 91% |
| Diluted sample | DTT− (U/mL) | DTT+ (U/mL) |
|---|---|---|
| ×2 | 2,064 | 1,632 |
| ×4 | 1,788 | 1,508 |
| ×8 | 5,032 | 1,472 |
| ×16 | 5,072 | 1,408 |
偽低値を示した乖離例No. 1の添加回収試験を行った。その結果,対照検体の回収率は98~105%であったのに対し,乖離例は血清の比率が5割を超えると58~67%と低値であった(Table 5)。
| Sample | Mixture ratio (serum:standard) | |||||
|---|---|---|---|---|---|---|
| 9:1 | 7:3 | 5:5 | 2.5:7.5 | 1.25:8.75 | 0.625:9.375 | |
| Discrepancy (%) | 61 | 58 | 67 | 86 | 93 | 96 |
| Control (%) | 98 | 102 | 104 | 104 | 105 | 100 |
乖離例No. 1のIgG分画を用いて添加回収試験を行ったところ,回収率は98%であった。
今回我々は,ラテックス免疫比濁法を原理とし,汎用のsIL-2R測定試薬である「ナノピアIL-2R」の基本性能を評価した。同時再現性のCVは最大でも2.8%と良好で,日差再現性も安定していた。希釈直線性は,測定範囲上限付近まで直線性が認められ,約140,000 U/mLまでプロゾーンはみられなかった。本試薬の測定上限は,10,000 U/mLと今回使用した対照試薬の50,000 U/mLより低い。しかし,2016年5月~2017年10月までの間に当院で測定した5,484例のsIL-2R濃度分布を調べると,本試薬の測定上限を超える検体は12例(0.22%)のみであったことから,日常検査において十分な測定範囲を有していると考えられた。対照試薬との相関性も良好であったが乖離例を3例認めた為,希釈試験を行い正確度の評価を行った。その結果,3例中1例では両試薬で明らかな非特異反応を認めなかった。この検体の診断名は悪性リンパ腫であるが,相関性の検討に用いた他の悪性リンパ腫検体では乖離がみられなかった。両試薬の測定値に差異を認めた原因は明らかでないが,用いている抗体が異なるため反応性の違いが推察された。一方,本試薬で偽高値,偽低値の非特異反応を1例ずつ認めた。以前我々は,検体中の異常IgMがsIL-2R値に及ぼす影響を報告している14)。そこで,乖離検体中のIgM濃度を測定したところ,偽高値例で高かったためDTT処理を行った。その結果,偽高値は消失し,対照試薬での測定値と同程度となった。このことから,検体中のIgMが本試薬の偽高値の原因であると考えられた。この検体のIgMが高値を示した理由は不明であったが,M蛋白ではなくポリクローナルな増加であった。また,既報14)でIgMによる非特異反応を認めた試薬は,今回の偽高値例で明らかな非特異反応を示さなかった。これは,両試薬においてIgMによる干渉様式が異なる可能性を示唆している。さらに,偽高値例を生理食塩水で希釈することでみられたsIL-2Rの異常高値もDTT処理により消失したことから,IgMの関与が疑われた。2倍および4倍希釈では異常高値を示さず,8倍希釈で異常高値となった理由は,蛋白濃度や塩濃度の低下が測定系に何らかの影響を及ぼした可能性が考えられるが,詳細は不明である。次に,偽低値の原因を調べるため添加回収試験を行ったところ,回収率は低値であったことから,本試薬の測定系に抑制的に作用し,sIL-2R値を低下させる物質が血清中に存在すると考えられた。偽陰性を起こす原因物質としては,IgGが報告されている15)。そこで,HPLC法により偽低値例のIgG分画を分取し添加回収試験を行ったが,回収率は98%と低下はみられず,IgGの関与は明らかでなかった。また,本症例は抗ミトコンドリアM2抗体が陽性であり,自己抗体の影響も否定できないがsIL-2R値を抑制する物質の特定には至らなかった。
「ナノピアIL-2R」の基本性能は良好で,日常検査に十分な性能を有していた。しかし,偽高値や偽低値を呈する検体が存在するため,初回異常値や前回値との差があるときは,臨床背景あるいは他の検査結果(免疫グロブリン値や蛋白分画,悪性リンパ腫であればLDや画像検査等)の確認が必要である。
本研究は,札幌医科大学附属病院臨床研究審査委員会の承認を得て施行した(整理番号:292-32)。
本論文に関連し,開示すべきCOI 状態にある企業等はありません。