2018 Volume 67 Issue 5 Pages 660-667
2018 Volume 67 Issue 5 Pages 660-667
今回,関節液98例および人工関節周囲材料140検体を用いてPCRラテラルフロー法(PCR-LF法)によるブドウ球菌系3菌種(methicillin-sensitive Staphylococcus aureus; MSSA, methicillin-resistant Staphylococcus aureus; MRSA, methicillin resistant-coagulase negative staphlyococci; MR-CNS),それ以外の細菌は16SリボゾームRNA(16S-rRNA法)の解析を実施し,人工関節感染症における術中検体を用いた細菌遺伝子検査の有用性を検討した。その結果,PCR-LF法を用いた関節液より細菌遺伝子24検体(MSSA: 5.1%, MRSA: 9.2%, MR-CNS: 10.2%)が検出された。PCR-LF法が陰性であった74検体は16S-rRNA法を用いたシーケンスによる菌の推定を行った。しかし,16S-rRNA法は増幅酵素由来のEscherichia coliや試薬中に存在する他の細菌によるコンタミネーションが発生し検出感度に問題が生じた。よって,真核細胞をホスト細胞として作製したEukaryote-made Taq polymerase(E-Taq)を用いてbacterial DNA contamination freeを確認した結果,術中材料より直接的に1 × 102(CFU/mL:50%検出)まで細菌の遺伝子検出が可能となった。E-Taqを用いた16S-rRNA法では,74検体中19検体から細菌遺伝子を検出しシーケンス解析により菌を推定した。遺伝子検査法は培養同定検査に比べて検出率が1.5倍高値を示した。しかし,培養同定検査が陰性を示した8検体(MSSA:3例,MR-CNS:3例,MRSA:2例)および同時に採取された組織材料3検体(MSSA:2例,MR-CNS:1例)の術中組織材料から細菌遺伝子が検出され,採取時のコンタミネーションが生じる可能性が示唆された。以上より,PCR-LF法およびE-Taqを用いた16S-rRNA法は良好な感度および特異性を示し,人工関節感染症の感染診断として臨床応用が可能であると考えられた。
近年,人工関節はインプラントの飛躍的な機能向上により生活の質の改善に極めて有効な治療法とされているが,人工関節感染症(prosthetic joint infection; PJI)が最も重篤な合併症となっている。米国感染症学会によるガイドラインでは,PJI の診断根拠(definitive evidence)として術中の二つ以上の組織検体の培養,あるいは術前・術中の穿刺液の培養において同一の微生物が検出された場合とされている。感染が疑われた場合のGold standardは,培養検査による起炎菌の同定が重要である。しかし,培養同定検査は検査時間が長く検出感度が低いため十分な診断法とは言えず,感染診断に苦慮する場合が少なくない。よって,臨床検査の場で感染症遺伝子検査が活用されている1),2)。
今回,我々は術中検体を用いた迅速細菌遺伝子検査法の確立を目的とし,polymarase chain reactionラテラルフロー法(PCR-LF法)を原理とする遺伝子検出試薬を用いて,関節液あるいは術中人工関節組織材料からメシチリン感受性黄色ブドウ球菌(MSSA),メチシリン耐性黄色ブドウ球菌(MRSA)およびメチシリン耐性コアグラーゼ陰性ブドウ球菌(MR-CNS)の解析を実施した3)。本法は約3時間でMRSAが検出可能であるが,これら3菌種以外は16SリボゾームRNAを用いたシーケンス(16S解析法)により菌を推定した4),5)。市販のPCR増幅試薬では16S解析法にてサイクル数が増加した場合,Escherichia coli(E. coli)による酵素由来のゲノムコンタミネーション,細菌培養検査との乖離などの問題が生じた。以上の問題点を考慮し,術中検体を用いた細菌遺伝子検査の有用性について検討した。
平成27年4月から平成29年3月までの期間に,北里大学病院整形外科を受診した人工関節感染症の患者から採取した関節液98検体,および術中の組織材料140検体(滑膜14検体,頚骨32検体,大腿骨周辺組織34検体,骨髄内組織10検体,ステム周辺組織20検体,脛骨周辺組織20検体,セメントスペサー周辺組織10検体)を対象とした。関節液はテルモシリンジ(TERUMO)で採取後,無菌的に採取管(EDTA-2Na:テルモ)に分注した。関節組織材料は滅菌処理した滅菌サンプルバック(アズワン)に無菌的生理食塩液1 mLを添加し保存した。
2. 方法 1) 培養同定検査関節液は,HK半流動培地で培養を行い5%ヒツジ血液加寒天培地,チョコレート寒天培地,BTB乳糖加寒天培地およびBHK寒天培地(極東)を用いてサブカルチャーを行った。培地上に発育した集落は,CLSI(Clinical and Laboratory Standards Institute)に準拠6)したMicroScan WalkAway-96SI(SIEMENS)を使用し,各菌種用専用パネルを用いて菌種同定・薬剤感受性を行い,各遺伝子検査法と比較した。操作法・判定法は添付書の指示に従った。
2) DNA抽出 ① 関節液EDTA-2Na管に採取した関節液200 μLにリゾスタフィン処理後(室温10分),DNA amp MiniKIT(QIAGEN)を用いて抽出した(QIA法)。特に,粘性が強い場合はNALC-NaOH液(BD MycoPrepTM)200 μLを添加し,1分間,激しく混合して抽出試薬のW1液の洗浄操作を2回繰り返した。
② 術中組織材料生体の組織は溶解しにくいが,簡易的で迅速性に優れた超音波での前処理を行った7)。滅菌サンプルバックに採取した組織材料は,無菌生理食塩液1 mLを添加し超音波洗浄装置で31 Hz,3分処理後,QIA法を用いて抽出した。
3) 細菌遺伝子検査 ① PCRラテラルフロー法(PCR-LF)によるMSSA,MRSAおよびMR-CNSの検出PCR-LF法は,Staphylococcus aureusが保有するfemA遺伝子とMRSAのmecAを同時に増幅する。DNAの増幅の判定は,probeスティックに金コロイド液で染色を行い,その各バンドを陽性対照と比較して目視判定した3)。
② 16S解析法抽出したDNAは,16S-rRNA遺伝子を増幅するユニバーサルprimerを用いたPCR法によって増幅した4),5)。PCR溶液25 μLは,TAKARA Ex Taq(TAKARA)を添付説明書に従い調整し,抽出DNA 5 μLを添加した(Ex-Taq法)。PCR法は,95℃5分後,35サイクル(95℃30秒,60℃30秒,72℃1分),72℃5分増幅した。DNAの増幅の判定は,Nuclease-Free Water(Cosmo BIO: N-Free Water)を陰性の対象として,電気泳動後,エチジウムブロマイド(ethidium bromide; EtBr)染色(ニッポン・ジーン)を説明書に従い染色し増幅酵素由来のE. coliや,試薬中の他の細菌によるコンタミネーションが陰性であることを目視判定した。PCR産物は,PCR産物精製キットNucleospin Gel and PCR Clean-up(TAKARA)を用いて精製した。細菌の推定は,16S-rRNAの領域(約1,500 bp)の保存性の高い約500 bpの519aと907aのシーケンスprimerを用いて測定した。その精製産物を鋳型として,シーケンスPCRキット:BigDye Terminator v 1.1 Cycle Sequencing Kit(Applied Biosystems)を用いて添付説明書に従い標識反応した。シーケンス産物は,精製キットBigDye® Xterminator Purification Kit(Applied Biosystems)を用いて精製した。精製済みのシーケンスPCR産物は,シーケンサー3500XL GenticAnalyzer装置(Applied Biosystems)を用いて塩基配列を解析した。得られた塩基配列はDNA Data Bank of Japan(DDBJ)のBLAST検索によりアライメントを行い,99%以上の相同性がある菌種について検索を行った。
③ PCR増幅試薬の比較PCR増幅試薬は,市販3種類のEx-Taq法,AmpliTaq Gold®(ThermoFisher:AmpG法)およびFastStart SYBR Green Master(Roche:SYBR法)を用いて,MRSA IIの16S-rRNA遺伝子を増幅しバンドの有無を比較した。また,真核細胞をホスト細胞として作製したEukaryote-made Taq polymerase(製造:北海道三井化学株式会社,提供:三井化学株式会社)は,Niimiらの方法8)に従い解析した(E-Taq法)。SYBR法はRealtime PCR装置(LightCycler Nano: Roche)を使用し,PCR溶液20 μLに抽出DNA 5 μLを添加した。MRSA II型のMacfarland 0.5菌液を無菌生理食塩で10倍希釈液を作製し感度試験を検討した。PCR条件は,95℃3分後,(95℃10秒,60℃20秒,72℃50秒),72℃5分増幅し,35,45,55 cycleで増幅した。
4) 各検査法から得られた結果の比較PCR-LF法および16S菌検索法から得られた結果を個々に比較検討した。
関節液および人工関節組織材料に由来した患者の背景および検査所見の一部を示す(Table 1)。98例の内訳は男性26検体,女性72検体で,検査依頼時の年齢は中央値67.1歳(16~88歳)であった。細胞数の中央値は29,903 cell/μL(143~195,000 cell/μL),血清CRPの中央値は6.25 mg/dL(0.03~30.6 mg/dL)であった。なお,細菌顕微鏡検査ではグラム陽性菌が4検体,グラム陰性菌が1検体,抗酸菌陽性が1検体であった。
| Cases mean (min~max) | |
|---|---|
| All | 98 |
| Male | 26 |
| Female | 72 |
| Age | 67.1 (16~88) |
| Synovial fluid (cell/μL) | 29,903 (143~195,000) |
| Bacterial microscopy | 6 (GP: 4 GN: 1 MT: 1) |
| Serum CRP (mg/dL) | 6.25 (0.03~30.6) |
GP: Gram-positive bacteria, GN: Gram-negative bacteria, MT: Mycobacterium tuberculosis
MRSA-IIの10倍段階希釈の菌液を用いて2重測定したPCR-LF法の検出感度は,1 × 102 CFU/mL,50 cycle増幅したE-Taq法の検出は1 × 102 CFU/mLを50%検出できる感度であった(50%検出)(Table 2)。
| (CFU/mL) | 1 × 108 | 1 × 107 | 1 × 106 | 1 × 105 | 1 × 104 | 1 × 103 | 1 × 102 | 1 × 101 |
|---|---|---|---|---|---|---|---|---|
| PCR-LF | (+) | (+) | (+) | (+) | (+) | (+) | (+) | (−) |
| 16S-rRNA | ||||||||
| Ex-Taq | (+) | (+) | (+) | (+) | (+) | (−) | (−) | (−) |
| (35 cycle) | (+) | (+) | (+) | (+) | (−) | (−) | (−) | (−) |
| E-Taq | (+) | (+) | (+) | (+) | (+) | (+) | (+) | (−) |
| (50 cycle) | (+) | (+) | (+) | (+) | (+) | (+) | (−) | (−) |
PCR-LF: PCR lateral flow method, 16S-rRNA: 16S ribosomal RNA method, PCR assay Ex-Taq (TAKARA Ex Taq), E-Taq (Eukaryote-made Taq polymerase)
4種類のPCR 増幅法を用いた陰性確認の電気泳動を示す(Figure 1)。N-Free Waterを用いて,35 cycleから55 cycleのPCR増幅を3日間測定し,E-Taq法では55 cycleまではバンドが陰性であることを確認した。市販3種類のPCR増幅試薬に関しては,45 cycleから陰性対照のN-Free Waterにバンドが認められ,陰性が確認できた35 cycleまでは大腸菌ホストのゲノムのバンドは認めなかった。市販のEx-Taq PCR試薬を35 cycle増幅した場合,1 × 104 CFU/mL(50%検出)とE-Taq試薬の感度に約100倍の差を認めた(Table 2)。

Effect of bacterial contamination using eukaryote-made thermostable DNA polymerase and Escherichia coli-made polymerase
Gels showing the PCR assay products (35, 45 and 55 cycles) of bacterial 16S ribosomal RNA genes in the Nuclease-Free Water or MRSA II using the universal primers. Commercial bacterially made thermostable of three companies were tested. MW: 100 bp DNA Ladder ① No. 2・6・10: TAKARA Ex Taq No. 3・7・11: Amplitaq Gold No. 4・8・12: SYBR Green ② No. 5・9・13: eukaryote-made thermostable DNA polymerase (PCR assay 55 cycles) for bacterial contamination of nuclease free water using bacterial universal primers.
関節液98例におけるPCR-LF法を用いた細菌遺伝子の検出結果を示す(Figure 2)。MSSA 5検体(5.1%),MRSA 9検体(9.2%),MR-CNS 10検体(10.2%)から細菌遺伝子が検出された。PCR-LF法が陰性を示した74検体について,E-Taqを用いた16S解析法で菌の推定を実施した。その結果,グラム陽性菌として,Streptococcus agalactiae 5検体(5.1%),Finegoldia magnaが2検体(2.0%),Propionibacterium acnesが1検体(1.0%),Clostridium leptumが1検体(1.0%),Enterobacter Speciesが1検体,Prevotella oralisが1検体(1.0%),Micrococuuus Speciesが1検体(1.0%),Bacilius thermolactisが1検体を認めた。また,グラム陰性菌ではEscherichia coliが2検体(2.0%),Stenotrophomonas maltophiliaが1検体(1.0%),Klebsiella pneumoniaeが1検体(1.0%)であった。PCR増幅が低濃度を示した2検体に関しては,16S解析法は判定不能であった。
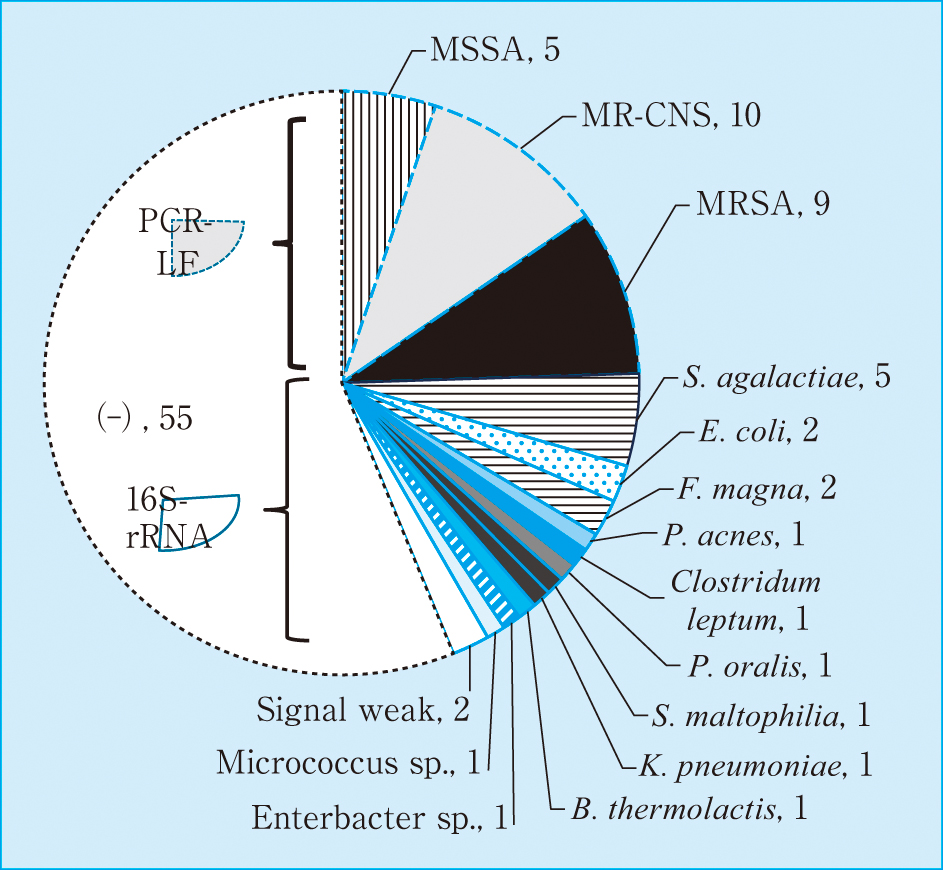
Detection of causative bacterial in prosthetic joint infection samples (n = 98: Syovail fliud)
MSSA: methicillin-sensitive Staphylococcus aureus (n = 5), MRSA: methicillin-resistant Staphylococcus aureus (n = 9), MR-CNS: methicillin resisitant coagrase-negative Staphylococci (n = 10), S. agalactiae: Staphylococcus agalactiae (n = 5), P. acnes: Propionibacterium acnes (n = 1), Clostridium leptum: (n = 1), F. magna: Finegoldia magna (n = 2), B. thermolactis: Bacilius thermolactis (n = 1), P. oralis: Prevotella oralis (n = 1). E. coli: Escherichia coli (n = 2), S. maltphilia: Stenotrophomonas maltophilia (n = 1), Micrococcus sp.: species (n = 1), Enterbacter sp.: species (n = 1), K. pneumoniae: Klebsiella pneumoniae (n = 1), signal weak: indeterminate (n = 2), (−): negative (n = 55).
同時に組織材料が提出された関節液91例についてPCR-LF法と培養同定検査を比較検討した(Table 3)。全体としてPCR-LF法では24例,培養同定法で16例が検出され,PCR-LF法による検出率は培養同定法の1.5倍であった。菌種による陽性一致率の比較では,MSSAが40.0%,MR-CNSが70.0%,MRSAが77.8%であった。また,材料の比較として同時に依頼された関節液と組織材料91例について比較検討した(Table 3)。組織材料との陽性一致率の比較では,MSSAが60%,MR-CNSが75%,MRSAが90%であった。
| PCR-LF assay (synovial fluid) Total: 91 | |||||||
|---|---|---|---|---|---|---|---|
| MSSA | MR-CNS | MRSA | |||||
| (+) | (−) | (+) | (−) | (+) | (−) | ||
| Bacteriological Test (synovial fluid) |
(+) | 2 | 0 | 7 | 0 | 7 | 0 |
| (−) | 3 | 86 | 3 | 81 | 2 | 82 | |
| PCR-LF asssay (periprosthetic samples) | (+) | 3 | 0 | 9 | 2 | 9 | 1 |
| (−) | 2 | 86 | 1 | 79 | 0 | 81 | |
PCR-LF: PCR lateral flow method, MSSA: methicillin-sensitive Staphylococcus aureus, MR-CNS: methicillin resistant coagulase-negative Staphlococci, MRSA: methicillin-resistant Staphylococcus aureus.
術中に左大腿骨頸部内側組織の迅速病理検査,培養同定検査および細菌遺伝子検査が提出されたBHA例の臨床経過を示す(Figure 3)。迅速病理診断では「形質細胞,リンパ球などの炎症細胞浸潤,化膿性炎症に矛盾なし」との診断で,好中球主体の炎症性浸出液が出現していた。7日間の培養同定検査は陰性,PCR-LF法ではmecAが陽性を示し,16S解析法においてS. epidermidisが推定された。その後,Cefazolinの投与により,炎症反応は改善を示した。術中に使用したVancomycinとGentamycinはリン酸カリシウムペーストに入れて局所に使用した。

Clinical course (culture no growth, 16S-rRNA positive)
BHA: bipolar hip arthroplasty
THA: total hip arthroplasty
人工関節における手術部位感染(surgical site infection; SSI)は,抗菌薬が発達した現在においても治療に難渋する場合が多く,早期の感染診断が重要である。日本整形外科学会では,骨・関節術後感染予防ガイドラインを2006年5月に作成し,以後も定期的に改定を行っている9)。本来,骨・関節は無菌的であるが,人工関節などの異物の存在下では少量の菌により感染症を生じ,関節インプラント,プレートなどの人工関節を抜去せざるを得ない合併症が生じる。よって,PJIの迅速的な感染診断および治療が重要であり10),術中に採取した組織や関節液に対する感染診断により,一期的置換か二期的置換かの選択が行われる。なお,起炎菌同定のGold standardは細菌検査であるが,迅速的な判定には細菌顕微鏡検査が必要である。しかし,関節液や周囲組織における細菌顕微鏡検査の感度は低く,報告時間と検出感度に限界がある。近年,遺伝子検査技術の向上により細菌感染症の迅速診断が可能となり,関節置換術時PJIの感染診断に活用されている11)~13)。
今回,我々はPJIにおいて,直接的に細菌の特異的遺伝子が検出可能なPCR-LF法および16S解析法を用いて,術中の細菌遺伝子検査の有用性について検討を行った。
検出感度に関しては,MRSA IIの菌液を用いたPCR-LF法は1 × 102 CFU/mLを示した。16S解析法では市販のPCR増幅酵素を用いた場合,PCR-LF法に比べ約1/100感度が低下した。なお,通常に市販されているE. coli由来のPCR酵素(Ex-Taq法,AmpliTaq法,SYBR法)を用いて35 cycle以上でPCR反応を行った場合,大腸菌ホストのゲノムにおけるコンタミネーションがしばしば問題視されている8)。そこで,Niimiら8)が開発したE-Taqを用いて,測定感度試験およびコンタミネーション試験を実施した。E-Taqはbacterial DNA contamination freeを初めて実現したPCR酵素であり,臨床材料から直接的に高感度なバクテリアDNAの検出が可能となったが,通常,16S解析法はオーバーナイトで解析を行うため報告は翌日となった。今回,E-Taqの使用により50 cycle増幅した場合でも,対照のN-Free Waterは陰性を呈することを確認した。細菌の検出感度についてはPCR-LF法とほぼ同等の1 × 102 CFU/mL(50%検出)を示し,3種類の市販試薬と比較して,約100倍向上した。
今回のPCR-LF法及び16S解析法による結果では,MSSA 5検体(5.1%),MRSA 9検体(9.2%),MR-CNS 10検体(10.2%)及びStreptococcus agalactiaeが5検体(5.1%)と上位を占めていた。なお,手術部位感染の起因微生物調査ではMSSAに次いで,CNS,Enterococcus Species,E. coliなどが多いことが報告されている14)~18)。検出動向に関して,日本整形外科学会学術プロジェクト研究「人工関節置換術および脊椎instrumentation術後感染症例の実態調査」では,MRSAやMR-CNSによるSSIが人工関節置換術で4割以上(46%)を示した19)。本検討においてもMSSA,MRSAおよびMR-CNSが約3割検出され,人工関節感染症に占める頻度がほぼ一致した。組織材料で確認が可能であった91例中24例から細菌遺伝子が検出され,組織材料で確認が可能であった関節液のMSSAの5例中2例及びMR-CNSの10例中1例は組織材料での細菌遺伝子が陰性であった。また関節液が陰性で組織材料が陽性であったMR-CNSの2例及びMRSAの1例が検出され,これらは汚染菌が示唆された。なお,PJIに関するInfectious Diseases Society of America(IDSA)ガイドライン20)では,複数検体の培養検査からP. acnes,CNSなどの常在菌が1菌種のみ検出された場合はPJIとは断定せず,他の検査所見も考慮して判断することされている21)~23)。分離培養法が陰性を示した皮膚常在菌に関しては,PCR法は死菌の遺伝子も検出するため検体採取時のコンタミネーションによる偽陽性の可能性があり,術中迅速病理所見,炎症反応などからPJIとの関連性は低いことが考えられた。しかし,今回のBHA症例では,16S解析法を実施した結果,S. epidermidisが推定されPCR-LF法でもmecA遺伝子が確認された。同時に依頼された術中迅速病理所見として関節内に好中球主体の炎症性浸出液を認め,細菌培養検査では7日間陰性を示したが,病態が感染症であることを考慮し,Cefazolinによる治療により,創部の浸出液は減少し炎症反応は改善した。S. epidermidisはコンタミネーションとの鑑別が難しい菌種であるが,迅速病理診断および遺伝子検査法により原因菌と判断できたことは,治療薬を選択する上で非常に重要であると考えられた。
以上より,術中検体を用いた細菌遺伝子検査は組織と関節液を組み合わせることにより,PJIの感染診断および適正治療に非常に有用であると考えられた。なお,高感度な遺伝子検査を用いてPJIの有無を判定する場合は,関節液および人工関節周辺組織の採取時に生じる皮膚汚染菌などのコンタミネーションによる偽陽性の注意が必要である。
PCR-LF法はMSSA,MRSA,MR-CNSの3菌種,それ以外の細菌はE-Taqを用いた16S解析法の細菌遺伝子検査の有用性が確認された。PCR-LF法は約3時間で結果報告が可能であり,PJIにおける培養同定検査結果が確認できない時期の早期診断に有用である。今後は,皮膚汚染菌の判定及び16S解析法の迅速性に向けた改善が必要である。
なお,本研究は北里大学医学部・病院倫理委員会の承認を得て,患者情報保護法に準じた(B13-64)。
本研究の遺伝子検査法に関して,ご助言,ご指導賜りました富山大学大学院医学薬学研究部(医学)臨床分子病態検査学講座 仁井見英樹先生,北島勲先生及び北里大塚バイオメディカルアッセイ研究所に深謝いたします。
本論文に関連し,開示すべきCOI 状態にある企業等はありません。