2018 Volume 67 Issue 5 Pages 716-721
2018 Volume 67 Issue 5 Pages 716-721
結核をはじめとした抗酸菌検査は遠心集菌法が推奨されている。しかし,遠心集菌法は高額なバイオハザード対策用冷却遠心機が必須で,施設によっては導入が困難である。磁性ビーズによる抗酸菌集菌法であるTB-Beads法は,バイオハザード対策用冷却遠心機を必要としない集菌法であり,これを評価する目的で基礎的検討を行った。当院にて抗酸菌検査依頼のあった喀痰50検体を対象とし,TB-Beads法と遠心集菌法による各抗酸菌集菌法処理後の塗沫検査,培養検査,遺伝子検査の結果を比較評価した。一致率は塗沫検査92.0%,培養検査100%,遺伝子検査98.0%であった。塗沫検査ではTB-Beads法が遠心集菌法よりも感度が低かったが,培養検査と遺伝子検査では良好な一致率であった。TB-Beads法はバイオハザード対策用遠心機を用いることなく抗酸菌集菌法が行えることで,より多くの施設で抗酸菌検査の精度向上が可能となる。
結核は過去の高蔓延時に比して罹患率は減少しているが,2015年(平成27年)時点で14.4対10万人,年間およそ19,000人の患者が発症し,約2,000人が死亡している1)。また,2014年に行われた疫学調査では非結核性抗酸菌症(non-tuberculous mycobacteria; NTM)の罹患率は14.7対10万人と2007年と比して2.6倍に増加している2)。NTMはヒトからヒトへの感染は報告されていないが,進行が緩やかであるにも関わらず抗菌薬の治療が難しい点など3),公衆衛生上,重要な感染症となっている。
「抗酸菌検査ガイド2016」4)では抗酸菌塗沫検査の精度を高めるため,均等化遠心集菌検体を用いて標本を作製する方法が推奨されている。また,その均等化遠心集菌検体を用いて培養検査,遺伝子検査も行うことが可能である。主な検体である喀痰からの抗酸菌の分離において,検体を溶解・均等化し,前処理液を効率よく作用させ,遠心集菌することは塗沫検査の感度向上,培養検査時の接種培地への雑菌汚染の低減を図るため重要である。この過程で遠心操作が必須であり,この際に用いる遠心機はバイオハザード対策用冷却遠心機でなければならない。小規模な施設や抗酸菌検査の依頼検体数が少ない施設では高額なバイオハザード対策用冷却遠心機の導入は困難であり,遠心集菌法を実施できていないのが現状である。
今回,我々はバイオハザード対策用冷却遠心機を必要としない磁性ビーズによる抗酸菌集菌法である「TB-Beads」(日本ビーシージー製造株式会社;以下BCG)を用いるTB-Beads法と従来から推奨されている遠心集菌法による基礎的検討を行ったので報告する。
2016年1月~8月に当院にて結核および非結核性抗酸菌症が疑われ,抗酸菌検査依頼のあった喀痰50検体を対象とした。
なお,本検討に際し,倫理委員会の承認は得ていないが,検体の検査終了後の利用について,病院として包括的同意を得ている。
2) 検討方法検討対象は抗酸菌集菌用試薬 TB-Beads(BCG)法,比較対照はバイオハザード対策用冷却遠心機を用いた遠心集菌法とした。
2. 試薬および機器検体前処理液は,抗酸菌検出用前処理液 CC-E“ニチビー”(BCG)を用いた。塗沫検査はチール・ネルゼン(Ziehl-Neelsen; ZN)染色,培養検査は全自動抗酸菌培養検査装置BDバクテックTMMGITTM960にて培養・判定を行うMGIT分離培養剤:以下MGIT(日本BD),固形培地は「セロテック」2%小川培地(以下,小川培地(セロテック)),遺伝子検査はコバスTaqMan48®(以下,TaqMan48(Roche))にてコバスTaqMan MTB®(以下,TaqMan MTB),コバスTaqMan MAI®(以下,TaqMan MAI)を用いて各々添付文書に従い実施した。
3. 方法 1) 抗酸菌集菌法 ① TB-Beads法操作手順をFigure 1に示す。平底容器に喀痰をサンプリングし,等量~3倍量のCC-E液(2%水酸化ナトリウム,喀痰膨潤剤)を加え,CC-E液1 mLに対しCC-E助剤(長期安定型NALC)を1滴加えた。容器を密閉し撹拌後,転倒混和し,室温で15分静置した( ①)。容器に混合液と等量のTB-Beads溶液を加え撹拌し2分間静置後(②),容器を磁石ラックにセットし,上清中に磁性ビーズが残らなくなるまで約1分間静置した(③)。容器を磁石ラックの磁石につけたまま上清をデカントにて廃棄し(④),容器を磁石ラックから外した。TB-Beads溶液と等量の洗浄液を加え,転倒混和し,容器内壁,キャップ内側に付着している磁性ビーズを洗い落とした(⑤)。再び容器を磁石ラックにセットし,上清中の磁性ビーズが残らなくなるまで静置し(5分以内),容器を磁石につけたまま上清をデカントにて廃棄した(⑥)。上清を廃棄後,速やかに容器を磁石ラックから外し,溶出緩衝液を100 μL加え,容器を密閉後混和し,5分間静置した(⑦)。容器を再度磁石ラックにセットし,上清中に磁性ビーズが残らなくなるまで静置後,容器に磁石をつけたまま上清50 μLをスライドグラスに塗沫し,標本を作製した。残りの上清に適量(250~500 μL)の滅菌精製水を加え,容器を磁石ラックから外し,撹拌後,再度容器を磁石ラックにセットし,上清中に磁性ビーズが残らなくなるまで静置した。この上清を培養検査,遺伝子検査に用いた(⑧)。
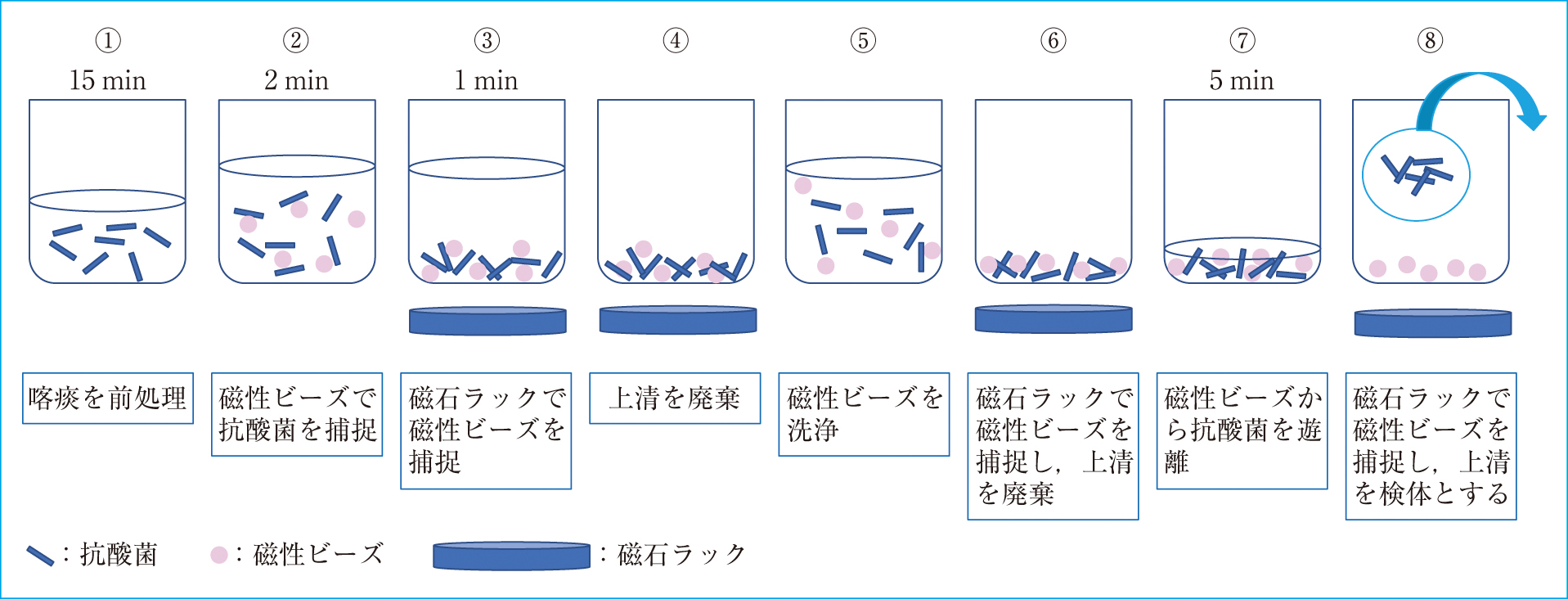
TB-Beads法における操作手順
Tb-Beadsの添付文書より改変した操作手順を図式化したもの
操作手順をFigure 2に示す。50 mL遠沈管に喀痰をサンプリングし,等量~3倍量のCC-E液を加え,CC-E液1 mLに対しCC-E助剤を1滴加えた。容器を密封し,ボルテックスで粘稠性がなくなるまで撹拌,転倒混和し,室温で9分静置し,その間5分ごとに軽く振った(①)。室温での静置は「抗酸菌検査ガイド2016」では15分とあるが,当院では前処理の手技が適切であったかを確認するための培養検査での雑菌汚染率の記録(固形培地:2~5%,液体培地:5~10%が許容範囲)に基づき,室温での静置時間を9分間とした。その後,スピンダウンし,内壁の混合液を落とし,混合液が5倍以上希釈されるように,冷却滅菌リン酸緩衝液pH 6.8(phosphate buffered saline; PBS)を加えた(②)。バイオハザード対策用冷却遠心機で3,000 g 20分間遠心した。上清をデカントにて廃棄し,沈渣50 μLをスライドグラスに塗沫し,標本を作製した(③)。残りの沈渣に1 mLのPBSを加え,これを培養検査,遺伝子検査に用いた(④)。

遠心集菌法における操作手順
遠心集菌法の操作手順を図式化したもの
スライドグラスは剥離防止処理したもの(MASコートスライドグラス)を使用した。それぞれの方法で集菌された処理検体を50 μL採取し,スライドグラス上に1 × 2 cmの大きさになるように塗沫した。自然乾燥後火炎固定し,Ziehl-Neelsen染色(チール・カルボールフクシン液;武藤化学)を実施した。
3) 培養検査(培養陽性率,雑菌汚染率,陽性までの日数)TB-Beads法および遠心集菌法で集菌した処理検体を液体培養(MGIT)では0.5 mL,固形培養(小川培地)では0.1 mLを接種後37℃で培養を実施し,各々発育状況を確認した。なお,固形培養は塗沫検査で抗酸菌が認められた検体,または塗沫検査で抗酸菌が陰性と判定された検体であっても同一患者検体で抗酸菌検出歴のある15検体について検査を実施した。
4) 遺伝子検査TaqMan48にてTaqMan MTB,TaqMan MAIを用いて結核菌群,M. avium,M. intracellulareの検出を行った。
光学顕微鏡にて×1,000(油浸レンズ100×)で鏡検した。菌量の記載は「抗酸菌検査ガイド2016」の鏡検における検出菌数記載法に従った。全体の一致率はTable 1に示すとおり92.0%(46/50),κ値は0.472で中等度の一致であった。遠心集菌法で±となった2検体で,TB-Beads法では陰性となった。また4検体で遠心集菌法よりもTB-Beads法の菌量が少なく判定された。
| TB-Beads法 | ||||||
|---|---|---|---|---|---|---|
| − | ± | 1+ | 2+ | 3+ | ||
| 遠心 集菌法 |
− | 45 | 0 | 0 | 0 | 0 |
| ± | 2 | 1 | 0 | 0 | 0 | |
| 1+ | 0 | 0 | 0 | 0 | 0 | |
| 2+ | 0 | 1 | 1 | 0 | 0 | |
| 3+ | 0 | 0 | 0 | 0 | 0 | |
一致率 = 92.0%(46/50)
κ値 = 0.472(中等度の一致)
液体培養および固形培養の一致率はどちらも100%であった(Table 2, 3)。両方法において,雑菌汚染はみられなかった。また,培養陽性までの両方法における日数も大きな差はなかった(Table 4)。
| TB-Beads法 | ||||
|---|---|---|---|---|
| − | + | 雑菌 | ||
| 遠心集菌法 | − | 45 | 0 | 0 |
| + | 0 | 5 | 0 | |
| 雑菌 | 0 | 0 | 0 | |
一致率 = 100%(50/50)
κ値 = 1(高い一致)
| TB-Beads法 | ||||
|---|---|---|---|---|
| − | + | 雑菌 | ||
| 遠心集菌法 | − | 10 | 0 | 0 |
| + | 0 | 5 | 0 | |
| 雑菌 | 0 | 0 | 0 | |
一致率 = 100%(15/15)
κ値 = 1(高い一致)
| TB-Beads法 | 遠心集菌法 | |||
|---|---|---|---|---|
| MGIT | 小川培地 | MGIT | 小川培地 | |
| No. 1 | 16日 | (−) | 16日 | (−) |
| No. 2 | 22日 | 30日 | 15日 | 30日 |
| No. 3 | 7日 | 30日 | 6日 | 30日 |
| No. 4 | 11日 | 42日 | 9日 | 42日 |
| No. 5 | 14日 | 56日 | 14日 | 56日 |
| No. 6 | (−) | 50日 | (−) | 46日 |
一致率は98.0%であった。またκ値は0.892で高い一致であった(Table 5)。遠心集菌法でのみ結核菌群を検出できた検体が1検体存在した。
| TB-Beads法 | |||||
|---|---|---|---|---|---|
| − | 結核菌群 | M. avium | M. intracellulare | ||
| 遠心集菌法 | − | 45 | 0 | 0 | 0 |
| 結核菌群 | 1 | 2 | 0 | 0 | |
| M. avium | 0 | 0 | 2 | 0 | |
| M. intracellulare | 0 | 0 | 0 | 0 | |
一致率 = 98.0%(49/50)
κ値 = 0.892(高い一致)
塗沫検査において,遠心集菌法で±と判定された2検体でTB-Beads法では陰性となった。また,2+と判定された2検体において,±および1+の判定であり,TB-Beads法では菌量が少なく観察される傾向を認めたが,培養検査において液体培養,固形培養の結果はすべて一致し,雑菌汚染も認めなかった。また,培養陽性となるまでの日数も大きな差は認めなかったことから,TB-Beads法で菌量が少なく観察されたもののその差は僅かであったと推察される。
遺伝子検査では遠心集菌法の検体で5検体が陽性となり,TB-Beads法では4検体が陽性となった。遠心集菌法で塗沫検査が±であった検体で遺伝子検査が陽性となった検体が1検体あり,この検体がTB-Beads法では塗沫検査陰性,遺伝子検査でも陰性となり,TB-Beads法の集菌率が若干低い結果となった。残りの4検体の結果は一致しており,TaqMan48におけるTB-Beads法による集菌における阻害反応などはなかったと推察される。
塗沫検査,培養検査,遺伝子検査における遠心集菌法とTB-Beads法の比較についていくつかの報告があるが,いずれもほぼ同程度の成績となっている5),6)。
抗酸菌はミコール酸という脂質を細胞壁に含むことにより疎水性を有するため,磁性ビーズにて抗酸菌を吸着させるより,物理的に遠心し,集菌する方法の方が感度が高くなった可能性が考えられる。また,TB-Beads法は処理中の撹拌時に処理液が泡立つことで,磁性ビーズが気泡に取り込まれ浮遊したような状態となり,磁性ラックによるビーズ捕捉の妨げになっている。このため,泡立たせないように操作しなければならないが,喀痰の抗酸菌集菌処理は粘稠性や雑菌除去するために確実な撹拌が必須である。撹拌時に泡立ちを最小限にするため,TB-Beads処理前にセミアルカリプロテアーゼ(Semi-alkaline protease; SAP)による喀痰の溶解(均等化)をすることで撹拌による余計な泡立ちを抑え,抗酸菌集菌感度の向上が考えられる。また,新製品では磁性ビーズのコーティング方法の最適化,溶出緩衝液中の界面活性剤の影響を除外するため,界面活性剤の変更とそれを不活化させるSR液が加わったことからも抗酸菌集菌感度の向上が期待できる。
本検討では旧製品のTB-Beadsを使用したことが塗沫検査,遺伝子検査の感度低下の問題の一因と考えられる。また,喀痰を各集菌法に分割する際,均等化することなく分割しているため,これが影響している可能性も考えられる。
TB-Beads法は高額なバイオハザード対策用遠心機を用いることなく抗酸菌集菌法が行えることにより,抗酸菌検査自体を外注化していた施設や直接塗沫検査のみを実施していた施設など,より多く施設で抗酸菌検査の実施が可能になる。遠心集菌法と比べて,一度に処理できる検体数が少なく,操作性がやや煩雑であるが,小規模な施設や抗酸菌検査の依頼件数が少ない施設には採用しやすいと考えられた。今後,より操作性が向上することが期待される。
本論文に関連し,開示すべきCOI 状態にある企業等はありません。