2018 Volume 67 Issue 5 Pages 694-700
2018 Volume 67 Issue 5 Pages 694-700
我々は,GOD固定化酵素膜と過酸化水素電極によるアンペロメトリー法を測定原理としたグルコース分析装置ADAMS Glucose GA-1172(アークレイ株式会社)の基礎的検討を行ったので報告する。常用参照標準物質JCCRM521を測定した結果,良好な正確性を確認した。また,併行精度は変動係数が0.67~2.15%,室内再現性は0.31~1.02%であり,良好な精密性を確認した。直線性は969.3 mg/dLまで良好な結果を確認した。全血検体と血漿検体ならびにGA-1172(電極法)とLABOSPECT006(酵素法)の相関性は良好な結果であった。今回の基礎的検討の結果は良好であった。全血検体でのグルコース測定では遠心分離作業が不要であり,検査業務の単純化ならびに結果報告時間の短縮に繋がることから,臨床に貢献できるものと思われる。
近年,糖尿病患者は増加傾向にあり,厚生労働省の平成26年(2014)患者調査の概況によると,糖尿病の総患者数(継続的な治療を受けている者)は,316万6,000人で,前回の調査よりも46万人以上増加した1)。本邦におけるグルコースの測定はhexokinase-glucose-6-phosphate-dehydrogenase(HK-G6PDH)法2),3)をはじめとする酵素法やglucose-oxidase(GOD)を用いた酵素電極法4),5)または過酸化水素電極法6)が主流であり,ヘモグロビンA1cと合わせて測定することは糖尿病の診断・治療において重要となる。今回われわれは,グルコース分析装置ADAMS Glucose GA-1170(アークレイ株式会社,以下GA-1170)からの機器更新に伴い,グルコースの全血測定が可能な分析装置ADAMS Glucose GA-1172(アークレイ株式会社,以下GA-1172)の基礎的検討を行ったので報告する。
測定装置はGA-1172を使用した。GA-1172はGOD固定化酵素膜と過酸化水素電極によるアンペロメトリー法を測定原理としている。GOD固定化酵素膜を通過したグルコースは,GODの働きにより,グルコン酸と過酸化水素に分解され,その過酸化水素はセルロースアセテート膜を通り電極に達する。電極に達した過酸化水素は外部電圧によって酸化還元反応を起こし,陽極と陰極の間に電流が流れる。全血測定モードではこの電流量(EP)と電流発生速度の最大傾斜(DI)をもとに,グルコース濃度を求める。EP値は血漿などの水溶性成分内のグルコース濃度に依存し,DI値は全血試料中の血球内グルコース濃度に依存するため,EP値とDI値の関係は試料のヘマトクリット(以下,Hct)値により影響を受ける。これより,Hct値が与えるEP値とDI値の関係を調査することで,EP値とDI値からHct値を推測することが可能となる。この原理を利用することでHctによる測定値への影響を補正でき,全血測定が可能となっている7)。
比較対象としてHK-G6PDH法を測定原理とする測定試薬アクアオート カイノス Glu(株式会社カイノス)を用い,測定機器LABOSPECT006(株式会社日立ハイテクノロジーズ)にて測定した。
当院の外来および入院患者で,当院検査部に血糖測定依頼のあった患者の残検体(全血または血漿検体)を匿名化して検討に用いた。なお,採血管はフッ化ナトリウム,ヘパリンナトリウムおよびEDTA-2ナトリウムが添加されたベノジェクトII真空採血管(テルモ株式会社;以下,血糖測定用採血管)を使用した。また,検討で使用した全血プール検体は血液型が同型であることを確認し,作成した。なお,本検討は鳥取大学医学部倫理審査委員会の承認を得て行った(承認番号:1605A019)。
2. 方法 1) 正確性グルコース常用参照標準物質JCCRM521(一般社団法人検査医学標準物質機構)のM,H,HHの3種類の試料をノーマル測定モードでそれぞれ3回連続測定した。得られた平均値を認証値と比較した。
2) 併行精度3濃度の全血プール検体を試料とし,全血測定モードでそれぞれ20回連続測定した。得られた平均値,標準偏差(SD)から変動係数(CV)を算出した。
3) 室内再現性内部標準液であるグルコース用内部標準液STD-Hi(アークレイ株式会社)ならびに精度管理試料であるQAPトロール1X・2X(Sysmex株式会社)をノーマル測定モードでそれぞれ5日間(1日3回)測定した。得られた平均値,SDからCVを算出した。
4) 直線性フッ化ナトリウム未添加の全血検体を一晩放置し,全血プール検体(実測値0 mg/dL)としたものにD-(+)-グルコース(ナカライテスク株式会社)を添加して血糖値が約250 mg/dL,1,000 mg/dLとなるよう調整した高濃度の全血プール検体を作製した。高濃度の全血プール検体それぞれを,全血プール検体にて10段階に希釈したものを試料とし,各段階の試料を測定レンジを1,000 mg/dLまで広げた全血測定モードでそれぞれ3回連続測定した。それぞれ理論値との差を算出し相対的な割合を求め評価した。
5) 干渉物質の影響2濃度の全血プール検体ならびに血漿プール検体に,干渉チェックAプラス(Sysmex株式会社)の試験項目(4項目)であるビリルビンF,ビリルビンC,ヘモグロビン,乳ビおよびL-アスコルビン酸(ナカライテスク株式会社)を添加後,5~6段階に希釈したものを試料とし,各段階の試料を全血測定モード,ノーマル測定モードでそれぞれ3回連続測定した。未添加試料の測定値に対してそれぞれ差を算出し相対的な割合を求め評価した。
6) ヘマトクリット(Hct)値の影響2濃度の患者検体を用いて血球と血漿の量を人為的に変え,Hct値を約20~60%の5段階に調整したものを試料とし,各段階の試料を全血測定モードでそれぞれ3回連続測定した。Hct値0%(血漿検体)の測定値に対してそれぞれ差を算出し相対的な割合を求め評価した。なお,Hctの測定には多項目自動血球分析装置XN-3000(Sysmex株式会社)を使用した。
7) 他測定法によるグルコース値との相関患者の全血検体50件について,GA-1170とGA-1172の相関性を確認した。また,別の患者の全血検体50件についてGA-1172全血測定モードで測定後,速やかに2,000 gで5分間遠心分離した。その上清を血漿検体としてGA-1172ノーマル測定モードで測定し相関性を確認した。さらに,別の患者の全血検体50件について,GA-1172全血測定モードで測定後,同様に上清分離し,血漿検体としてHK-G6PDH法を測定原理とするアクアオートカイノスGluを用いたLABOSPECT006にて測定し相関性を確認した。
JCCRM521のM,H,HHのそれぞれの認証値100.1 ± 1.0 mg/dL,150.2 ± 1.6 mg/dL,248.9 ± 2.6 mg/dLに対し,それぞれの平均値は99.0 mg/dL,149.3 mg/dL,249.3 mg/dLであった(Table 1)。
| JCCRM 521 | |||
|---|---|---|---|
| M | H | HH | |
| Certified value | 100.1 | 150.2 | 248.9 |
| Expanded uncertainty | 1.0 | 1.6 | 2.6 |
| Glu BA (%) | 2.3 | ||
| 1 | 99 | 150 | 249 |
| 2 | 99 | 149 | 249 |
| 3 | 99 | 149 | 250 |
| Mean | 99.0 | 149.3 | 249.3 |
BA: analytical bias
Unit: mg/dL
3濃度の試料をそれぞれ20回連続測定した結果,CVは0.67~2.15%とすべて3%以下であった(Table 2)。
| Sample 1 | Sample 2 | Sample 3 | |
|---|---|---|---|
| N | 20 | 20 | 20 |
| Mean | 64.7 | 147.0 | 306.0 |
| Min | 62 | 145 | 302 |
| Max | 67 | 150 | 310 |
| Range | 5 | 5 | 8 |
| SD | 1.39 | 1.56 | 2.04 |
| CV (%) | 2.15 | 1.06 | 0.67 |
Unit: mg/dL
3濃度の試料をそれぞれ5日間(1日3回)測定した結果,CVは0.31~1.02%とすべて2%以下であった(Table 3)。
| STD | QAP 1X | QAP 2X | |
|---|---|---|---|
| N | 15 (3 × 5 day) | 15 (3 × 5 day) | 15 (3 × 5 day) |
| Mean | 149.9 | 86.7 | 222.1 |
| Min | 149 | 85 | 220 |
| Max | 151 | 88 | 224 |
| Range | 2 | 3 | 4 |
| SD | 0.46 | 0.88 | 1.19 |
| CV (%) | 0.31 | 1.02 | 0.54 |
Unit: mg/dL
2濃度の試料を測定した結果,969.3 mg/dLまで理論値に対して±5%以内の変動であった(Figure 1)。

Dilution linearity test
2濃度の全血プール試料を測定した結果,ビリルビンF 20.0 mg/dL,ビリルビンC 20.0 mg/dL,乳び3,000 FTU,アスコルビン酸300 mg/dLまで未添加試料の測定値に対して±3%以内の変動であった(Figure 2)。
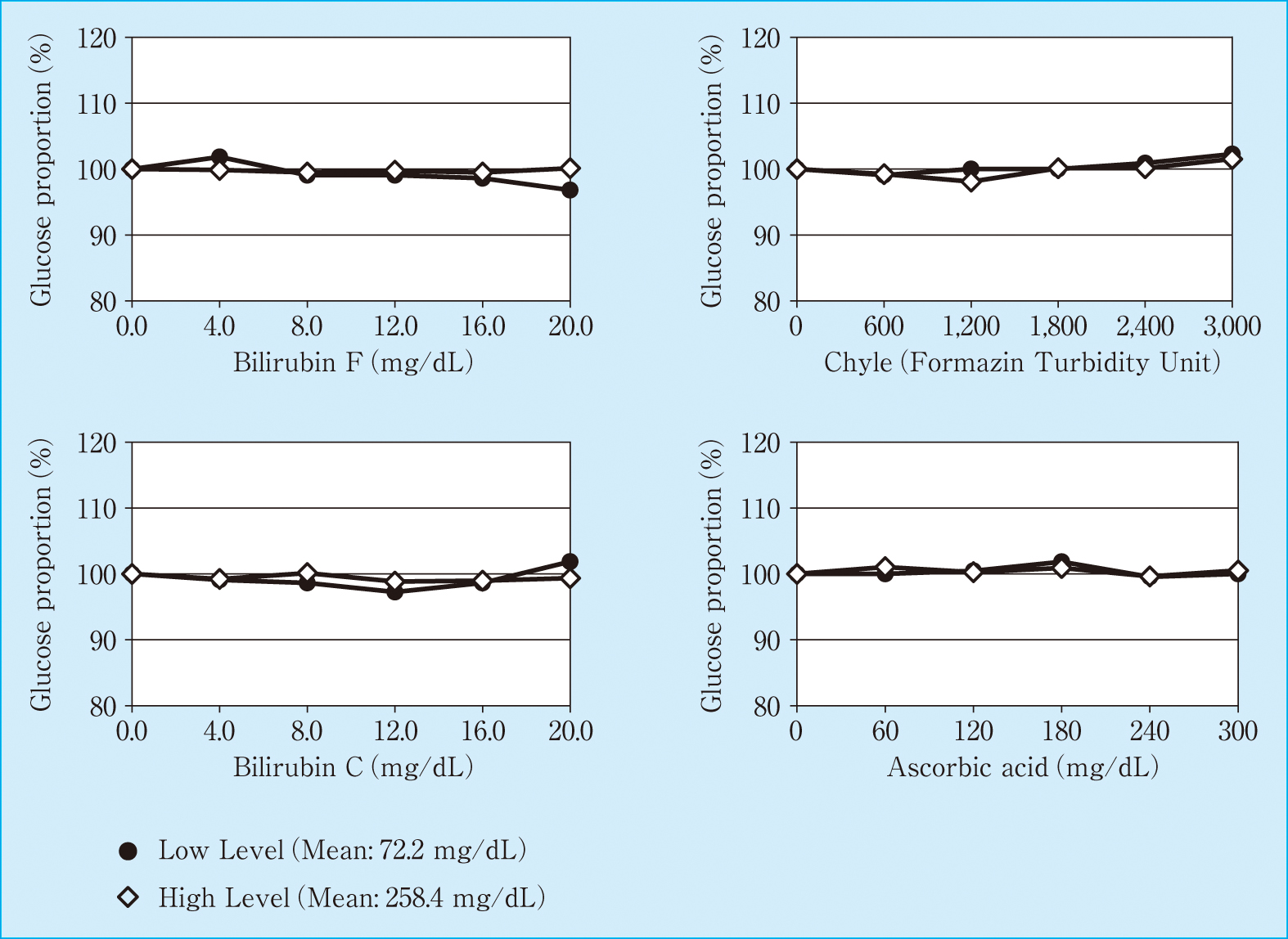
Effect of interfering substances on whole blood
同様に,2濃度の血漿プール試料を測定した結果,ビリルビンF 20.0 mg/dL,ビリルビンC 20.0 mg/dL,ヘモグロビン500 mg/dL,乳び2,000 FTU,アスコルビン酸200 mg/dLまで未添加試料の測定値に対して±3%以内の変動であった(Figure 3)。

Effect of interfering substances on plasma
2濃度の試料を測定した結果,Hct値64.0%までHct値0%(血漿検体)の測定値に対して±7%以内の変動であった(Figure 4)。

Effect of hematocrit
患者の全血検体50件について,GA-1172(y)とGA-1170(x)での測定値を比較した結果,相関係数r = 0.99,回帰式y = 1.01x − 3.22であった。また,別の患者の全血検体50件についてGA-1172全血測定モード(y)とノーマル測定モード(x)での測定値を比較した結果,相関係数r = 0.99,回帰式y = 1.02x − 1.59であった。さらに,別の患者の全血検体50件についてGA-1172全血測定モード(y)とLABOSPECT006のHK-G6PDH法(x)での測定値を比較した結果,相関係数r = 0.99,回帰式y = 0.97x − 0.95であった(Figure 5)。

(A) Correlation between glucose concentrations (mg/dL) measured by GA-1172 and GA-1170. (B) Correlation between glucose concentrations (mg/dL) in whole blood and plasma measured by GA-1172. (C) Correlation between glucose concentrations (mg/dL) measured by GA-1172 and LAbOSPECT006.
今回われわれは全血検体を用いてGA-1172の基礎的検討を行った。正確性確認では,認証値に対して高い一致率であった。後述の相関性が良好であったことから,全血検体においても正確性は同等と考えられる。全血測定モードで行った併行精度ならびにノーマル測定モードで行った室内再現性では全血測定モードのCVがノーマル測定モードのCVに比べて若干ではあるが大きな値を示した。全血測定モードではヘマトクリット補正が行われるため,結果に影響したものと推測されるが,それぞれCV 3%以下であった。それぞれについてわが国における許容誤差限界8)を用いて評価した結果,良好な結果が確認でき,日常検査に用いるには十分な精密性を有していると思われる。
直線性では,GA-1172の全血測定モードでは初期設定で0~500 mg/dLとなっているが,測定レンジを1,000 mg/dLまで広げ検討した結果,969.3 mg/dLまでは理論値に対し5%以内の変動であり,良好な結果が確認された。
干渉物質の影響では,未添加試料の測定値に対して±5%以上乖離する場合を影響ありとして検討した結果,全血検体を用いた全血測定モードではビリルビンF 20.0 mg/dL,ビリルビンC 20.0 mg/dL,乳び3,000 FTU,アスコルビン酸300 mg/dLまで測定値への影響は認められなかった。しかし,全血検体の場合はサンプリングされる干渉物質は血球の容積を補正すると約1/2となるため,血漿検体を用いてノーマル測定モードについても検討した結果,ビリルビンF 20.0 mg/dL,ビリルビンC 20.0 mg/dL,ヘモグロビン500 mg/dL,乳び2,000 FTU,アスコルビン酸200 mg/dLまで測定値への影響は認められなかった。
Hctの影響では,Hct値64.0%の全血検体の測定値において,Hct値0%(血漿検体)の測定値に対して最大7%の低下を認めた。GA-1172の仕様はHct値60%以下の検体に対し±8%以内の変動との記載があり,仕様上は精度を満たしていた。前述したようにGA-1172はHct補正機能を有しているものの,Hct値が高値になるに従い,測定値が低値傾向を示した。これは前機種GA-1170でも同様の報告がされている7)。全血測定モードは微量測定が可能であり,新生児検体などで有用性が高い。しかし,新生児検体ではHctが60%以上であることも多く,更なる改良が望まれる。また,血液検査で高Hct検体が確認された場合は,情報を共有し,再測定するなど,検査部内での体制や対応を検討する必要がある。
相関性については,GA-1172とGA-1170の測定値の相関係数はr = 0.99,回帰式はy = 1.01x − 3.22であり良好な相関性が確認できた。GA-1172による全血グルコース値と血漿グルコース値の相関係数はr = 0.99,回帰式はy = 1.02x − 1.59であり良好な相関性が確認でき,検査材料による測定値の乖離は認められなかった。GA-1172の電極法による全血グルコース値とLABOSPECT006の酵素法による血漿グルコース値では相関係数r = 0.99,回帰式y = 0.97x − 0.95であり,こちらも良好な結果が確認され,測定原理による測定値の乖離は認められなかった。
メンテナンスに関してはGA-1170を使用時と同様に,週1回の流路洗浄ならびに測定件数に応じてGODカートリッジなどの消耗品を適宜交換する簡単な作業のみで,現在のところ問題なく稼動している。
今回,全血検体を対象とした,ADAMS Glucose GA-1172によるグルコース測定の基礎的検討を行った。全血測定モードにおける基礎的検討の結果は良好であり,日常検査に用いるには十分な性能を有していることを確認した。全血検体でグルコースの測定を行うことで,遠心分離作業が不要となり,検査業務の単純化ならびに迅速化に繋がる。また,ヘモグロビンA1c測定装置と合わせて連続測定が可能となり,両項目の結果報告時間の短縮に繋がることで,より臨床に貢献できるものと思われる。
本論文に関連し,開示すべきCOI 状態にある企業等はありません。