2018 Volume 67 Issue 5 Pages 809-816
2018 Volume 67 Issue 5 Pages 809-816
乳腺の扁平上皮癌はまれで,急速に増大する特徴から予後不良とされる。今回われわれは,乳腺扁平上皮癌の1例を経験したので細胞学的特徴を中心に報告する。症例は60歳代女性で,検診で右乳房腫瘤を指摘され当院を受診した。腫瘤はDynamic MRIで遅延相におけるリング状増強効果を示した。穿刺吸引細胞診では,多数の壊死物質とリンパ球,少数の線維芽細胞を背景に,重積性の腫瘍細胞集塊や,孤立散在性の角化した腫瘍細胞を認めた。広めの細胞質を有する大小の細胞からなる集塊では,辺縁から突き出す約70 μmの大型細胞を認めた。大型細胞は濃いライトグリーンやオレンジ色の厚い細胞質を有し,中心に48 μmの巨大核を認めた。単調な楕円形核を有する細胞が結合性のよい流れるような配列を示す集塊では,p40免疫細胞染色において陽性の細胞が集塊の片側に偏るように染色された。小型の集塊では,すべての細胞がp40陽性を示す集塊と,p40陽性細胞と陰性細胞が混在する集塊とがみられた。病理組織学的には高分化な扁平上皮癌で,一部に腺癌から扁平上皮癌へと連続する移行部を認めた。ER,PgR,HER2は陰性,Ki-67陽性率は55%であった。今回,経験した乳腺扁平上皮癌は細胞診において,強い異型を示す角化細胞と移行部を反映した特徴的な細胞集塊がみられた。本報告例は予後良好であり,腫瘍の小さい早期に行われた細胞診検査は組織型推定に有用と考えられた。
乳腺扁平上皮癌は,1936年Pasternack & Wirth1)が腺癌,扁平上皮癌および肉腫様腫瘍組織を含む混成乳癌として報告し,現在WHO分類2)では化生癌に分類される。その発生頻度は全乳癌の0.1%とまれで,腺癌の扁平上皮化生により発生すると考えられている。われわれは,一部に充実腺管癌成分を伴う乳腺扁平上皮癌を経験し,細胞学的特徴を中心に文献的考察を加え報告する。
患者:60歳代女性。
既往歴:10年前に高脂血症,8年前に糖尿病。
現病歴:2週間前に乳房検診で右乳房腫瘤を指摘され,他院細胞診で疑陽性となり当院を受診した。マンモグラフィでは,右C領域に比較的境界明瞭な腫瘤を認めたが,壊死型石灰化は指摘できなかった。超音波検査では,右CD領域に12 × 8 × 11 mmの多角形の低エコー腫瘤を認めた。エラストグラフィで腫瘤は弾性の低下がみられ,カラードップラー法で腫瘤辺縁や内部に入り込む血流を認めた。MRIでは,右C領域にT2強調画像および拡散強調画像で高信号を示す18 × 15 mmの不整形腫瘤を認めた。Dynamic法で腫瘤内部は一部wash outパターンを示したが,辺縁は後期相でも造影効果が蔓延したため腫瘤はリング状を呈し,乳癌が疑われた(Figure 1)。大胸筋への浸潤や両腋窩リンパ節の腫大は認められなかった。腫瘤は当院細胞診で悪性と診断され,cT1cN0M0 stage Ⅰで円状部分切除術を行った。術中迅速センチネルリンパ節生検は陰性で腋窩郭清は省略した。術後化学療法と放射線療法を施行した。術後約5年の現在,局所の再発や転移は認められていない。

Dynamic magnetic resonance imaging (MRI) features on delay phase
MRI of the breast demonstrated 18 × 15 mm hyperintence mass in the right CD area. On dynamic MRI, the intratumoral contrast material had been washed out and delayed rim enhancement had appeared at the peritumoral portion, so called ring-like “rim-like” enhancement.
一方,左乳房にはマンモグラフィで小円形腫瘤を認め,超音波検査では左BD領域に6 × 4.6 mmの血流のない円形腫瘤が認められた。MRIでは6 mmの境界明瞭な円形結節として認められ,出血性嚢胞や濃縮嚢胞を疑った。
細胞はエコーガイド下吸引法にて採取し,吹き付け法で標本を作成した。パパニコロウ染色(Papanicolaou;Pap染色)標本では,壊死や多数のリンパ球を背景に,大型の重積性細胞集塊と孤立散在性の角化細胞を認めた。異型に乏しい線維芽細胞様の紡錘形細胞の集塊も観察された。不規則重積性の大型集塊は広めの細胞質を有する大小の細胞からなり,細胞相互封入像も観察された。核の大きさは5 μm~24 μmでばらつきがみられた。集塊内部や辺縁から突き出すように,濃いライトグリーンやオレンジ色を呈する50 μm~70 μmの大型細胞を認めた。核は中心性に位置し30 μm~48 μmと巨大で,2核もみられた(Figure 2)。クロマチン構造は粗顆粒状で,核小体は小型不明瞭であった。充実性の大型集塊は約14 μmのN/C比の高い細胞からなり,集塊辺縁ではライトグリーンに好染する細胞質と楕円形核を有する細胞が結合性のよい流れるような配列を示した(Figure 3)。核は長径約12 μm,短径約9 μmで,クロマチン構造は粗顆粒状を呈した。小型集塊を構成する細胞の核は類円形で,大きさは5 μm~16 μmとばらつきがみられた。腺腔様の空隙を有する集塊が1か所みられた。孤立散在性の細胞は,輝度の高いオレンジやライトグリーンの厚い細胞質を有し,核は大型で,集塊を構成する細胞より変性濃縮状核や多核が目立った。100 μmのオタマジャクシ状細胞もみられた。メイ・グリュンワルド・ギムザ二重染色(May-Grünwald Giemsa;MG染色)では細胞質がtranslucent robin’s egg blue色を示した(Figure 4)。一般的な角化型扁平上皮癌の特徴的所見を多く有したため,扁平上皮癌もしくは扁平上皮への分化を示す乳管癌と診断した。
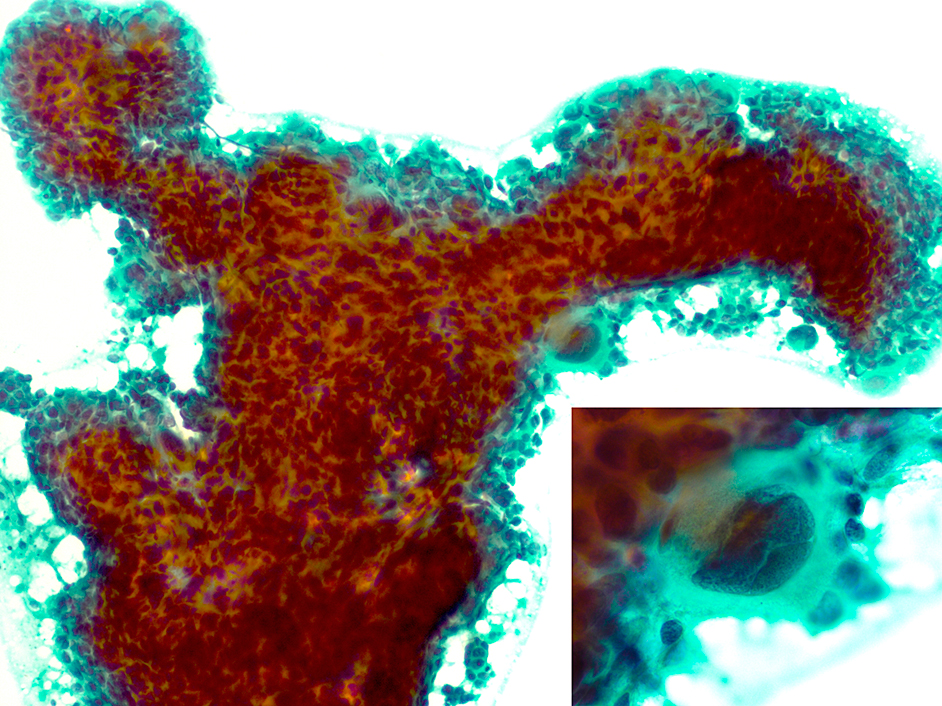
Cytological findings (Pap. staining, 10×, inset: Pap. staining, 40×)
Giant/bizarre nuclei were often present. A large cell (70-μm-diameter) with a giant nucleus and a thick cytoplasm was protruded from periphery of a large cluster consisting of tumor cells of various sizes.

a: Cytological findings (a-1: Pap. staining, 4×, a-2: Pap. staining, 40×), b: Histological findings (b-1: Hematoxylin-Eosin; HE staining, 40×, b-2: p40 immunostaining, 40×)
In large clusters consisting of streaming arrangements of uniform tumor cells, the positivity for p40 showed a biased distribution to one side. It is thought that such clusters were collected from the periphery of portions transitioning from AC to SqCC.

Cytological findings (Pap. staining, 40×, MG staining, 40×)
Some tumor cells appeared as isolated cells, which had giant/bizarre nuclei and dense cytoplasm with sharp borders. Occasionally tadpole-shaped Orange G-philic cells were observed. These cells showed translucent robin’s egg blue by MG staining.
なお,N/C比の高い細胞からなる集塊の由来を特定するためp40免疫細胞染色を施行した。小型集塊では,p40陽性細胞と陰性細胞が混在する集塊と,すべての細胞がp40陽性を示す集塊がみられた。腺腔様の構造を呈する細胞集塊の核や,細胞質の乏しい小型細胞の類円形核はp40陰性であった(Figure 5a)。重積性が強く,Pap染色で辺縁がライトグリーンに縁取られるような集塊は構成細胞がすべてp40陽性を示した(Figure 5b)。流れるような配列を示す集塊では,p40陽性の細胞と陰性の細胞がそれぞれ集塊の片側に偏って染色された。

Immunocytochemical findings (a-1: Pap. staining, 40×, a-2: p40 immunostaining, 40×, b-1: Pap. staining, 40×, b-2: p40 immunostaining, 40×)
a: Components transitioning from AC to SqCC were identified as small clusters, which consisted of the cells having round nuclei with mild anisokaryosis. The vestigial gland formation was rare. These clusters were composed of mixture with both p40-positive and p40-negative cells. p40-positive cells had more broader cytoplasm than p40-negative cells.
b: Small clusters of SqCC were characterized by their surroundings covered with light green cytoplasm. These nuclei ware enlarged, overlapped and positive for p40.
摘出標本の割面は腫瘤径が15 × 15mmで,固く,白色で,薄黄色の微小斑紋が数個みられた。褐色の小さな窪みを1個認めた(Figure 6)。組織学的に,腫瘍の80%は充実性胞巣を形成し周囲間質に圧排性に浸潤増殖する扁平上皮癌の像を呈した。エオシンに好染もしくは淡染する広い細胞質の角化細胞や細胞間橋を認め,一部には癌真珠もみられた(Figure 7)。また,腫瘍の20%程度に充実腺管癌が観察された。腫瘍細胞はNuclear atypia 3,Maitotic count 3,Nuclear Grade 3であった。免疫組織学的には,前述した両組織成分はER,PgR,HER2すべて陰性で,Ki-67陽性率は55%であった。p40免疫組織染色では,扁平上皮癌への分化を示す部分で核に強い陽性反応を認めた。腺癌部分はすべて陰性であった。腺癌から扁平上皮癌への移行部では,間質側にp40陽性細胞が多くみられ,腺癌胞巣内部にも極少数の陽性細胞を認めた(Figure 8)。

Macroscopic findings of the cut surface of the tumor
The resected tumor measured 15 mm in diameter. The tumor exhibited a white nodule with cream-colored and yellowish spots. Only one small grayish depression was observed.

Histological findings (HE staining, 20×)
Tumor cells with marked nuclear irregularity showed keratinization and prominent inter-cellular bridges.

Histological findings (HE staining, 4×, p40 immunostaining, 4×)
Transitional features from AC to SqCC were sporadically observed. In the periphery of the potions transitioning from AC to SqCC, the immunopositivity for p40 showed a biased distribution to interstitial side of the nest. p40 positive cells were also slightly observed in the AC component.
乳腺扁平上皮癌は,1936年Pasternack & Wirth1)が腺癌,扁平上皮癌および肉腫様腫瘍組織を含む混成乳癌として報告し,その起源は化生性である可能性が高いと指摘した。乳癌取扱い規約第17版3)では特殊型に分類され,「組織学的に扁平上皮化生を伴う癌で,癌胞巣が単に重層を示すだけでなく,角化あるいは細胞間橋のみられるもの」かつ「その組織形態が癌巣の大部分を占めるもの」と定義されている。Azzopardi et al.4)は,乳腺扁平上皮癌を1)adenocarcinoma with varying degree of squamous metaplasia,2)squamous cell carcinoma with extensive spindle cell metaplasia and/or marked desmoplasia,3)squamous cell carcinoma arising in cystosarcoma phyllodes,4)pure squamous cell carcinomaの4型に分類して症例を蓄積する必要があるとし,紡錘細胞化生を伴う扁平上皮癌と伴わない扁平上皮癌を区別した。乳腺扁平上皮癌は61%~74.3%と高頻度に嚢胞が認められ,腫瘍径は1 cm大のものから16 cm大と巨大なものまで報告があり5)~8),一般的に急速に増大する特徴から予後不良とされる7)。しかしEggersら9)は,乳腺扁平上皮癌の報告には広範囲な紡錘細胞化生を伴うものが含まれている可能性を指摘し,紡錘細胞化生は乳腺扁平上皮癌の一般的なパターンとはいえないとした上で,乳腺扁平上皮癌の予後は通常型乳癌と差はないとしている。Lesterら10)は,化生癌のうち形態学的に明らかな悪性所見を有する紡錘形細胞成分を含むもののみ予後不良と報告している。また,化生癌は分子生物学的にはbasal-like subtypeに含まれるが11),basal-like subtypeの乳癌は近年,1)basal-like immune-suppressed,2)basal-like immune-activated,3)mesenchymal,4)luminal androgen receptorの4亜型が提唱されている12)。
本報告例の扁平上皮癌は,一部に充実腺管癌を伴う扁平上皮癌で,腫瘍周囲間質におけるリンパ球浸潤と線維芽細胞の増生が目立った。細胞像もこれを反映し,多数のリンパ球とその破砕物,線維芽細胞が付着した扁平上皮癌細胞集塊がみられた。このような所見から本報告例は,Ahnら12)が提唱したbasal-like immune-activated subtypeに相当し,充実腺管癌から腫瘍免疫応答環境に対する細胞適応として化生性変化した扁平上皮癌とも考えられる。本報告例の腫瘍細胞はKi-67陽性率が高値であったが,診断時の腫瘤径は15 mmと小さく,センチネルリンパ節への転移はみられなかった。組織学的に壊死はみられたが壊死性の嚢胞化はみられず,紡錘細胞化生はあきらかでなかった。術後5年の現在再発や転移は認められていない。乳腺原発扁平上皮癌において壊死型の嚢胞や肉腫様紡錘細胞成分を伴わないものは予後が良い可能性があると考えられる。
乳腺扁平上皮癌は,乳頭腺管癌,充実腺管癌,硬癌,髄様癌,紡錘細胞癌,腺様嚢胞癌との共存が報告され,それらの腺癌成分と混在することが多いため腺癌が扁平上皮癌へ分化したものと考えられている13)~15)。本報告例も,組織学的に腫瘍の一部に充実腺管癌が観察され,扁平上皮癌と連続する移行部を認めた。p40免疫組織染色では,腺癌部は陰性,扁平上皮癌部は陽性を示した。移行部では腺癌部にもわずかにp40陽性細胞が混在したこと,胞巣中心部でp40陰性細胞が多く間質接面部にp40陽性細胞が多かったことより,本報告例は腺癌が増殖の過程で形質転換し扁平上皮細胞の表現型を獲得したものと考えられた。
本報告例との鑑別を要する疾患には,良性扁平上皮化生細胞,転移性扁平上皮癌,腺扁平上皮癌が挙がる。扁平上皮化生自体は炎症などの刺激に対する細胞適応であり,悪性腫瘍以外の正常乳管上皮,乳頭腫,乳腺症,線維腺腫,葉状腫瘍でも認められる現象である。細胞診で扁平上皮への分化を示す細胞がみられた場合は,壊死の有無,細胞質の輝度と形,核異型の有無を観察し,良性扁平上皮化生細胞と扁平上皮癌の鑑別が必要である。本報告例は多量の壊死を背景に,ライトグリーンに濃染した重厚感ある細胞質と強い核異型を有する円形細胞や,100 μmを超えるパンプキンオレンジ色のオタマジャクシ状細胞がみられたため,扁平上皮癌細胞と判定することは容易であった。
転移性扁平上皮癌との鑑別点として,腺癌から扁平上皮癌への移行像の有無が挙げられる。本報告例は組織学的に腺癌と扁平上皮癌との移行部を認め,細胞診でも移行部を反映した細胞集塊を認めた。その細胞集塊は,p40陽性細胞と陰性細胞が混在し,細胞および核の大小不同や管腔形成を伴う小型集塊,流れるような細胞配列を呈し,p40陽性細胞が集塊の片側に偏るように染まる大型集塊である。後者の細胞集塊は,扁平上皮癌への分化を示す蜂巣の辺縁部から充実性部への移行部より採取されたものと考えられた。これら特徴的な細胞集塊の出現は原発性扁平上皮癌を示唆する所見のひとつとなる。
低異型度腺扁平上皮癌(low-grade adenosquamous carcinoma; LGASC)は,化生癌の低悪性度亜型と考えられるため鑑別が必要である2),16)。LGASCは細胞診で,背景に間質由来の裸核細胞やリンパ球,時に石灰化小体がみられるが17),18),無核角化細胞や壊死物質は認められない。腺癌成分,扁平上皮癌成分ともに異型が弱い。腺癌成分は単調な細胞が小型腺管状で出現し,核腫大は軽度でクロマチン構造は微細顆粒状を呈する19)。本報告例は,粗顆粒状のクロマチン構造を有する細胞が大型重積性集塊で出現した。移行部の小型集塊では細胞や核の大小不同がみられた。特に角化扁平上皮癌細胞で巨大核などの強い異型を認める点はLGASCとの重要な鑑別点と考えられた。
本報告例は,腺癌から分化転換し発生した扁平上皮癌で,壊死型嚢胞や広範囲の紡錘細胞化生は伴わず,腫瘍は小さく予後良好であった。細胞診では異型の強い扁平上皮癌細胞と移行部を反映した腫瘍細胞集塊が出現し特徴的な像を呈した。乳腺扁平上皮癌において,腫瘍の小さい早期の細胞診はその組織型や予後の推定に有用と考えられる。
本症例は名古屋大学医学部附属病院の倫理委員会の承認(2015-0497-3)を得て報告した.
本論文に関連し,開示すべきCOI 状態にある企業等はありません。