2019 Volume 68 Issue 1 Pages 99-104
2019 Volume 68 Issue 1 Pages 99-104
【背景】オートタキシンはリゾホスファチジルコリンをリゾホスファチジン酸とコリンに分解するリゾホスホリパーゼD活性を持った酵素である。肝線維化の進展によって血中濃度が上昇するため,新たな肝線維化マーカーとなることが期待されている。今回我々はEテスト「TOSOH」II(オートタキシン)の基礎的性能評価と健常人のオートタキシンの濃度分布について検討を行った。【対象と方法】オートタキシンはAIA-2000(東ソー株式会社)で測定した。性能評価は再現性,直線性,定量限界,共存物質の影響,検体の保存安定性について行った。健常人の濃度分布については,肝機能が正常な健常人160名(男性80名,女性80名)を対象として,性別・年齢グループ別にオートタキシン濃度に差があるか検討した。【結果】同時再現性は変動係数(coefficient of variation; CV)1.74~2.52%,日差再現性はCV 3.55~4.09%であった。希釈直線性は8.51 mg/Lまで確認され,定量限界は0.03 mg/Lであった。共存物質の影響は認められなかった。保存条件は,室温で5日間,冷蔵で6日間,冷凍で30日間,凍結融解は5回まで,オートタキシンの測定値に影響がなかった。健常人のオートタキシン濃度の中央値は男性で0.70 mg/L,女性で0.82 mg/Lで有意な差を認めたが,年齢差は認められなかった。【まとめ】オートタキシン測定の基礎的性能は良好であった。オートタキシンは男性に比べて女性で高値となるので,男女別の基準値や臨床判断値の設定が必要である。
オートタキシンは,リゾホスファチジルコリンをリゾホスファチジン酸(lysophosphatidic acid; LPA)とコリンに分解するリゾホスホリパーゼD活性を持った125 kDaの糖蛋白である1),2)。LPAは,血管新生や平滑筋収縮,血小板凝集などにおいて多彩な生理作用を示す細胞間メディエーターであり,癌細胞の増殖や転移にも関与していることが明らかになっている3),4)。血中のLPAはその大部分がオートタキシンの作用によって産生されるため,血中LPA濃度とオートタキシン濃度は非常によく相関している5)。
慢性肝炎患者の血中でLPAおよびオートタキシン濃度が上昇していることが明らかになり,慢性肝炎から生じる病態である肝線維化とLPAおよびオートタキシンの関係性が研究されてきた。肝星細胞は,肝臓の線維化で増殖し線維成分を産生するが,LPAがこの肝星細胞の増殖を促進するため,LPAが肝線維化の進行に何らかの役割を果たしている可能性が示唆されている6)。また,一方で血中のオートタキシンは肝臓の類洞内皮細胞で取り込まれて代謝されることから7),肝線維化によってオートタキシンの取り込みが減少することが血中オートタキシンおよびLPA濃度上昇の原因と考えられている。
肝線維化は肝生検で評価されるが,侵襲性が高いため,非侵襲的な肝線維化マーカーの開発が長年求められてきた。すでに複数の肝線維化マーカーが開発され,臨床の場で利用されているが,肝生検にとって代わるようなマーカーは未だに存在しないのが現状である。LPAは血小板に多く含まれ,採血の手技によってその濃度が変動することや,血清を分離した後でも時間の経過とともに増加すること8)から臨床検査の項目としては不向きであることが明らかになったため,オートタキシンが新たな肝線維化マーカーとして開発されることになった。オートタキシンは従来の線維化マーカーが苦手としていた早期の線維化の判別9)や疾患特異性に優れており10),従来の線維化マーカーの欠点を補う新たなマーカーとして期待されている。
本研究では東ソー株式会社が開発した血清オートタキシン測定試薬であるEテスト「TOSOH」II(オートタキシン)の基礎的性能を評価するとともに,血清オートタキシン濃度の健常人での濃度分布を検討したので報告する。
測定機器は「全自動エンザイムイムノアッセイ装置AIA®-2000」(東ソー株式会社)を用い,試薬はEテスト「TOSOH」II(オートタキシン)(東ソー株式会社)を使用した。2種類のラット抗オートタキシンモノクローナル抗体を使用し,抗体に標識されたアルカリフォスファターゼによって生じる蛍光を測定する,1ステップ蛍光酵素免疫測定法(fluorescence-enzyme immunoassay; F-EIA)を測定原理としている。
2. 再現性2濃度の専用精度管理試料と2濃度のオートタキシン添加ヒト血清をそれぞれ10回連続測定して,同時再現性を評価した。日差再現性は同時再現性と同様の試料を15日間2重測定して評価した。
3. 希釈直線性希釈直線性は,ヒトプール血清にオートタキシンを添加して作成した高値検体を専用希釈液で2n希釈し,それぞれを3重測定して評価した。
4. 検出限界と定量限界検出限界と定量限界は,専用希釈液と,ヒトプール血清を専用希釈液で2n倍希釈して作成した低濃度試料をそれぞれ5日間2重測定して算出した。
5. 共存物質の影響共存物質の影響の評価には,干渉チェック・Aプラス(シスメックス株式会社)を用いた。オートタキシン濃度が約0.80 mg/L,1.50 mg/L,6.50 mg/Lの3種類のヒト血清に各干渉物質を5段階希釈して添加し,それぞれを3重測定した。共存物質添加前の濃度に比べて10%以上の値の変動がある場合を影響ありとした。
6. 検体安定性検体の安定性の評価には,オートタキシン濃度が約0.80 mg/Lと2.0 mg/Lのプール血清を,室温(約20℃),冷蔵(4–8℃),冷凍(−20℃以下)でそれぞれ小分け分注し,保存したものを使用した。室温は5日間で5回,冷蔵は6日間で4回,冷凍は30日間で6回2重測定して評価した。また凍結融解の影響を評価するため,同様の試料を,5回凍結融解を繰り返して,融解するたびに2重測定した。
7. 健常人分布健常人検体には,AST 11–28 U/L,ALT 7–36 U/L,アルブミン/グロブリン比(ALB/(TP-ALB))1.3–2.0,PLT 10万/μL以上,CRP 0.1 mg/dL未満のすべての条件を満たす160名(男性80名,女性80名,20代から50代の各年代20名)の血清を用いた。男女別,年齢別にカイ2乗検定を行い,各群でオートタキシン濃度に差があるか解析した。またノンパラメトリック法で95%タイル値を健常人の基準範囲として求めた。
8. 統計解析再現性,希釈直線性,検出限界と定量限界,共存物質の影響の統計処理は日本臨床化学会のValidation-Support/Excel Ver3.0を用いた。本研究は信州大学医学部医倫理委員会の承認を得ている(試験番号3244)。
同時再現性および日差再現性の変動係数(coefficient of variation; CV)は,同時再現性で1.74%~2.52%,日差再現性では3.55%~4.09%であった(Table 1)。
Precision
| mean (mg/L) | SD (mg/L) | CV (%) | ||
|---|---|---|---|---|
| Control | level 1 | 0.99 | 0.02 | 1.74 |
| level 2 | 4.91 | 0.12 | 2.52 | |
| Serum | low | 1.12 | 0.03 | 2.35 |
| high | 3.38 | 0.07 | 2.00 | |
| mean (mg/L) | SD (mg/L) | CV (%) | ||
|---|---|---|---|---|
| Control | level 1 | 0.99 | 0.04 | 3.85 |
| level 2 | 4.85 | 0.17 | 3.55 | |
| Serum | low | 1.11 | 0.04 | 3.82 |
| high | 3.39 | 0.14 | 4.09 | |
8.51 mg/Lまで良好な直線性が確認された(Figure 1)。

Linearity
To confirm the linearity, autotaxin-added pooled serum was diluted with a manufacture’s diluent.
検出限界は0.01 mg/Lで,定量限界は許容誤差をCV 10%とすると,0.03 mg/Lであった(Figure 2)。

Limit of quantitation
The plots indicate mean and %CV of samples. Limit of quantitation was determined to be the concentration at which the fitted curve crosses the 10% CV line.
遊離ビリルビンは17.7 mg/dL,抱合型ビリルビンは19.0 mg/dL,溶血ヘモグロビンは445.5 mg/d,乳びは1,318 FTUまで測定値に影響を及ぼさなかった(Figure 3)。
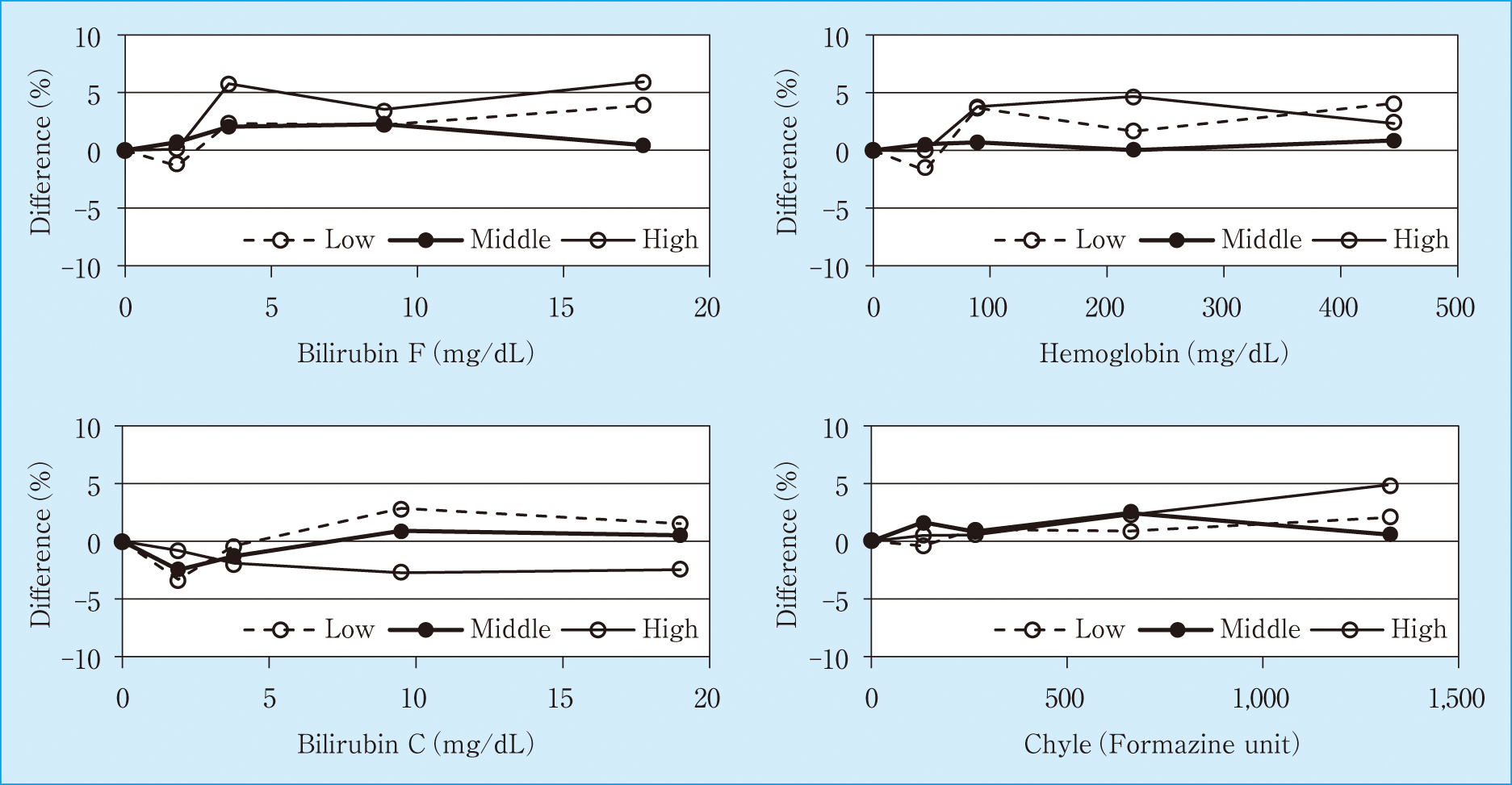
Effects of interfering substances
The plots indicate the change ratio of autotaxin concentration at each concentration of interfering substances.
採取直後の測定値を基準とすると,最大で7%の変動が認められたものの,いずれの保存条件でも測定値の変動に明らかな傾向は認められなかったため,室温で5日間,冷蔵で6日間,冷凍で30日間は,オートタキシンが安定であることが分かった。また凍結融解も5回までは測定値に影響がなかった(Figure 4)。

Stability of autotaxin
The plots indicate the change ratio of autotaxin concentration over time in each storage condition.
健常人のオートタキシン濃度の中央値と四分位範囲は,男性で0.70(0.61–0.76)mg/L,女性で0.82(0.76–0.90)mg/Lで有意に女性のほうが高い結果となった(p < 0.005)。年齢別では男女ともに差は認められなかった(Figure 5)。ノンパラメトリック法による95%タイル値は,男性が0.44–0.91 mg/L,女性が0.64–1.26 mg/Lとなった。
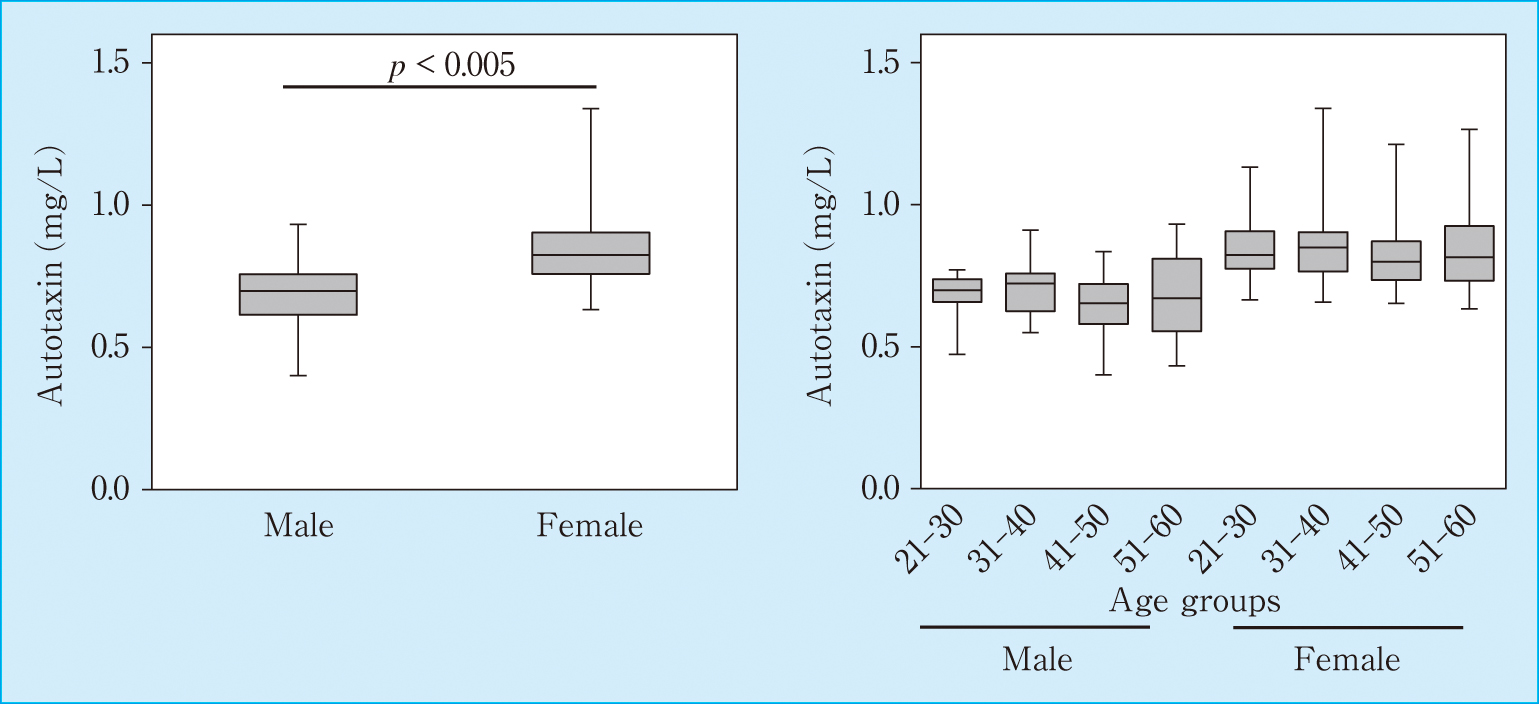
Comparison of autotaxin levels between genders and age groups
The box plots present the interquartile range, 95% confidence, and median value.
Eテスト「TOSOH」II(オートタキシン)の基礎的性能を評価し,健常人の血清オートタキシン濃度の分布について検討した。測定の基礎的性能は良好であり,日常検査法として十分に利用できるものであった。また血清オートタキシンは室温,冷蔵,凍結のどの条件下においても非常に安定な物質であり,臨床の現場でも扱いやすいと言える。健常人においては男性より女性で高値になる傾向があったが,年齢による差は認められなかった。
以前からオートタキシンは女性のほうが高くなることが報告されているが11),その原因はいまだに明らかになっていない。肝線維化以外では,妊娠12)や濾胞性リンパ腫13)などで高値になることが分かっているが,こちらも高値になるメカニズムは解明されていない。肝線維化のある患者でも同様に女性のほうが高値であるため9),基準範囲やカットオフ値も男女別で設定される必要がある。
肝臓の線維化はウィルス性肝炎,自己免疫性肝炎,アルコール性肝炎,非アルコール性脂肪肝炎などの慢性肝炎から生じる病態で,数十年かけて肝硬変へと進展する。特に肝硬変の原因疾患の6割以上を占めるC型肝炎ウィルスによる肝線維化は,線維化の進行と肝細胞癌の発生率が比例することから,治療方針の決定には肝線維化の評価が不可欠である。しかし,肝線維化評価のゴールドスタンダードである肝生検は侵襲性が高く,検査には入院が必要で,患者の合併症によっては実施できない場合もある。さらに,サンプリングエラーが生じるという問題もある。
現在は,ヒアルロン酸やIV型コラーゲン,M2BPGiといった血液マーカーが使用されている。いずれも肝線維化の程度を反映するマーカーではあるが,疾患特異性があまり高くないこと10),14)や,線維化だけでなく肝臓の炎症も反映して高値になること15)などが課題となっている。これらの線維化マーカーに対してオートタキシンはごく一部の疾患を除いては肝線維化でのみ上昇することから,疾患特異性が高く,炎症の影響も受けにくい。また,B型・C型肝炎ウィルス感染による慢性肝炎患者においては,従来のバイオマーカーでは判別が難しかった早期の肝線維化を鋭敏にとらえることができると報告されている9),16)。現在,他の疾患による線維化での評価も行われており,今後の報告に注目したい。
本論文に関連し,開示すべきCOI 状態にある企業等はありません。