2019 Volume 68 Issue 4 Pages 663-670
2019 Volume 68 Issue 4 Pages 663-670
大動脈弁狭窄症に対する,経カテーテル的大動脈弁置換術(transcatheter aortic valve implantation; TAVI)の治療前後における,心機能の変化について,心筋ストレインを用いて検討した。対象はTAVIを施行した20例で,TAVI術前,術後急性期,および術後慢性期に心エコー図検査を施行し,左室心筋全体の長軸方向の収縮指標であるglobal longitudinal strain(GLS)を解析した。解析した結果,TAVI術前の20例平均のGLSは−11.5%,術後急性期のGLSは−12.0%,術前と術後急性期のGLSに有意差を認めなかった(p = 0.09)。一方,術後慢性期のGLSは−14.4%で,術前とのGLSに有意差を認めた(p < 0.01)。また,治療前後において,左室駆出率(left ventricular ejection fraction; LVEF)に著変はなかった。今回の検討により,TAVI術前と術後慢性期とのGLSに有意差を認め,大動脈弁の治療を行うことで,継続的に左室長軸方向の心筋機能は改善するものと思われた。また,TAVI前後ではLVEFに著変はなかったが,GLSでは改善した。GLSはLVEFではわからない収縮異常を検出することが可能であり,心臓弁膜症においても心機能の評価には,心筋ストレインが有用であると思われた。
In this study, we examined cardiac function strain in the left ventricular longitudinal axis direction before and after transcatheter aortic valve implantation (TAVI), which is one of the treatments for aortic valve stenosis, using myocardial strain. The subjects were 20 patients who underwent TAVI at our hospital. We performed echocardiography TAVI at the preoperative, postoperative acute, and postoperative chronic phases, and the indexes of the longitudinal contraction for the left ventricular myocardium global longitudinal strain (GLS) were analyzed. Results of the analysis showed that there were no significant differences in GLS between the preoperative and postoperative acute phases (p = 0.09), with GLS of −11.5% in the 20 patients with TAVI at the preoperative phase and −12.0% in those in the postoperative acute phase. On the other hand, the GLS in the postoperative chronic phase was −14.4%, which is significantly different from that in the preoperative phase (p < 0.01). On the basis of this study, it was considered that the significant improvement in GLS between the TAVI preoperative and postoperative chronic phases and the treatment of the aortic valve continuously improves myocardial function in the left ventricular longitudinal axis direction. Also, before and after TAVI, there was no significant change in the left ventricular ejection fraction (LVEF), but LVEF improved with GLS. With GLS, we were able to detect contraction abnormalities, which was not possible in the case of using LVEF, and myocardial strain was considered to be useful for the evaluation of cardiac function also in valvular disease.
大動脈弁狭窄症(aortic stenosis; AS)は心臓弁膜症の一つであり,高齢化に伴い,AS患者数は増加傾向にある1)。ASの病態生理として,左室に慢性的な圧負荷がかかり,左室の求心性肥大をきたし,さらに進行すると,心筋の線維化によって,非可逆性の壁運動低下をきたし,心不全の原因となる1),2)。また,ASは左室駆出率(left ventricular ejection fraction; LVEF)が正常であっても,心筋の線維化が進行し,心筋機能が低下していることがある。
左室心筋の評価法として,心エコー図検査でスペックルトラッキング法を用いて,心筋の収縮を各方向に分けて解析できるようになった3),4)。なかでも,心尖三断面からの長軸方向のストレイン値を平均した,global longitudinal strain(GLS)は,心臓弁膜症や心不全などの心疾患においても心筋機能を反映し,予後の予測に有用とされている5)~10)。
近年,ASに対する治療法として,経カテーテル的大動脈弁置換術(transcatheter aortic valve implantation; TAVI)が施行されているが,TAVI患者での心筋ストレインの評価を検討した報告は少ない。今回,我々は当院で施行された,TAVI前後における,左室長軸方向の心機能の変化について,心筋ストレインを用いて検討し,若干の知見を得たので報告する。
対象は当院にてTAVIを施行し,描出不良例や局所壁運動異常のある症例を除外した20例で,年齢は80~94歳(平均年齢:88.8歳),男性6例,女性14例であった。TAVIで使用した,人工弁やサイズはTable 1に示した。
| 症例 | 年齢(歳) | 性別 | 人工弁名称 | 人工弁サイズ(mm) |
|---|---|---|---|---|
| 1 | 86 | F | Sapien XT | 23 |
| 2 | 92 | F | Sapien XT | 23 |
| 3 | 91 | F | Sapien XT | 23 |
| 4 | 92 | F | Sapien XT | 23 |
| 5 | 84 | M | Sapien XT | 26 |
| 6 | 94 | F | CoreValve | 26 |
| 7 | 93 | F | Sapien XT | 23 |
| 8 | 93 | F | Sapien XT | 23 |
| 9 | 90 | M | CoreValve | 29 |
| 10 | 93 | F | Evolut R | 23 |
| 11 | 92 | F | Sapien 3 | 23 |
| 12 | 93 | F | Evolut R | 26 |
| 13 | 90 | F | Evolut R | 23 |
| 14 | 84 | F | Sapien 3 | 23 |
| 15 | 88 | M | Evolut R | 29 |
| 16 | 83 | M | Sapien 3 | 29 |
| 17 | 94 | F | Evolut R | 26 |
| 18 | 84 | M | Evolut R | 29 |
| 19 | 80 | F | Evolut R | 29 |
| 20 | 81 | M | Evolut R | 29 |
方法は,GE社製のVivid E9を用いて,TAVI術前,術後急性期(約1週間後),および術後慢性期(約6ヶ月後)に心エコー図検査を施行し,解析装置Echo PAC Version:201を用いて,左室心筋のストレイン解析を行った。心筋ストレイン値は,心尖三断面各々のlongitudinal strainを平均したGLSとした。また,解析ソフトはIBM SPS Statisticsで,統計学的にはPaird t-testを用い,p < 0.05を有意差ありとした。なお,当院ではあらかじめ対象者に十分なインフォームドコンセントが得られており,対象者の同意を得た上で検討を開始した。
20例を平均した,TAVI前後のLVEF,最大大動脈弁通過血流速度(AV flow),左室-大動脈間平均圧較差(mean PG),弁口面積,弁口面積係数をFigure 1に示した。

LVEF(①)は術前,術後に著変はなかったが,AV flow,mean PG,弁口面積,弁口面積係数は術後に改善した(②~⑤)。
TAVI術前20例の平均GLSは−11.5%,術後急性期のGLSは−12.0%で,術前と術後急性期のGLSに有意差を認めなかった(p = 0.09)。また,術後慢性期のGLSは−14.4%で,術前とのGLSに有意差を認めた(p < 0.01)(Figure 2)。

TAVI術前20例平均のGLSは−11.5%,術後急性期のGLSは−12.0%で有意差を認めなかった(p = 0.09)が,術後慢性期のGLSは−14.4%で,術前とのGLSに有意差を認めた(p < 0.01)。
代表例を提示する。
患者:90歳代,女性
既往歴:肺炎,高血圧,骨粗鬆症
現病歴:中等度のASにて,当院循環器内科で経過観察中であった。2015年2月頃より労作時の呼吸困難が出現し,心エコー図検査にて重度のASに進行しており,TAVIが施行された。
入院時現症:身長:147 cm,体重:47 kg,血圧:107/46 mmHg,体温:36.3℃,脈拍数:55回/分,SpO2:98%
術前の心エコー図検査では,心室中隔壁厚(interventricular septum thickness; IVST)は13 mm,左室拡張末期径(left ventricular end-diastolic dimension; LVDd)は54 mm,左室収縮末期径(left ventricular end-systolic dimension;LVDsは29 mm,左室後壁厚(left ventricular posterior wall thickness; LVPWT)は13 mm,左房容積係数(left atrial volume index; LAVI)は85 mL/m2,LVEFは63%,E/Aは0.75,E/e’は35.0であった。大動脈弁は三尖で,高度の石灰化と開放制限を認め,大動脈弁逆流は軽度であった。AV flowは5.5 m/sec,mean PGは86 mmHgと高値を示し,弁口面積は0.5 cm2,弁口面積係数0.4 cm2/m2と小さく,重度のASが疑われた(Figure 3)。また,術前のGLSは−11.9%であった(Figure 4)。術後急性期では,IVSTは12 mm,LVDdは56 mm,LVDsは34 mm,LVPWTは14 mm,LAVIは87 mL/m2,LVEFは64%,E/Aは0.73,E/e’は30.2で術前と著変はなかった。人工弁の可動性は良好で,2か所に軽度の弁周囲逆流を認めた。AV flowは2.2 m/sec,mean PGは10 mmHg,弁口面積は1.7 cm2,弁口面積係数1.2 cm2/m2で,治療により改善した(Figure 5)。また,術後急性期のGLSは−13.0%で,術前よりわずかに改善していた(Figure 6)。術後慢性期では,IVSTは12 mm,LVDdは54 mm,LVDsは32 mm,LVPWTは12 mm,LAVIは98 mL/m2,LVEFは67%,E/Aは0.72,E/e’は24.4であり,左室の大きさやLVEFなどに著変はなかったが,E/e’は改善していた。人工弁の可動性は良好で,術後急性期と著変はなく,AV flowは2.7 m/sec,mean PGは15 mmHg,弁口面積は1.2 cm2,弁口面積係数0.9 cm2/m2で,術後急性期よりわずかに流速が上昇した(Figure 7)。術後慢性期のGLSは−16.3%で,術後急性期よりさらに改善していた(Figure 8)。

大動脈弁に高度の石灰化と開放制限を認め(A~C:矢印),AV flow:5.5 m/sec,mean PG:86 mmHg,弁口面積:0.5 cm2,弁口面積係数0.4 cm2/m2で重度のASが疑われた(D:傍胸骨右縁アプローチ)。また,大動脈弁逆流は軽度であった(E)。

GLSは−11.9%と低値であった。

大動脈弁位に人工弁を認め(A~C:矢印),AV flow:2.2 m/sec,mean PG:10 mmHg,弁口面積:1.7 cm2,弁口面積係数1.2 cm2/m2で,治療により改善した(D:心尖部五腔断面)。

GLSは−13.0%で,わずかに改善した。
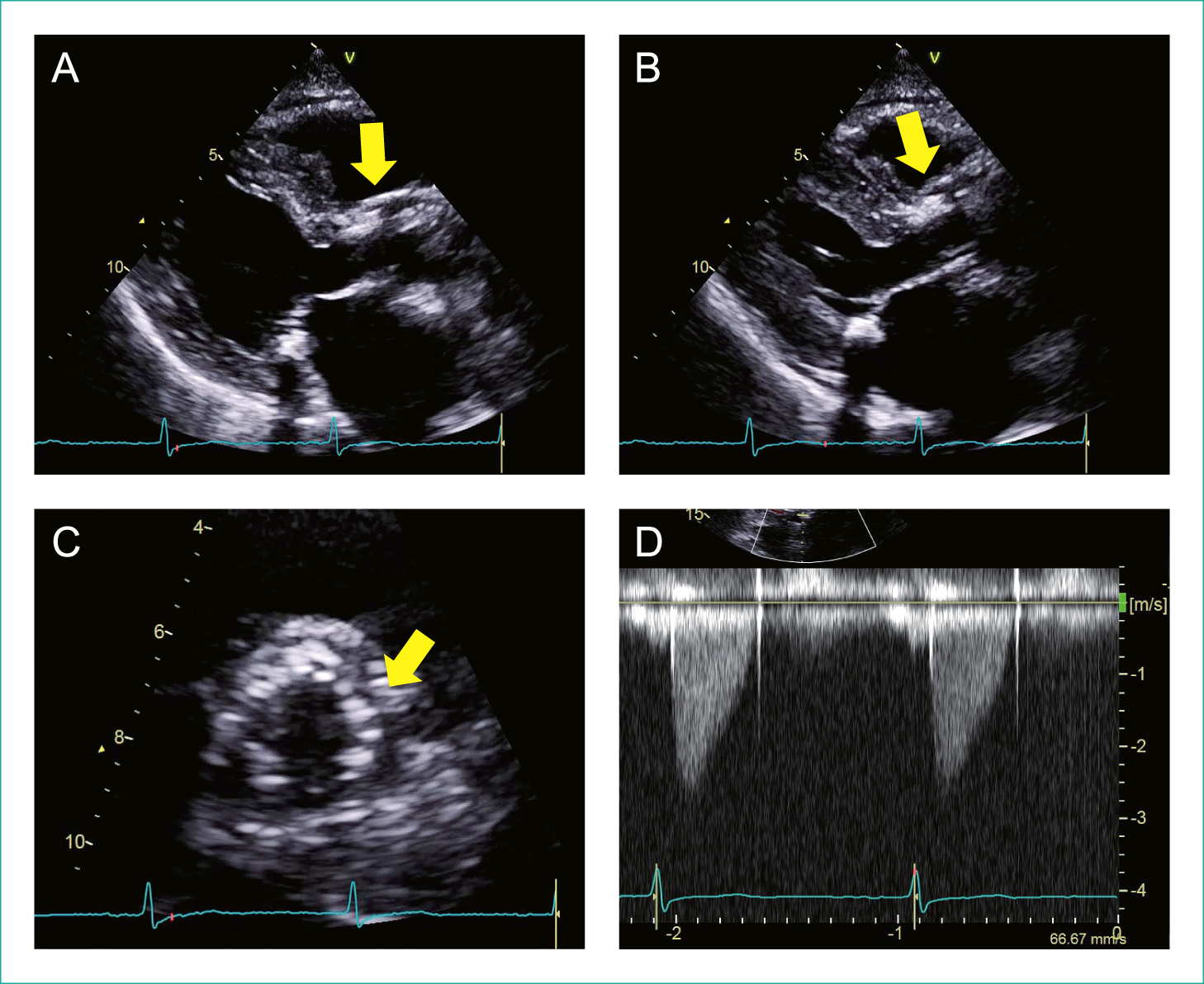
人工弁の可動性に著変はなく(A~C:矢印),AV flow:2.7 m/sec,mean PG:15 mmHg,弁口面積:1.2 cm2,弁口面積係数0.9 cm2/m2で,術後急性期よりわずかに流速が上昇した(D:心尖部五腔断面)。

GLSは−16.3%で,術後急性期よりさらに改善していた。
ASの慢性的な圧負荷によって,左室は代償的に求心性肥大をきたし,心筋の線維化の原因となる1),2)。進行すると,左室心筋重量や酸素消費を増やすとともに,心筋酸素供給が低下し,心筋虚血や心不全を引き起こす1),2),11)。ASは無症状で進行することが多いが,平均余命は心不全出現から2年と,予後は急激に悪化するといわれており,患者の治療時期や治療方針が重要である2)。従来,ASに対する治療法として,大動脈弁置換術が主流であったが,患者層の高齢化により,開心術に高リスクな症例が増加したが,TAVIの普及により,高リスクな患者に対しても,治療が行えるようになった12)。
心エコー図検査はASの評価において,中心的な役割を担っており,非侵襲的に心機能や心臓弁膜症の評価が可能である。さらに,術後の人工弁の評価も可能であり,経過観察にも有用である。近年,スペックルトラッキング法を用いて,心筋の収縮を各方向に分けて解析することができ,局所の心筋収縮について,客観的に評価することが可能となった3),4)。さらに,左室心筋全体の長軸方向の収縮指標であるGLSは,心臓弁膜症や心不全の予後予測に有用である6)~10)。Sawayaら7)は,乳がん患者への抗がん剤に対する心筋障害の予測を検討したところ,投与3ヶ月後のLVEFでは薬剤性心筋障害を予測できなかったが,−19.0%を下回るGLSの低下が,その後の薬剤性心筋障害に先行して出現したと報告している。また,Lancellottiら8)は,無症候性の中等度から重度のAS症例において,GLSが−15.9%以上の群では,2年間のイベント回避生存率が69%であったのに対し,−15.9%未満の群は,わずか29%であったと報告している。
重度のASではLVEFが正常でも,心筋の線維化の進行により,心筋機能は低下している。心筋障害は心内膜面から起こるため,長軸方向から障害され,GLSが心筋機能の評価に有用である6)。今回の検討では,TAVI術前と術後慢性期とのGLSに有意差を認め,大動脈弁の治療を行うことで,圧負荷が解消され,継続的に左室長軸方向の心筋機能は改善すると考えられた。ASにおいて,心筋ストレインの低下は心筋の線維化を反映しており,TAVI前後の心筋機能の影響が,GLSでは鋭敏に反映されたと考えられた。また,今回の20例において,TAVI前後ではLVEFに著変はなかったが,GLSは改善した。心臓弁膜症は圧負荷や容量負荷のため,本来の心機能がマスクされており,LVEFとGLSとの間に乖離がみられたという報告もある3),13)。LVEFよりもGLSは計測再現性が高く,微細な変化に鋭敏な指標であると報告されている13),14)。GLSはLVEFではわからない収縮異常を検出することが可能であり,心臓弁膜症においても心機能の評価には,心筋ストレインが有用であると思われた。
大動脈弁狭窄症の治療法である,TAVIは術後から継続的に心筋機能が改善することが示唆された。TAVI前後の心機能の評価には,心エコー図検査が有用であるが,なかでも心筋ストレインの有用性は高い。
本論文に関連し,開示すべきCOI 状態にある企業等はありません。