2020 Volume 69 Issue 1 Pages 1-9
2020 Volume 69 Issue 1 Pages 1-9
悪性腫瘍の治癒切除例において術前心電図所見と長期予後との関連を検討した報告は極めて少ない。この研究の目的は,大腸癌治癒切除例において術前心電図所見と無再発生存率(recurrence free survival; RFS)との関連を明らかにすることである。大腸癌の術前に心電図検査が行われ,治癒手術が行われ,病理組織学的にStage IIあるいはIIIと診断された431例を対象とした。年齢,性別,腫瘍の占拠部位(左側結腸/右側結腸/直腸),腫瘍のStage,術後補助化学療法,術前心電図所見(心拍数,PR間隔,QRS間隔,QTc間隔,左室肥大(left ventricular hypertrophy; LVH)の有無と術後RFSとの関連を検討した。多変量解析でRFSと有意な関連を認めた因子は年齢,腫瘍の占拠部位,Stage,QRS間隔(< 120 ms, ≥ 120 ms),LVHの有無で,QRS間隔 ≥ 120 ms,LVH(+)はStageと独立した有意な予後不良因子であった。Stage IIIではQRS間隔 ≥ 120 ms,LVH有の両者あるいはいずれかを認める症例のRFSは,両者のない症例と比較して有意に低かった(p = 0.0475)。Stage II,III大腸癌治癒切除例において,術前心電図検査におけるQRS間隔 ≥ 120 ms,LVHは長期予後不良を示唆する。
Few studies have shown the relationship between electrocardiogram (ECG) findings and long-term outcomes after malignant tumor resection. In this study, we aimed to evaluate the relationship between preoperative ECG findings and relapse-free survival (RFS) in patients who underwent curative resection for colorectal cancer (CRC). The study included 431 patients who underwent R0-resection for Stages II and III CRC, and data for the following parameters were collected: age, sex, tumor location (left or right side of the colon or rectum), tumor depth (T), lymph node metastasis (N), stage, postoperative adjuvant chemotherapy, preoperative ECG findings (heart rate, PR interval, QRS interval, QTc interval, and left ventricular hypertrophy (LVH)), and RFS. Univariate analysis revealed that age, tumor location, T, N, stage, postoperative adjuvant chemotherapy, and LVH were significantly associated with RFS. Multivariate analysis revealed that age, stage, QRS interval, and LVH were independent significant prognostic factors. Patients with a QRS interval ≥ 120 ms and/or LVH showed significantly shorter RFS than those without either of these factors (p = 0.0475) in Stage III CRC. Thus, a QRS interval ≥ 120 ms and LVH on preoperative ECG may be long-term prognostic factors for patients undergoing curative resection for CRC.
大腸癌は本邦の全悪性新生物の罹患数において男性では4位,女性では2位,死亡数において男性では3位,女性では1位を占める疾患である1)。外科的切除は大腸癌の標準的治療の1つであり,手術後の再発リスクを正確に予測することは術後のフォローアップ計画策定,治療方針の決定に重要である。大腸癌患者の予後予測因子として病理学的病期(Stage)が最も重要であるが,これを補う予後予測因子が明らかになれば,術後補助療法,サーベイランス計画の策定に有用である。
心電図所見は心筋の電気生理学的状態を反映し,血清電解質,イオン電流,代謝の変化,薬物などの影響を受ける。心電図検査はその簡便性,有用性から医療において汎用されているが,近年,心電図検査所見が慢性腎障害患者,高齢者において,心血管疾患による死亡だけでなく,全死亡と関連するという報告がある2),3)。しかし,悪性腫瘍の治癒切除例において心電図所見と長期予後との関連を検討した報告は極めて少ないため,大腸癌治癒切除例において術前心電図所見と無再発生存率(recurrence free survival; RFS)との関連を明らかにすることを,本研究の目的とした。
2008年1月から2013年3月までに,大腸癌に対して術前に心電図検査が行われ,治癒切除(R0手術)が行われ,病理組織学的にStage IIあるいはIIIと診断された446例のうち,心房細動および心室性不整脈を認めた症例(n = 13),ペースメーカーの留置された症例(n = 2)を除いた431例(平均年齢:69.0 ± 9.6歳,男:女=246:185)を対象とした。12誘導心電図はCardio Star FCP-7431(フクダ電子)を用い,標準化された手順によって記録した4)。心拍数,PR間隔,QRS間隔,QTc間隔を正常洞調律中に自動記録し,ミネソタ分類に従って(心電図自動解析プログラムS1バージョン),自動判読結果を用いて以下の5項目を評価した:心拍数 < 50/50–100/> 100(bpm),PR間隔 < 200/≥ 200(msec),QRS間隔 < 100/100–119/≥ 120(msec),QTc間隔 < 440/≥ 440,左室肥大(left ventricular hypertrophy; LVH)の有無5)。V5あるいはV6誘導でのR波とV1誘導S波の和が3.5 mV以上,左室高電位 + 左房負荷,ST変化を考慮してLVHと診断した6)。
年齢,性別,腫瘍の占拠部位(左側結腸/右側結腸/直腸),腫瘍の深達度(T),リンパ節転移(N),Stage,術後補助化学療法の有無,心電図所見と術後RFSとの関連を検討した。腫瘍の病理組織学的分類はUICCI TNM分類(第7版)に従った7)術後補助化学療法はPerformance statusが0~1で主要臓器機能(骨髄,肝機能,腎機能)が保たれたStage III症例,および再発リスクの高いStage IIの症例(T4,穿孔,低分化型腺癌,脈管侵襲陽性,腸閉塞を伴う症例)で,患者の同意が得られた症例に施行された。カルテから再発所見を検索し,2017年7月までの全ての患者のフォローアップデータを収集した。
心拍数,収縮期血圧,拡張期血圧,体格指数(BMI),術前2週間以内に施行されたルーチン術前血液検査(血色素量(Hb),平均赤血球容積(mean corpuscular volume; MCV),白血球数,好中球数,好中球/リンパ球比率(N/L比),ナトリウム(Na),カリウム(K),クロール(Cl),C-Reactive Protein(CRP),アルブミン),Glasgow Prognostic Score(GPS)とQRS間隔,LVHとの関連を検討した。GPSは,CRP ≤ 1.0 mg/dLとAlb ≥ 3.5 g/dLの両者を認める場合はGPS 0,CRP > 1.0 mg/dL あるいはAlb < 3.5 g/dLのいずれか一方を認める場合はGPS 1,CRP > 1.0 mg/dLとAlb < 3.5 g/dLの両者を認める場合は,GPS 2と分類した8)。
統計学的解析連続変数は中央値(四分位範囲)あるいは平均 ± 標準偏差で表し,Mann-Whitney U testあるいはStudent t testで比較した。カテゴリー変数はカイ2乗検定で比較した。
RFSは再発をイベントとし,再発無く生存(最終無再発生存確認日)あるいは再発がなく,大腸癌と関連のない死亡を打ち切りとして扱って計算した。単変量解析ではKaplan-Meier法で生存率を算出し,群間の差をlog-rank testで検定した。多変量解析では単変量解析を行った因子をすべて共変量として投入した。ただし,T,N因子はStageと関連が強いためStageに統一した。多変量解析はCox比例ハザードモデルを用い,ハザード比,95%信頼区間を算出した。統計解析にはJMP version 10.0 for Windows(SAS Institute Inc., Cary, NC)を使用し,p < 0.05を統計学的に有意とした。
本研究は介入を伴わない後ろ向き研究であるため,当院の臨床研究審査委員会によって患者の同意は必要ないと判断された(承認番号:2017-043)。
患者の背景因子をTable 1に示す。全431例のうちStage IIは219例,Stage IIIは212例で,そのうち146例(Stage II: 11%, Stage III: 58%)で術後補助化学療法が施行された(Table 1)。術後補助化学療法レジメンはUracil/Tegafur and oral Leucovorin,Capecitabine,Uracil/Tegafur,XELOXの順に多かった。術後観察期間の中央値は60.9ヶ月(四分位範囲:35.8~86.0ヶ月)で,5年RFSはStage II:85.1%,Stage III:61.3%であった。
| 年齢(歳) | 69.0 ± 9.6(31–91) |
| 性別(男:女) | 246:185 |
| 占拠部位 | |
| 右側結腸 | 153(35%) |
| 左側結腸 | 137(32%) |
| 直腸 | 141(33%) |
| Stage | |
| II | 219(51%) |
| III | 212(49%) |
| 術後補助化学療法 | |
| 無 | 285(66%) |
| 有 | 146(34%) |
| 心電図所見 | |
| HR(bpm) | 72(63–80) |
| PR間隔(msec) | 160(146–176) |
| QRS間隔(msec) | 98(92–106) |
| QTc間隔 | 425(407–439) |
| LVH | |
| (−) | 369(86%) |
| (+) | 62(14%) |
単変量解析でRFSと有意な関連を認めた因子は,年齢,腫瘍の占拠部位,T,N,Stage,術後補助化学療法,LVHであった(Table 2)。多変量解析でRFSと有意な関連を認めた因子は年齢,Stage,QRS間隔,LVHであった。QRS間隔 ≥ 120 ms,LVH(+)はStageとは独立した有意な予後不良因子で,QRS間隔100–119 msを基準とすると,QRS間隔 ≥ 120 msの症例の再発のハザード比は2.23(95%信頼区間:1.09–4.27,p = 0.0301)であった(Table 2)。LVH(−)を基準とすると,LVH(+)の症例の再発のハザード比は1.71(95%信頼区間:1.04–2.71,p = 0.0363)であった。QRS間隔120 msで患者を2群に分類したRFS曲線をFigure 1に,LVHの有無で患者を2群に分類したRFS曲線をFigure 2に示す。QRS間隔 ≥ 120 ms,LVH有りの両者,あるいはいずれかを認めた症例のRFSは,QRS間隔 < 120 msかつLVH無との症例と比較してStage IIIでは有意に低く(p = 0.0475),Stage IIでは低い傾向を認めた(p = 0.3268)(Figure 3)。術後補助化学療法の有無別に検討を行っても,以上の結果は同様であった。
| n | 単変量解析 | 多変量解析 | |||||
|---|---|---|---|---|---|---|---|
| 5年無再発生存率 | p | ハザード比 | 95%信頼区間 | p | |||
| 年齢(歳) | < 65 | 124 | 63.3% | 0.0019 | 1.76 | 1.14–2.68 | 0.0100 |
| ≥ 65 | 307 | 77.7% | 1 | ||||
| 性別 | 女 | 185 | 72.9% | 0.6936 | 1.06 | 0.70–1.61 | 0.7731 |
| 男 | 246 | 74.2% | 1 | ||||
| 占拠部位 | 右側結腸 | 153 | 77.8% | 0.0219 | 0.72 | 0.44–1.16 | 0.1743 |
| 左側結腸 | 137 | 77.9% | 0.64 | 0.39–1.01 | 0.0569 | ||
| 直腸 | 141 | 64.6% | 1 | ||||
| 深達度(T) | T1 | 7 | 85.7% | < 0.0001 | |||
| T2 | 20 | 70.5% | |||||
| T3 | 351 | 77.7% | |||||
| T4a | 30 | 51.4% | |||||
| T4b | 23 | 36.4% | |||||
| リンパ節転移(N) | N1 | 220 | 84.8% | < 0.0001 | |||
| N2 | 166 | 66.2% | |||||
| N3 | 45 | 45.0% | |||||
| Stage | II | 219 | 85.1% | < 0.0001 | 0.33 | 0.20–0.52 | < 0.0001 |
| III | 212 | 61.3% | 1 | ||||
| 術後補助化学療法 | 無 | 285 | 77.8% | 0.0170 | 1 | ||
| 有 | 146 | 65.9% | 0.80 | 0.52–1.26 | 0.3417 | ||
| 心電図所見 | |||||||
| 心拍数(bpm) | <50 | 2 | 100.0% | 0.3305 | 0.000047 | 0–3.64 | 0.2876 |
| 50–100 | 405 | 74.1% | 1 | ||||
| ≥ 100 | 24 | 63.1% | 1.56 | 0.67–3.18 | 0.2772 | ||
| PR間隔(msec) | < 200 | 402 | 73.8% | 0.5816 | 1 | ||
| ≥ 200 | 29 | 70.8% | 1.46 | 0.64–2.90 | 0.3380 | ||
| QRS間隔(msec) | < 100 | 231 | 72.9% | 0.1769 | 1.23 | 0.79–1.93 | 0.3634 |
| 100–119 | 165 | 76.9% | 1 | ||||
| ≥ 120 | 35 | 62.5% | 2.23 | 1.09–4.27 | 0.0301 | ||
| QTc間隔 | < 440 | 324 | 73.4% | 0.9066 | 1 | ||
| ≥ 440 | 107 | 74.4% | 0.92 | 0.56–1.48 | 0.7494 | ||
| LVH | (−) | 369 | 75.5% | 0.0194 | 1 | ||
| (+) | 62 | 62.4% | 1.71 | 1.04–2.71 | 0.0363 | ||

QRS間隔120 msで患者を2群に分類した無再発生存率曲線を示す。

LVHの有無で患者を2群に分類した無再発生存率曲線を示す。
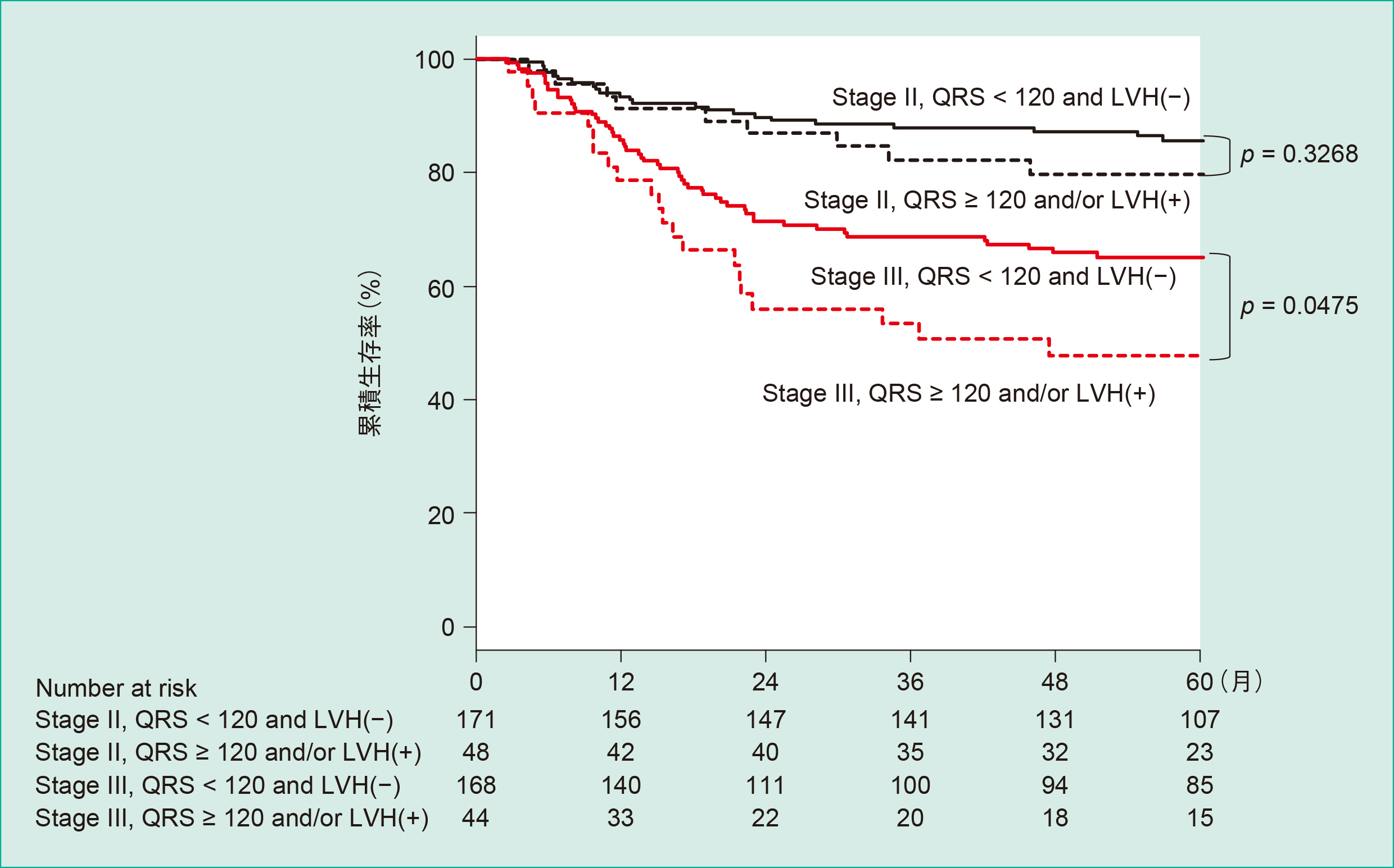
Stage,QRS間隔,LVHと無再発生存率との関係を示す。QRS間隔 ≥ 120 ms,LVH有りの両者,あるいはいずれかを認めた症例のRFSは,QRS間隔 < 120 msかつLVH無との症例と比較してStage IIIでは有意に低く(p = 0.0475),Stage IIでは低い傾向を認める(p = 0.3268)。
Figure 4にQRS間隔 < 120 msかつLVH(−)の症例のうちの1例の心電図所見を示す。Figure 5にQRS間隔 ≥ 120 msかつLVH(+)の症例のうちの1例の心電図所見を示す。

QRS間隔83 msec,R波(V5)+ S波(V1)=2.6 mV

QRS間隔127 msec,R波(V5)+ S波(V1)=5.1 mV。
本研究においてQRS ≥ 120 msであった35症例の内訳は,右脚ブロック(complete right bundle branch block; CRBBB)(27例),左脚ブロック(complete left bundle branch block; CLBBB)(2例),非特異的心室内伝導障害(6例)であった。この35例は術後経過観察期間中にCLBBB,CRBBBへそれぞれ1例が移行したが,心血管疾患による死亡を認めていない。
QRS間隔,LVHと臨床・心電図所見との関連を検討すると(Table 3),QRS ≥ 120 msecは男性,HR,QTc間隔 ≥ 440,MCV高値と有意な関連を認めた。LVH(+)では心拍数が有意に低く,収縮期血圧,Na,Clが有意に高かった。N/L比,CRP,アルブミン,GPSとQRS間隔,LVHに有意な関連を認めなかった。
| QRS間隔 | LVH | ||||||
|---|---|---|---|---|---|---|---|
| < 120 ms(n = 396) | ≥ 120 ms(n = 35) | p | (−)(n = 369) | (+)(n = 62) | p | ||
| 年齢(歳) | < 65 | 118(29.8%) | 6(17.1%) | 0.1129 | 109(29.5%) | 15(24.2%) | 0.3896 |
| ≥ 65 | 278(70.2%) | 29(82.9%) | 260(70.5%) | 47(75.8%) | |||
| 性別 | 女 | 177(44.7%) | 8(22.9%) | 0.0123 | 158(42.8%) | 27(43.5%) | 0.9144 |
| 男 | 219(55.3%) | 27(77.1%) | 211(57.2%) | 35(56.5%) | |||
| 占拠部位 | 右側結腸 | 145(36.6%) | 8(22.9%) | 0.2526 | 130(35.2%) | 23(37.1%) | 0.7202 |
| 左側結腸 | 123(31.1%) | 14(40.0%) | 120(32.5%) | 17(27.4%) | |||
| 直腸 | 128(32.3%) | 13(37.1%) | 119(32.3%) | 22(35.5%) | |||
| Stage | II | 200(50.5%) | 19(54.3%) | 0.6680 | 188(50.9%) | 31(50.0%) | 0.8901 |
| III | 196(49.5%) | 16(45.7%) | 181(49.1%) | 31(50.0%) | |||
| 術後補助化学療法 | 無 | 261(65.9%) | 24(68.6%) | 0.7497 | 244(66.1%) | 41(66.1%) | 0.9995 |
| 有 | 135(34.1%) | 11(31.4%) | 125(33.9%) | 21(33.9%) | |||
| 心電図検査所見 | |||||||
| 心拍数(bpm) | < 50 | 1(0.3%) | 1(2.9%) | 0.0323 | 2(0.5%) | 0(0.0%) | 0.2835 |
| 50–100 | 371(93.7%) | 34(97.1%) | 344(93.2%) | 61(98.4%) | |||
| ≥ 100 | 24(6.0%) | 0(0.0%) | 23(6.3%) | 1(1.6%) | |||
| PR間隔(msec) | < 200 | 372(93.9%) | 30(85.7%) | 0.0626 | 346(93.8%) | 56(90.3%) | 0.3165 |
| ≥ 200 | 24(6.1%) | 5(14.3%) | 23(6.2%) | 6(9.7%) | |||
| QRS間隔(msec) | < 100 | 203(55.0%) | 28(45.2%) | 0.3126 | |||
| 100–119 | 136(36.9%) | 29(46.8%) | |||||
| ≥ 120 | 30(8.1%) | 5(8.0%) | |||||
| QTc間隔 | < 440 | 306(77.3%) | 18(51.4%) | 0.0007 | 281(76.2%) | 43(69.4%) | 0.2517 |
| ≥ 440 | 90(22.7%) | 17(48.6%) | 88(23.8%) | 19(30.6%) | |||
| LVH | (−) | 339(85.6%) | 30(85.7%) | 0.9860 | |||
| (+) | 57(14.4%) | 5(14.3%) | |||||
| 心拍数(bpm) | 72(63–81) | 70(63–77) | 0.2749 | 72(64–81) | 67(59–78) | 0.0079 | |
| 収縮期血圧(mmHg) | 122(110–140) | 122(116–132) | 0.7254 | 122(110–137) | 137(115–147) | 0.0197 | |
| 拡張期血圧(mmHg) | 72.1 ± 12.5 | 69.9 ± 11.5 | 0.3770 | 71.7 ± 12.4 | 74.0 ± 13.0 | 0.2440 | |
| 体格指数(BMI) | 22.2(20.1–24.5) | 22.7(21.6–25.8) | 0.1660 | 22.3(20.2–24.7) | 21.4(19.4–23.5) | 0.0661 | |
| Hb(g/dL) | 11.8 ± 1.9 | 12.2 ± 2.0 | 0.3090 | 11.9 ± 1.9 | 11.6 ± 2.0 | 0.4480 | |
| MCV(fL) | 90.2(83.1–93.8) | 92.9(86.7–95.8) | 0.0143 | 90.4(83.6–93.8) | 90.9(85.0–94.4) | 0.5607 | |
| WBC(×103/μL) | 6.2(4.9–7.8) | 6.1(5.2–7.0) | 0.8202 | 6.2(5.1–7.6) | 5.9(4.9–7.9) | 0.4976 | |
| neutrophil count(×103/μL) | 3,945(2,950–5,233) | 3,802(3,300–4,898) | 0.9724 | 3,928(3,008–5,142) | 3,966(2,817–5,404) | 0.9968 | |
| N/L比 | 2.7(1.9–4.0) | 3.0(2.0–3.9) | 0.4037 | 2.7(1.9–4.0) | 2.8(1.7–4.6) | 0.8508 | |
| Na(mEq/L) | 139(138–141) | 139(137–140) | 0.2806 | 139(137–141) | 140(138–141) | 0.0263 | |
| K(mEq/L) | 4.2(4.0–4.5) | 4.3(4.0–4.5) | 0.4539 | 4.2(4.0–4.5) | 4.2(4.0–4.5) | 0.6765 | |
| Cl(mEq/L) | 103(102–105) | 103(102–106) | 0.8165 | 103(102–105) | 104(103–106) | 0.0044 | |
| CRP(mg/dL) | 0.3(0.1–1.1) | 0.4(0.2–1.1) | 0.4607 | 0.3(0.1–1.0) | 0.2(0.2–1.5) | 0.8319 | |
| Albumin(g/dL) | 3.9(3.5–4.2) | 3.9(3.7–4.2) | 0.3632 | 3.9(3.5–4.2) | 4.0(3.5–4.3) | 0.3522 | |
| Glasgow prognostic score (0, 1, 2) |
0 | 118(50.4%) | 12(63.2%) | 0.6780 | 116(52.2%) | 14(45.2%) | 0.3600 |
| 1 | 82(35.1%) | 5(26.3%) | 77(34.7%) | 10(32.2%) | |||
| 2 | 34(14.5%) | 2(10.5%) | 29(13.1%) | 7(22.6%) | |||
本研究ではStage II,III大腸癌治療切除例において術前心電図所見RFSとの関連を検討した。多変量解析ではQRS間隔,LVHはRFSと有意に関連し,QRS間隔 ≥ 120 ms,LVH(+)はStageとは独立した有意な予後不良因子であった。Stage III症例では,QRS間隔 ≥ 120 msec,LVHのいずれかあるいは両者を認める症例のRFSは,この両者を認めない症例と比較して,有意に低かった。
QRS間隔の延長は心室内伝導障害や線維症,伝導系疾患を反映し,脱分極時間の延長,両心室あるいは中隔壁と左心室自由壁の収縮の時相のずれを意味する9)。その結果,一回拍出量が減少し,前負荷の増大による心房拡張,房室伝導遅延を招く。Chengら10),Desaiら11)は,QRS間隔 ≥ 120 msは心血管疾患死亡のリスク因子であると報告している。
本研究においてQRS間隔とLVHはRFSと有意な関連を認めたため,この両者と臨床所見との関連を検討すると,QRS ≥ 120 msecの症例はQRS < 120 msecの症例と比較して,MCVが高かった。MCVは貧血の指標として知られているが,MCV高値は炎症,内皮細胞障害,およびインスリン抵抗性糖尿病の指標でもある12)。一方,インスリン抵抗性と悪性腫瘍による死亡との関連を示す複数の報告がある13),14)。また,Nagaiら15)は大腸癌治癒切除例において,MCV高値はRFS不良と有意に関連することを報告している。
インスリン抵抗性と高血圧はメタボリック症候群(metabolic syndrome; MetS)の構成要素である16)。Lindら17)は,中年男性における高血圧,脂質異常症および高インスリン血症はQRS間隔と関連すると報告している。Isikら18)は,142例のMetS患者を170例の年齢および性別の一致した対象者と比較し,MetS患者ではQRS間隔が長いことを報告している。さらにElffersら19)は,Netherlands Epidemiology of Obesity studyの対象者6,671例を調査し,MetSの要素数が多い人ほどQRS間隔が長いことを報告している。Gomez-Marcosら20),Uedaら21)は,高血圧は心電図でのLVHと関連することを報告している。以上の報告を考慮すると,心電図検査におけるQRS間隔,LVHはMetS要素の代理指標である可能性がある。
本研究結果は大腸癌治癒切除例におけるRFSとMetS要素との関連を示唆している可能性がある。これまでに,MetSと悪性腫瘍による死亡との関連を示す多くの報告がある16),22)~26)。高インスリン血症はinsulin-like growth factor 1(IGF-1)の生物学的利用能の促進と関連する27)。インスリンとIGF-1は肝における性ホルモン結合グロブリン(sex hormone binding globulin)合成を抑制し,エストロゲン上昇と関連する28)。脂肪細胞から分泌されるレプチン(leptin)は細胞増殖や血管増殖を促進する29)。tumor necrosis factor-α(TNF-α)は肥満,インシュリン抵抗性と関連する30)。インシュリン,IGF-1,エストロゲン,leptin,TNF-αは,脂肪細胞からの血管内皮細胞増殖因子(vascular endothelial growth factor; VEGF)の分泌を促進する31)。これらの機序は,MetSと悪性腫瘍による死亡との関連を支持している。
大腸癌の予後指標として,好中球数,N/L比,CRP,Albumin,GPSなどが知られているが,本研究においてはQRS間隔とLVHにこれらの因子と有意な関連を認めなかった8),32),33)。これはQRS間隔,LVHは炎症,栄養指標と関連が乏しいことを示唆している。QRS間隔≥ 120 ms,LVH(+)で分類すると,Stage IIIではこれらの両者あるいはいずれかを認める症例は両者を認めない症例と比較して,RFSが有意に不良であった(Figure 3)。これは,より再発のリスクの高いStage III症例において,心電図所見による分類が有用であることを示唆している。
本研究には考慮すべきいくつかの制限がある。第一に,本研究は単一施設で行われた後ろ向き研究であり,検討されていないさまざまなバイアスを含んでいる可能性がある。第二に,術後補助化学療法が行われた症例が対象に含まれている。術後補助化学療法の施行/非施行,そのレジメンはRFSに影響を与える。しかし,術後補助化学療法の有無でサブグループ解析を行っても,QRS ≥ 120 msec,LVH有りはRFSと同様の関連を認めた。第三に,本研究は患者の全身状態,併存疾患,外科的アプローチ(開腹または腹腔鏡)および術後合併症について調査していない。これらの因子はRFSに影響した可能性があるが,本研究では調査しなかった。第四に,LVHの評価は心電計に搭載されている自動判読機能を用いているため,心尖部肥大型心筋症や心尖部瘤合併例を疑う症例が対象に含まれている。第五に,本研究はQRS間隔,LVHとRFSとの関連を明らかにしたが,MetSの要素である中心性肥満,脂質異常,インスリン抵抗性について調査していない。今後の研究では心電図所見とこれらの因子について関連を検討する必要がある。
これらの制限はあるが,我々の知る限りでは,本研究は大腸癌切除例において術後心電図検査所見と長期予後との関連を明らかにした初めての研究である。QRS間隔,LVHは術前心電図検査から簡便に得られ,臨床で利用しやすいことは長所の一つである。本研究結果は大腸癌術後のフォローアップ計画策定,治療方針の決定に有用である。つまりQRS間隔(≥ 120 ms),LVH(有)の患者ではフォローアップを密にし,再発により注意すべきである。また,この両者は術後補助化学療法の決定に有用である可能性がある。加えて,大腸癌患者において肥満,高血圧,脂質異常および血糖,高インシュリン血症を考慮した治療が再発防止の点からも有用である可能性がある。
Stage II,III大腸癌根治切除例において,術前心電図検査におけるQRS間隔 ≥ 120 ms,LVH有は長期予後不良因子である。
本論文に関連し,開示すべきCOI 状態にある企業等はありません。