2020 Volume 69 Issue 3 Pages 366-373
2020 Volume 69 Issue 3 Pages 366-373
ECLIA法を原理としたエクルーシス試薬ビタミンDトータルIIの基礎的検討を行った。併行精度はCV:2.4~5.4%,室内精度はCV:4.1~10.6%と良好であった。定量限界(LoQ)はCVが20%となる濃度が2.69 ng/mLであり,また希釈直線性も良好であった。共存物質の影響については,遊離型ビリルビン,抱合型ビリルビン,溶血ヘモグロビン,乳び,およびリウマトイド因子のいずれにおいても最終濃度まで影響は認められなかった。他法との相関性については,リエゾンとは回帰式y = 0.87x + 2.14,相関係数r = 0.94,ルミパルスとは回帰式y = 0.85x + 4.46,相関係数r = 0.97となり良好な相関性が認められたが,エクルーシス試薬とリエゾンの相関で回帰直線の95%信頼区間を外れる乖離検体が1件認められた。乖離検体の25(OH)D濃度は高く,測定値の乖離はビタミンD結合蛋白(DBP)からビタミンDを解離する前処理試薬の性能の違いにより生じたものであると考えられた。乖離例において,DBP濃度が約1,000 μg/mLと高値を示しており,25(OH)D測定においてLC-MS/MSと最も近い値を示したのはエクルーシス試薬であった。エクルーシス試薬ビタミンDトータルIIは十分な性能を持っており,LC-MS/MSとも近い値を示す良好な試薬であると考えられた。
The clinical significance of 25-hydroxyvitamin D (25(OH)D), which is the storage form of vitamin D, has attracted attention. In this study, Elecsys Vitamin D total II based on electrochemiluminescence immunoassay was evaluated. The CV of repeatability and the intermediate precision were 2.4 to 5.4% and 4.1 to 10.6%, respectively. The LoQ at which the CV became 20% was 2.69 ng/mL, and the dilution linearity was also good. No effects of interfering substances were observed up to a final concentration. In the analysis of correlation with other methods, the regression equation and correlation coefficient for LIAISON were y = 0.87x + 2.14 and r = 0.94, and those for LUMIPULSE were y = 0.85x + 4.46 and r = 0.97, respectively, indicating a good correlation. However, one sample was outside the 95% confidence interval of the linear regression slope in the correlation between Elecsys and LIAISON. A similar deviation was observed in the same patient sample during the study period, which was considered to be due to differences in the performance of pretreatment reagents that dissociate 25(OH)D from the vitamin D-binding protein (DBP). In the example of the deviation from the high concentration range, the DBP concentration was about 1,000 μg/mL, and the 25(OH)D concentrations measured using Elecsys as a reagent were closest to those obtained by LC-MS/MS. The results of this study indicate that Elecsys is a good reagent with sufficient performance.
ビタミンDは脂溶性ビタミンの一つであり,植物性のビタミンD2と動物性のビタミンD3に大別される。体内への供給源としては,食事やサプリメントからの経口摂取と紫外線照射による皮膚での生合成である。体内に取り込まれたビタミンDのほとんど全ては肝臓で25ヒドロキシビタミンD(25-hydroxyvitamin D; 25(OH)D)に変換される。25(OH)DはビタミンD結合蛋白(vitamin D binding protein; DBP)と結合して比較的安定に血中を循環する。循環血液中の25(OH)Dは,メガリンを介して細胞内に取り込まれる。腎臓の近位尿細管では,1,25ジヒドロキシビタミンD(1,25-dihydroxyvitamin D; 1,25(OH)2D)が合成され血中へと分泌される。ビタミンDの作用は,核内受容体スーパーファミリーに属するビタミンD受容体(VDR)を介して発現されるが,このVDRに対する親和性が最も高いのが1.25(OH)2Dである1)。
ビタミンDは,非充足状態にあると腸管におけるカルシウムおよびリンの吸収低下をきたす。骨の材料となるカルシウムおよびリンの吸収低下により骨の石灰化障害が発生し,くる病・骨軟化症の発症リスクが上昇する。また,カルシウムおよびリンの血中濃度が下がると,それを元に戻すために副甲状腺ホルモン(parathyroid hormone; PTH)の分泌が亢進する。そしてPTHの骨吸収促進作用によって骨粗しょう症の発症リスクが上昇すると考えられている。また,骨粗しょう症の治療に用いられるビスフォスフォネート系製剤に代表される骨吸収抑制薬は,ビタミンDが充足していない患者に投与しても十分な効果が期待できないことが報告されている2)~5)。
ビタミンDは,体内において多くの代謝産物が存在するが,臨床的意義を持つビタミンDは主に活性型である1,25(OH)2Dと貯蔵型である25(OH)Dである。血中1,25(OH)2Dは,血中カルシウム濃度の変化によって厳密に調整され,ビタミンD欠乏が深刻にならない限り減少しない。それに対して,25(OH)Dは血中半減期が約3週間と長いことから,生体のビタミンD充足度を反映すると考えられている1)。そのためビタミンD非充足は25(OH)D減少によるビタミンD作用が低下した状態であると考えられるようになっており,臨床的にビタミンD代謝状態を正確に評価するには,25(OH)Dを測定することが推奨されている2),6)。
今回我々は,電気化学発光免疫測定法(electrochemiluminescence immunoassay; ECLIA)を原理とした新規25(OH)D測定試薬であるエクルーシス試薬ビタミンDトータルIIを検討する機会を得たので報告する。
なお,本研究は岡山大学の倫理委員会の承認を受けて実施した(審査番号:研1802-040)。
2018年3月30日から2018年12月31日までの間に,当院検査部に25(OH)Dの測定依頼があった患者検体122件を対象とした。対象となった患者検体の残余血清を検体採取したその日のうちに0.5~1.0 mL分注し,連結可能匿名化処理を行った上で−20℃以下で凍結保存した。測定に使用した検体の残りはプール血清として使用した。
2. 25(OH)D測定検討試薬はECLIAを原理としたエクルーシス試薬ビタミンDトータルII(ロシュ・ダイアグノスティックス株式会社,以下Elecsys)を用い,対照試薬は化学発光免疫測定法(chemiluminescent immunoassay; CLIA)を原理としたリエゾン25水酸化ビタミンDトータル(協和メディックス株式会社,以下LIAISON)と化学発光酵素免疫測定法(chemiluminescent enzyme immunoassay; CLEIA)を原理としたルミパルス25-OHビタミンD(富士レビオ株式会社,以下LUMIPULSE)を用いた。
測定機器として,Elecsysはcobas8000〈e801|e801〉(ロシュ・ダイアグノスティックス株式会社)を用い,LIAISONはLSIメディエンス株式会社に,LUMIPULSEは富士レビオ株式会社にそれぞれ外注委託した。
3. 併行精度2濃度のコントロール血清であるエクルーシスプレチコントロールビタミンDトータルII(ロシュ・ダイアグノスティックス株式会社,以下VITDT1およびVITDT2)および2濃度に調整したプール血清(以下Pool LおよびPool H)を用いて同時に21回測定を行い,それぞれの変動係数(coefficient of variation; CV)を求めた。
4. 室内精度VITDT1,VITDT2,Pool L,およびPool Hを用いて1日2回の測定を15日間繰り返し,そのCVを求めた。
5. 定量限界(limit of quantitation; LoQ)25(OH)D濃度が5.0 ng/mL未満の検体10件を5つに小分け凍結保存し,1日2回5日間測定を行った。
6. 希釈直線性凍結乾燥品の高濃度25(OH)D試料1種類を高値試料として用いた。希釈液にトータルビタミンD欠乏血清を使用して,高値試料を10段階希釈,二重測定を行って,その直線性を確認した。
7. 干渉物質の影響Pool LおよびPool Hに干渉物質として干渉チェック・Aプラス(シスメックス株式会社)及び干渉チェック・RFプラス(シスメックス株式会社)を添加して,その影響を確認した。測定はそれぞれ二重測定を行った。
8. 相関性対象検体122件についてElecsys,LIAISON,およびLUMIPULSEの各法で測定値を求め,そのうちいずれかの測定法でメーカーが示す測定感度以下を示した検体を除外した108件の測定データを用いて,その相関性を線形主軸回帰の回帰式および相関係数で確認した。また,ElecsysとLIAISONの相関において,回帰直線の95%信頼区間を外れた乖離検体を除いた107件でも同様に回帰式および相関係数を用いて相関性を確認した。
9. 乖離検体の解析ElecsysとLIAISONの相関において,回帰直線の95%信頼区間を大きく外れた検体が1件存在した。その検体を乖離検体として解析を行った。また,検討期間中にこの乖離検体と同一患者の検体があと2件存在したので,最初の乖離検体と併せて同じように解析を行った。
乖離検体の解析としてLC-MS/MSの測定値との比較を行った。LC-MS/MSでの測定は株式会社あすか製薬メディカルに外注委託した。なお,LC-MS/MSで測定を行った検体は乖離検体3件のうち,代表で2件を抽出した。対照検体としてElecsysで25(OH)Dが30 ng/mL程度を示した検体1件を使用した。
10. DBP測定DBPの測定にはHuman Vitamin D BP Quantikine ELISA Kit(R&D SYSTEMS)を使用し,マイクロプレートミキサーおよびマイクロプレートリーダーとしてinfinite F200Pro(Tecan)を使用した。
検体は事前にキットに付属の検体希釈液を用いて10,000倍希釈を行い,インキュベートの際には87.6 rpmで混和した。それ以外の操作および解析方法はELISA Kitの添付文書に従い,吸光度測定には主波長450 nm,副波長540 nmで測定した。
DBP測定に用いた検体は,乖離検体3件に加えて,乖離検体を除く相関性で使用した107件の中から14件を抽出し,合計17件を使用した。
11. 統計解析統計解析には日本臨床化学会のValidation-Support処理プログラム(V3.5)を使用した。
VITDT1,VITDT2,Pool L,およびPool HのCVはそれぞれ4.91%,2.49%,5.39%,および2.38%となった(Table 1)。CV以外の統計値は表に示した通りである。
| VITDT1 | VITDT2 | Pool L | Pool H | |
|---|---|---|---|---|
| Max (ng/mL) | 10.7 | 23.9 | 11.9 | 26 |
| Mean (ng/mL) | 10.01 | 22.74 | 10.29 | 24.6 |
| Min (ng/mL) | 8.7 | 21.6 | 9.52 | 23.7 |
| SD (ng/mL) | 0.49 | 0.57 | 0.55 | 0.59 |
| CV (%) | 4.91 | 2.49 | 5.39 | 2.38 |
VITDT1,VITDT2,Pool L,およびPool HのCVはそれぞれ10.59%,4.07%,8.21%,および4.07%となった(Table 2)。CV以外の統計値は表に示した通りである。
| VITDT1 | VITDT2 | Pool L | Pool H | |
|---|---|---|---|---|
| Max (ng/mL) | 12.2 | 26.3 | 10.2 | 25.4 |
| Mean (ng/mL) | 10.52 | 24.31 | 9.25 | 23.78 |
| Min (ng/mL) | 8.27 | 22.2 | 7.59 | 22.1 |
| SD (ng/mL) | 0.96 | 0.79 | 0.36 | 0.64 |
| CV (%) | 10.59 | 4.07 | 8.21 | 4.07 |
精度プロファイル図を用いて算出したところ,許容限界CVを10%,および20%としたとき,それぞれLoQは6.80 ng/mL,および2.70ng/mLとなった(Figure 1)。

Ten samples with a 25(OH)D concentration of less than 5.0 ng/mL were aliquoted into five and cryopreserved and measured twice a day for 5 days. Using the accuracy profile diagram, the concentrations at which the allowable limit CV was 10% and 20% were determined.
約43.5 ng/mLの凍結乾燥試料で10段階希釈を行って検定したところ,残差変動の分散と級内変動の分析比の有意確率は0.0884となり,凍結乾燥試料の濃度であった約43.5 ng/mLまで直線性があることが確認できた(Figure 2)。

One high-concentration 25(OH)D sample of the lyophilized product was used as a high value sample. Using total vitamin D deficient serum as a diluent, high value sample was diluted in 10 steps and duplicate measurement were made to confirm linearity.
遊離型ビリルビンは19.1 mg/dLまで,抱合型ビリルビンは21.2 mg/dLまで,溶血ヘモグロビンは490 mg/dLまで,乳びは1,610ホルマジン濁度まで,リウマトイド因子は500 IU/mLまで10%を超える変動は認められなかった(Figure 3)。

Interfering substances were added to Pool L and Pool H, and the effects were confirmed. Each measurement was performed in duplicate.
108件の全例で相関性を検討した結果では,Elecsys とLIAISONで回帰式y = 0.95x + 0.93,相関係数r = 0.90(Figure 4A),Elecsys とLUMIPULSEで回帰式y = 0.93x + 3.51,相関係数r = 0.96(Figure 4B)となった。Elecsysと LIAISONの相関において,回帰直線の95%信頼区間を大きく外れた検体が1件存在した。Elecsysと LIAISONの相関性において回帰直線の95%信頼区間を外れた1件の乖離検体を除いた107件で相関性を確認したところ,ElecsysとLIAISONでは回帰式y = 0.87x + 2.14,相関係数r = 0.94(Figure 4C),Elecsys とLUMIPULSEでは回帰式y = 0.85x + 4.46,相関係数r = 0.97(Figure 4D)となった。
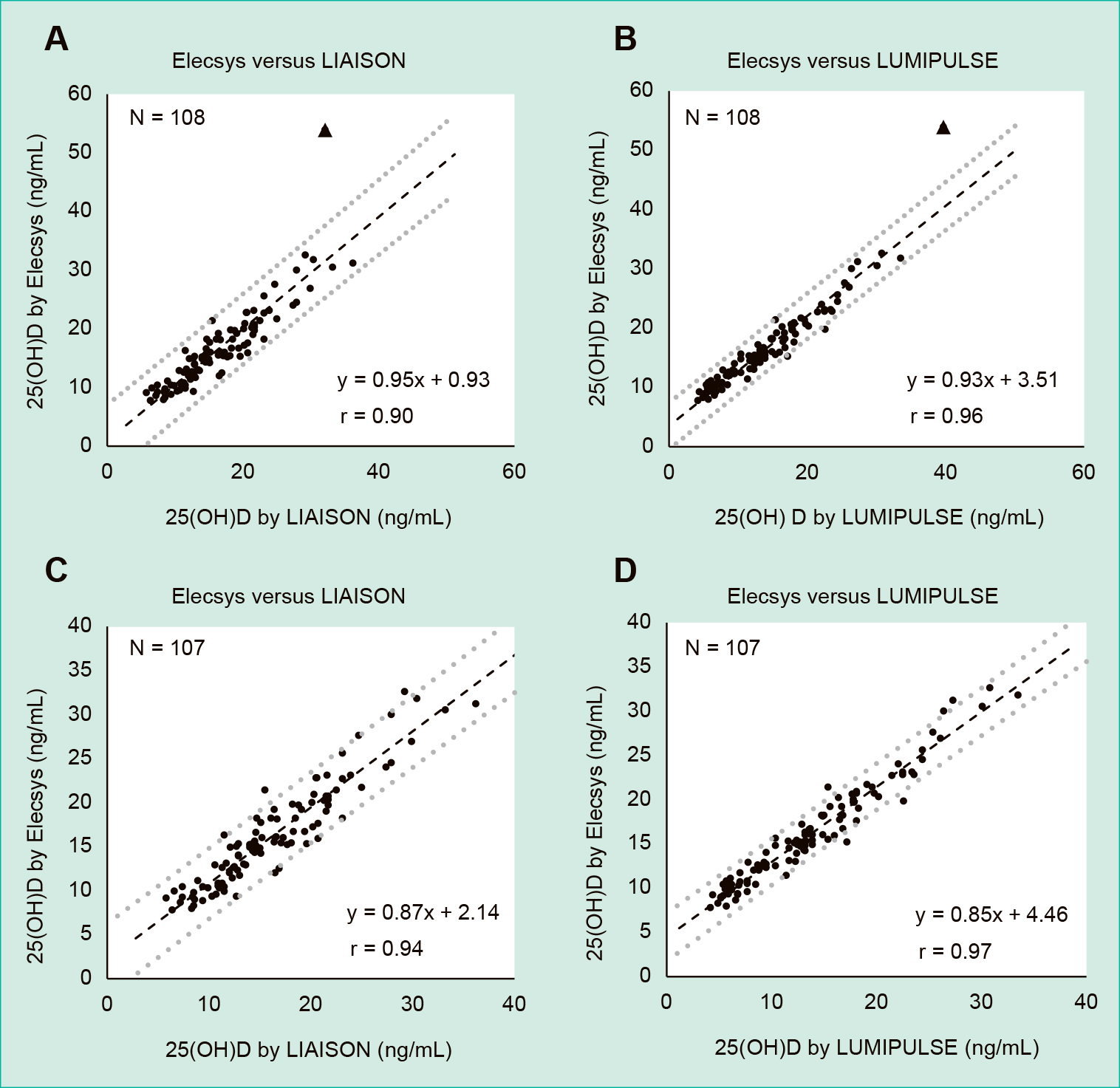
The Elecsys, LIAISON, and LUMIPULSE methods obtained measurements on 122 specimens. A and B: Correlation was confirmed using a regression equation and a correlation coefficient on 108 measurement data, excluding samples that showed measurement sensitivity or lower in either measurement method. C and D: Correlations was confirmed using the regression equation and the correlation coefficient in 107 cases excluding the dissociation samples, similarly. Dotted lines are 95% confidence interval.
乖離検体のうちLC-MS/MS法で測定を行った2件については,LIAISONの測定値はLC-MS/MS法の測定値に比べて20%以上低値,LUMIPULSEの測定値はLC-MS/MSの測定値に比べて10%以上低値,Elecsysの測定値はLC-MS/MSの測定値に比べて10%程度高値を示した(Table 3)。対照検体は各検査法のLC-MS/MSとの差は10%以内に収まった。
| LC-MS/MS (ng/mL) | LIAISON (ng/mL) | LUMIPULSE (ng/mL) | Elecsys (ng/mL) | [LIAISON]/ [LC-MS/MS] |
[LUMIPULSE]/ [LC-MS/MS] |
[Elecsys]/ [LC-MS/MS] |
|
|---|---|---|---|---|---|---|---|
| Deviation specimen 1 | 47.81 | 32.1 | 39.7 | 53.9 | 0.671 | 0.830 | 1.127 |
| Deviation specimen 2 | 35.91 | 26.4 | 31.1 | 40 | 0.735 | 0.866 | 1.114 |
| Control specimen | 31.96 | 29.2 | 30.8 | 32.6 | 0.914 | 0.964 | 1.020 |
乖離検体3件を除く14件のDBP測定値は287.06~815.98 μg/mL(中央値580.875 μg/mL)であった。また,乖離検体3件の測定値はそれぞれ1,084.95,862.65,1,380.04 μg/mLであり,今回の測定の中では最も高い値を示した。またLIAISONを基準としたElecsysもしくはLUMIPULSEとの比(以下,それぞれElecsys/LIAISON,LUMIPULSE/LIAISON)と,DBP測定値との相関性を検討したところ,Elecsys/LIAISONでr = 0.64,LUMIPULSE/LIAISONでr = 0.51といずれもやや正の相関性が認められた(Figure 5)。

DBP was measured using ELISA. Three dissociation samples and 14 cases from 107 cases used for correlation were extracted as samples used for DBP measurement.
併行精度および室内精度においては,CVが最大で10.59%であり,浜口ら7)が報告している最大CV 5.8%よりも大きくなった。室内精度の検討は,浜口ら7)の検討では10日間二重測定であるのに対して,本検討では15日間二重測定である。試しに10日目までのCVを算出したところ,VITDT1は7.9%,Pool Lは7.5%と浜口らの報告値に近づき良好な再現性が確認できた。また,15日間の測定値はいずれの測定試料においても経時的に下降傾向が認められた。これらのことから,本検討の室内精度の結果は試薬のオンボード安定性の影響を強く受けたものと推測される。試薬添付書上ではオンボード28日間は安定であるとされているが,実際の日常運用に耐えうる安定性を有しているのか追加で検討する必要があるものと考えられた。また,LoQにおいても,許容限界CVを20%としたとき,試薬添付書上の5 ng/mLを十分に下回る2.70 ng/mLとなっており,良好な性能を発揮していると考えられた。希釈直線性については,試薬添付書上は100 ng/mLまで測定可能と表記されている。しかし,高濃度検体を入手することが困難であったため,今回の検討では凍結乾燥試料を用いて43.5 ng/mLまで直線性を確認したが,検討可能な範囲では良好な直線性が確認できた。干渉物質についても,遊離型ビリルビン,抱合型ビリルビン,溶血ヘモグロビン,乳び,およびリウマトイド因子のいずれにおいても,25(OH)D測定には影響がないものと考えられた。
今回検討したElecsys,LIAISON,およびLUMIPULSEの相関性については,いずれの方法を比較しても非常に高い相関性が認められた。しかしその中でElecsysとLIAISONの相関において,回帰直線の95%信頼区間を大きく外れた検体が1件存在した。この乖離検体と同一患者の検体が検討期間中あと2件発生したため,その検体を含む合計3件の乖離検体について詳細な解析を行った。いずれの乖離検体においてもLIAISONと比較してElecsysが高値となるような乖離パターンを示したことから,検体由来の何らかの因子による影響が存在するものと示唆された。浜口ら7)はこれまでにElecsysがLIAISONと比較して低値を示すような乖離事例を報告しているが,この原因はビタミンDの代謝物質に対する交差反応性の違いによるものではないかと推測されている。Heijboerら8)は血清中の25(OH)DをDBPから遊離する原理の違いなどにより,血清中のDBPが高濃度であると測定法によってはすべての25(OH)Dが抽出できず,ID-XLC-MS/MSの測定値よりも低値となることがあるが,ElecsysではDBPが高濃度であってもID-XLC-MS/MSと同等の結果が得られたとしている。本検討で発生した乖離検体でもLIAISONはLC-MS/MSに比べて20%以上低値を,LUMIPULSEはLC-MS/MSに比べて15%程度低値を示していたが,ElecsysではLC-MS/MSに比べて10%程度高値を示しただけであり,高濃度のDBPが検体中に含まれている可能性が示唆された。そこで,ELISAを用いてDBP濃度を測定したところ,乖離検体のDBP濃度は1,000 μg/mL前後であり,ELISAキットの添付書で示されている参考基準範囲168~367 μg/mLと比べても非常に高値を示した。このことからも今回の高濃度乖離検体はDBP高値が原因であったと推測される。また,Elecsys/LIAISONとDBPの相関性においても,r = 0.64の正の相関性が認められ,DBPがLIAISONの測定値に負の影響を与えている可能性を裏付ける結果となった。LUMIPULSE/LIAISONとDBPの相関性においては,r = 0.51と正の相関性が認められたが,Elecsys/LIAISONとDBPの相関係数より0に近い値であったことから,LUMIPULSEはLIAISONよりDBPの影響を受けにくいが,ElecsysよりDBPの影響を受けやすいと推測できる。Elecsysの前処理液に含まれているジチオスレイトールは不可逆的にDBPを変性させる強い条件で25(OH)Dを遊離させており,そのことによって最もLC-MS/MSと近い測定値が求められたものと考えられる。
DBPは,血清α2グロブリンの一部として発見され,“group-specific component(Gc-globulin)”と呼ばれていたが,その後ビタミンDと結合することからDBPと呼ばれるようになった9)。また,DBPは4番染色体長腕に存在するGC遺伝子にコードされており,アルブミン,αフェトプロテイン,およびαアルブミンなどと共にアルブミンスーパーファミリーに属している10)~12)。そしてそのGC遺伝子には多くの遺伝子多型が存在しており,それによってDBPにも等電点電気泳動による移動度の違いで区別される蛋白質多型が120余り知られている13)。その中でも,Gc1S,Gc1F,およびGc2がDBP多型の大部分を占めている14),15)。GC遺伝子多型とビタミンD代謝との関連性が従来から指摘されており,25(OH)Dと1,25(OH)2Dの親和性は,高いほうからGc1F > Gc1S > Gc2であるとされている16)。このようなDBPの性質から,DBPの表現型による機能の違いが血中25(OH)Dの濃度を規定する独立した因子であることが報告されている17)~19)。本研究で遭遇した乖離症例も,このDBP多型の影響を受けている可能性が示唆されるが,詳細な解析を行うことが困難であった。また,DBPはエストロゲンが多い妊娠中や1型糖尿病などで高値になることがあるとされているが20)~22),いずれも今回の乖離症例には当てはまらずDBPが高値であった原因についても不明である。
今回検討したエクルーシス試薬ビタミンDトータルIIは,日常検査に耐えうる十分な基礎的性能を確認することができた。DBPが高値の場合,LIAISONやLUMIPULSEと比較してElecsysで最もLC-MS/MSに近い測定値が得られた。
本論文に関連し,開示すべきCOI 状態にある企業等はありません。