2021 Volume 70 Issue 1 Pages 23-31
2021 Volume 70 Issue 1 Pages 23-31
背景:抗がん剤治療は分子標的薬や免疫チェックポイント阻害剤などの開発により選択肢が増えてきているが,その効果には個人差がある。今回我々は,大腸がんの予後および治療効果予測を目的として,CD-DSTによる抗がん剤感受性試験の有用性を検証した。方法:術後化学療法を実施した大腸がん症例71例を対象にCD-DSTを行い,病期分類別に高感受性群と低感受性群の全生存期間,生存期間中央値,2年生存率,5年生存率を比較した。また,6種類の大腸がん細胞株を対象にCD-DSTによるセツキシマブの薬剤感受性評価を行った。結果:II/III期の高感受性群の全生存期間は低感受性群より延長する傾向がみられた(p = 0.162)。さらにII/III期の高感受性群と低感受性群の生存期間中央値は8.6年と2.8年,5年生存率は63.6%と28.6%となり,他の病期よりも高感受性群の予後が良好となる傾向が強かった。大腸がん細胞株を用いたセツキシマブの効果予測の検証では,KRASやBRAFの変異がないcaco-2のみが高い感受性を示した。また,FOLFOXやFOLFIRIとセツキシマブの併用によって相加的な抗腫瘍効果が認められた。結論:CD-DSTはII/III期の大腸がん症例の予後およびセツキシマブ併用化学療法の治療効果予測に有用と考えられた。
Background: The number of anticancer drug treatments has increased with the development of molecularly targeted drugs and immune checkpoint inhibitors. However, there are individual differences in the therapeutic effects of these anticancer drugs. In this study, we investigated the usefulness of CD-DST for predicting the prognosis and treatment response in colorectal cancer. Methods: We performed CD-DST in 71 colorectal cancer patients treated with postoperative chemotherapy. We then compared overall survival, median survival, two-year survival, and five-year survival between the high- and low-sensitivity groups for each pathological stage. We also evaluated the sensitivity of six different colorectal cancer cell lines to the drug cetuximab by CD-DST. Results: The overall survival of the high-sensitivity group in stage II/III tended to be longer than that of the low-sensitivity group (p = 0.162). In addition, the median survival in stage II/III was 8.6 years in the high-sensitivity group and 2.8 years in the low-sensitivity group, and the five-year survival rates were 63.6% in the high-sensitivity group and 28.6% in the low-sensitivity group. The prognosis of the high-sensitivity group tended to be better in stage II/III than in the other stages. Furthermore, a validation test of the predicted effect of cetuximab on colorectal cancer cell lines showed that only Caco-2 cells without KRAS or BRAF mutations were highly sensitive. The combination of FOLFOX or FOLFIRI with cetuximab resulted in an additive antitumor effect. Conclusions: CD-DST appears to be useful in predicting the prognosis of patients with stage II/III colorectal cancer and the effect of cetuximab combination chemotherapy.
抗がん剤治療は新薬の開発により選択肢が増えてきているが,その効果には個人差があり,実際に治療を行ってみないと分からないことも多い。また同一患者であっても,抗がん剤に対する感受性が治療の過程で変化することが知られている1)。治療開始前に,効果が期待できる抗がん剤と効果が低いと思われる薬剤が予測できると,治療成績の向上や患者の身体的および経済的負担の軽減につながることが期待される。
分子生物学の進歩により,がん細胞の増殖に関与する遺伝子やタンパク質を標的とする分子標的薬やがん細胞による免疫抑制シグナル伝達を阻害する免疫チェックポイント阻害剤が開発されている。これら薬剤は作用機序に基づいたバイオマーカーを指標として,効果の見込める患者を抽出する。さらに近年,次世代シークエンサーで多くの遺伝子変異を網羅的に解析し,患者一人ひとりのがんの個性を明らかにすることで,より効果的な抗がん剤治療を行うがんゲノム医療が急速に普及している。しかし,保険診療でがんゲノム医療を受けられるのは,厳しい要件を満たした一部の患者のみであり,実際にその結果に基づいた治療が行われる患者は全体の1~2割程度である2)。従って,多くの患者は従来型の化学療法が第1選択となっているのが現状である。
一方,細胞培養技術を基盤に,5-フルオロウラシル(5-FU)やドセタキセルといった従来型化学療法の治療効果を予測する試みは比較的歴史が古く,中でも1990年代に開発されたCD-DST(collagen gel droplet embedded culture drug sensitivity test)とHDRA(histoculture drug response assay)は2012年より臨床検査として保険収載されている。しかし,CD-DST実施報告は欧文および和文論文を合わせて200件ほどにとどまっている。そのような中,市立函館病院(以下,当院)ではCD-DSTを2006年から開始し,2019年までに大腸がんや胃がん症例を中心に約500例の検査を実施してきた。当院は本邦で数少ないCD-DST実施施設の1つであり,本検査結果と実際の治療効果について検証する意義は大きい。今回我々は,これまでCD-DSTを行った症例の中から,術後化学療法を実施して5年以上経過した大腸がん症例を対象にCD-DSTの有用性を検証した。加えて,CD-DST開発当初想定されていなかった分子標的薬への応用について,大腸がん細胞株を用いた検討を行ったので併せて報告する。
2006年7月から2014年4月までに当院消化器外科で腫瘍摘出術を施行し,CD-DSTおよび術後化学療法を実施した大腸がん症例83例中,細胞増殖不良による判定不能例を除いた71例を対象とした。本症例をUICCのTNM分類に基づく術後病理学的ステージで分類した内訳は,II期6例(平均56.3歳:40~72歳),III期12例(平均64.8歳:39~75歳),IV期38例(平均64.0歳:29~81歳),加えて転移・再発25例(平均65.6歳:33~82歳)であった。なお,II期の症例は予防投与として化学療法が行われた。
2. 試薬CD-DSTの実施には,ヒト癌細胞初代培養システムキット「Primaster®」(クラボウ)を使用した。本キットには細胞分散酵素EZ,コラーゲンゲルコーティングフラスコ(CGフラスコ),予備培養用培地PCM-1,コラーゲンゲルドロップ培養キット,無血清培地PCM-2,ニュートラルレッド溶液が含まれている。基礎培地のDF培地(DMEM/F-12)はGibcoから購入し,DF(+)培地はDF培地にウシ胎仔血清(FBS:Gibco)を10%の割合で添加した。生理食塩液は光製薬,コラゲナーゼはSigma-Aldrichから購入した。EGTA-トリプシン溶液は,190 mgのEGTA(Nacalai tesque),150 mgトリプシン(富士フイルム和光純薬)をハンクス液(−)(Gibco)500 mLに溶解し,0.2 μmのフィルターで濾過滅菌した。PCM-1,PCM-2,DF,DF(+)培地および生理食塩液には,0.5 mg/mLのピペラシリンナトリウム(ペントシリン:富山化学工業),0.25 mg/mLのカナマイシン硫酸塩(硫酸カナマイシン:Meiji Seikaファルマ),10 μg/mLバンコマイシン塩酸塩(塩酸バンコマイシン:小林化工),1.25 μg/mLアンホテリシンB(アムビゾーム:大日本住友製薬)を添加した。抗がん剤はフルオロウラシル(5-FU:協和発酵キリン),イリノテカン活性代謝物(SN-38:富士フイルム和光純薬),オキサリプラチン(エルプラット:ヤクルト),セツキシマブ(アービダックス:メルクバイオファーマ)を使用した。
3. CD-DSTによる抗腫瘍効果判定CD-DSTは組織片からの細胞分散,がん細胞の選択的回収を目的とした予備培養,コラーゲンドロップによる三次元細胞培養,画像解析による抗腫瘍効果判定の工程から構成される(Figure 1)。
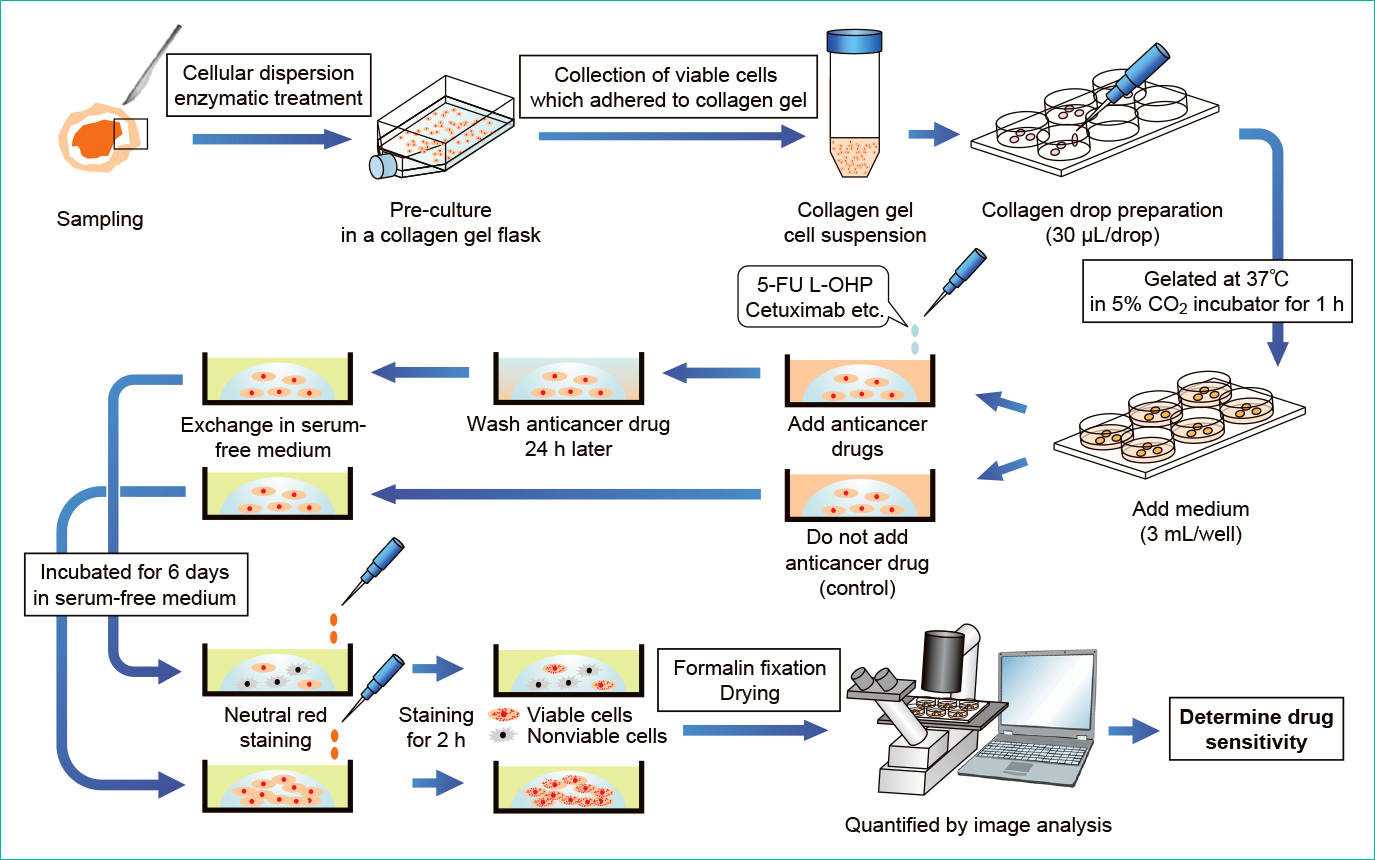
CD-DST predicts the effects of anticancer drugs by culturing a portion of surgically removed cancer cells in vitro and exposing them to various anticancer drugs.
はじめに手術等で摘出した結腸直腸がん組織から,壊死や潰瘍部を避けて腫瘍部分を約1 cm角に数ヶ所切除し,抗生剤を含む生理食塩水で洗浄後,DF(+)に浸漬させて4℃で一晩保管した。翌日,腫瘍組織片をメスで細切した後,細胞分散酵素EZおよびEGTA-トリプシンで順次処理し,組織片を十~数十個程度の細胞で構成される細胞集塊に分散した。
2) 予備培養分散した細胞をPCM-1培地に再懸濁し,CGフラスコに播種した後,37℃・5%CO2で24時間予備培養を行った。予備培養後,CGフラスコをコラゲナーゼで処理し,コラーゲンゲルに付着した腫瘍細胞を選択的に回収した。
3) 三次元培養回収した腫瘍細胞を再度EGTA-トリプシンで処理し,125 μmのフィルターで濾過した後,最終濃度が5 × 104~2 × 105 cells/mLとなるようにコラーゲンゲルに懸濁した。調整したコラーゲンゲル細胞浮遊液を6ウェルシャーレの各ウェルに30 μLずつ3ヶ所滴下し,37℃・5% CO2で1時間静置してゲル化させ,DF(+)を加えて24時間培養を続けた。翌日,所定の条件(Table 1)で抗がん剤を添加し,その後DF(−)にて抗がん剤を洗浄・除去した。次いで,ウェルに無血清培地のPCM-2を添加し,培養3日目に培地交換を行い,合計6日間無血清培養を継続した。
| Anticancer drugs | Exposure conditions | |
|---|---|---|
| 5-FU | 1.0 μg/mL/24 hr. | |
| CPT-11 | 0.03 μg/mL/24 hr. | |
| FOLFOX | 5-FU/LV L-OHP |
5.0 μg/mL/24 hr. (as 5-FU) 0.6 μg/mL/24 hr. |
| FOLFIRI | 5-FU/LV CPT-11 |
5.0 μg/mL/24 hr. (as 5-FU) 0.03 μg/mL/24 hr. |
培養終了後,各ウェルにニュートラルレッド(最終濃度:50 μg/mL)を添加し,37℃・5%CO2で2時間振盪したのち,10%中性緩衝ホルマリンで40分間固定した。固定後,水洗・風乾してコラーゲンドロップを平坦化し,画像解析装置(VH-5910: Keyence)にて比色定量を行った。抗腫瘍効果はMekataらの報告10)に従い,抗がん剤処理群と抗がん剤非処理群の相対増殖率「T/C(%)」が60%未満の場合を高感受性,60%以上となった場合を低感受性と判定した。
4. CD-DSTによる予後および治療効果予測1つ以上の抗がん剤が高感受性判定となった症例を高感受性群,全ての抗がん剤が低感受性となった症例を低感受性群として,症例全体および病期別の全生存期間,生存期間中央値,2年生存率,5年生存率を比較した。なお,IIおよびIII期については,症例数が少ないため,両者を合わせて1つの病態グループとして解析した。
さらに,術後の残存もしくは再発腫瘍に対する治療効果判定が可能であった71例中51例を対象として,CD-DSTの判定と初回治療時の効果を比較し,感度,特異度,真陽性率,真陰性率を検証した。治療効果はPR以上の判定となった症例を効果ありとした。なお,本検討の対象とした51例中5例(IV期2例,転移・再発3例)は術前化学療法が行われていた。
5. 分子標的薬セツキシマブの効果予測KRASおよびBRAF statusが明かな6種類のATCC(American Type Culture Collection)ヒト大腸がん細胞株(野生型:Caco-2,KRAS変異株:DLD-1・HCT116・SW620,BRAF変異株:WiDr・Colo205)を対象に,①セツキシマブ単剤,②セツキシマブ+FOLFOX(5-FU/LV + L-OHP),③セツキシマブ+FOLFIRI(5-FU/LV + CPT-11)のCD-DSTによる薬剤感受性評価を行った。セツキシマブの接触条件はインタビューフォームで公表されている単回投与時のAUCを参考に250 μg/mL/120 hr.とした。また,セツキシマブ単剤では2,10,50,1,250 μg/mLにおける評価も行い,セツキシマブと化学療法の併用を想定した条件では,FOLFOXあるいはFOLFIRI処理後にセツキシマブと接触させた。
6. 統計処理統計解析ソフトウェア「EZR」(自治医科大学附属さいたま医療センター・血液科)を用い,Kaplan-Meier法(Log-rank検定)にて解析した3)。
7. 倫理委員会本研究はCD-DSTを先進医療として実施していた2011年までは全例個別に同意を取得し,保険診療となった2012年以降についてはオプトアウトを適用することで,後ろ向きに市立函館病院倫理委員会の承認を受け実施した(迅2020-1)。
CD-DSTの高感受性群と低感受性群における全生存期間の比較では,いずれの病期においても両者に有意差を認めなかった。しかし,II/III期では高感受性群の全生存期間が低感受性群より延長する傾向がみられた(p = 0.162)。さらにII/III期の高感受性群と低感受性群の生存期間中央値は8.6年と2.8年,5年生存率は63.6%と28.6%となり,他の病期よりも高感受性群の予後が良好となる傾向が強かった。また,IV期や転移・再発例の高感受性群と低感受性群の生存曲線は類似するグラフを描いたが,術後1~3年に着目すると,高感受性群の生存率が低感受性群より2~3割程度高かった(Figure 2)。

The high-sensitive group in stage II/III tended to have better overall survival, median survival, and 5-year survival than the low-sensitive group.
CD-DST判定と残存腫瘍病変に対する初回治療時の効果比較では,病期によって多少幅を認めるが,症例全体としては感度86.7%,特異度47.2%,陽性適中率40.6%,陰性適中率89.5%であった(Table 2)。
| Sensitivity (%) | Specificity (%) | PPV (%) | NPV (%) | |
|---|---|---|---|---|
| All cases (n = 51) | 86.7 | 47.2 | 40.6 | 89.5 |
| Stage II/III (n = 7) | DZ | 57.1 | 0.0 | 100.0 |
| Stage IV (n = 33) | 84.6 | 40.0 | 47.8 | 80.0 |
| Metastasis/Recurrence (n = 11) | 100.0 | 55.6 | 33.3 | 100.0 |
PPV, positive predictive value; NPV, negative predictive value; DZ, division by zero.
caco-2は,セツキシマブ濃度に依存してT/C(%)が低下した。caco-2以外の大腸がん細胞株では,生体投与時の5倍量に相当する1,250 μg/mLにおいてもT/C(%)は最大79.9%までしか低下しなかった(Table 3)。
| colorectal cancer cell lines | cetuximab concertration (μg/mL) | FOLFOX | FOLFOX + cetuximab | FOLFIRI | FOLFIRI + cetximab | mutation | ||||
|---|---|---|---|---|---|---|---|---|---|---|
| 2 | 10 | 50 | 250 | 1,250 | ||||||
| caco-2 | 80.1 ± 2.1 | 80.6 ± 1.2 | 80.3 ± 1.4 | 59.5 ± 1.2 | 21.9 ± 0.5 | 9.4 ± 0.5 | 4.8 ± 0.1 | 10.3 ± 0.2 | 4.6 ± 0.4 | (−) |
| DLD-1 | 94.8 ± 0.3 | 97.8 ± 0.5 | 106.8 ± 2.5 | 98.6 ± 2.0 | 85.2 ± 0.6 | 78.8 ± 0.7 | 60.1 ± 0.8 | 32.5 ± 0.8 | 25.9 ± 0.4 | KRAS |
| HCT-116 | 92.4 ± 1.9 | 97 ± 0.5 | 94 ± 0.9 | 98.3 ± 0.6 | 81.3 ± 1.5 | 9.9 ± 0.2 | 13.6 ± 1.5 | 6.3 ± 0.1 | 8.1 ± 0.4 | KRAS |
| SW-620 | 99.1 ± 1.0 | 98.9 ± 0.9 | 97.4 ± 0.4 | 103.5 ± 2.4 | 79.9 ± 0.6 | 17.9 ± 0.4 | 11.1 ± 0.2 | 12.9 ± 0.4 | 11.1 ± 0.3 | KRAS |
| WiDr | 93.8 ± 2.7 | 99.1 ± 1.5 | 89.8 ± 2.0 | 81.2 ± 2.0 | 83.8 ± 1.3 | 23.6 ± 0.3 | 30.5 ± 0.7 | 21.3 ± 0.4 | 26.0 ± 0.2 | BRAF |
| colo-205 | 89.3 ± 0.4 | 87.2 ± 0.4 | 92.6 ± 4.6 | 87.2 ± 2.1 | 91.0 ± 1.0 | 65.3 ± 1.1 | 65.4 ± 0.5 | 59.1 ± 0.8 | 61.8 ± 1.5 | BRAF |
Data are presented as the mean ± standard error.
FOLFOX・FOLFIRIの単独条件のT/C(%)を基準としたセツキシマブ併用時のT/C(%)の変化率は,caco-2が48.9%・55.3%,DLD-1が23.8%・20.3%,SW620が38.0%・14.0%低下した。一方,HCT-116は37.3%・28.6%,WiDrは29.2%・22.1%増加し,colo-205は0.2%・4.6%と不変あるいは軽度増加した(Table 3)。
大腸がんは我が国の悪性新生物による主要死因の1つであり,平成30年の厚生労働省統計情報・白書では全悪性新生物死亡者の13.5%にあたる約5万人が命を落としている4)。老衰が脳血管疾患を抜いて日本人死因の第3位となった現在,高齢化が進行する社会的背景も考慮されるが,依然として大腸がんの死亡数は増加しており,さらなる治療戦略が求められている。
CD-DSTはコラーゲンゲルによる三次元細胞培養と画像解析による生細胞の定量化を組み合わせた検査法である5)~7)。コラーゲンは生体の細胞外マトリックスの主要成分であり,生体構造の維持,細胞間接着,情報伝達等において重要な役割を果たすことが知られ,その約90%がType Iコラーゲンである。CD-DSTはType Iコラーゲンを含んだゲル状培地に初代がん細胞を立体的に配置することで疑似体内環境を構築し,従来の単層培養では困難であった初代がん細胞の維持・増殖を可能とする。加えて,生理的活性濃度に近似した抗がん剤濃度で抗腫瘍効果を評価できることを特徴とし5),8),実臨床では,胃がん,大腸がん,肺がん,乳がん等,様々な悪性腫瘍に対して実施されている9)~13)。
今回我々は,CD-DSTの判定と大腸がん症例の予後との関連性について検証を行った。病期別にCD-DSTの高感受性群と低感受性群の全生存期間を比較したところ,いずれの病期においても両群に有意差を検出できなかった。しかし,両群の50%生存期間中央値に着目すると,IV期や転移・再発例ではその差が0.7年であったのに対し,II/III期では5.8年と大きく延長していた。また,5年後生存率の両郡の差は,IV期や転移・再発例で11.1%だったが,II/III期では35.0%の開きとなり,予後良好となる傾向が認めた。これら結果は,II/III期のCD-DST判定が予後予測因子となり得る可能性を示しており,Mekataらの報告10)と類似する結果であった。
腫瘍が浸潤・遠隔転移をするメカニズムは細胞接着装置の破綻14),上皮間葉転換による細胞遊走15),脈管侵入16),17)などによって引き起こされる。また近年,上皮間葉転換やがん幹細胞が,転移部の薬剤耐性に重要な役割を果たしていることが報告されている18),19)。そのため,IV期や転移・再発例では,原発部位の腫瘍細胞を用いたCD-DSTで高感受性と判定された症例であっても,遠隔転移部の腫瘍細胞は抗がん剤に抵抗性を示していた可能性が高い。これがIV期や転移・再発例の高感受性群において,治療が効果を示さなかった要因と考えられた。一方,2年後生存率に着目すると,高感受性群の方が低感受性群より2~3割高かった。解析数が少ないため,さらなる症例の蓄積が必要であるが,IV期や転移・再発例におけるCD-DSTの判定が術後数年間の病態の進行を反映する可能性を否定できない結果と思われた。
CD-DSTの判定と初回治療時の効果の比較では,感度および陰性適中率は症例全体で86.7%以上と高かったのに対し,特異度および陽性適中率は47.6%・40.6%と低かった。これは,CD-DSTで低感受性と判定した症例の多くは予測通り治療効果を認めなかったが,高感受性と判定した症例の半数は予測に反して治療効果を認めなかったことを示している。堀田らもSDI法による抗がん剤感受性試験で同様の傾向を報告しており20),本結果は細胞培養を基盤とした感受性評価の検査特性と考えられた。低感受性判定にも関わらず,治療効果を認めた症例は,感受性評価を行った抗がん剤とともに,血管新生阻害薬やセツキシマブなどの分子標的薬を併用した上乗せ効果が加わったためと考えられた。また,高感受性判定で治療効果を認めない症例については,腫瘍内不均一性が抗がん剤感受性に差異を生じさせる21)ことに加え,生体における抗がん剤の組織移行性22),23)や代謝24)の関与によって,抗腫瘍効果が減弱している可能性が示唆された。これらより,CD-DSTは効果が期待できる薬剤の選択ではなく,効果が期待できない薬剤を除外することに適しており,不要な治療による身体的負担や経済的負担の軽減に寄与することが期待された。実診療ではKRAS・BRAF変異解析,血中VEGF測定25),PD-L1タンパク発現やマイクロサテライト不安定性検査をCD-DSTと併行することで,セツキシマブ,血管新生阻害薬といった分子標的薬や免疫チェックポイント阻害剤の併用を視野に入れた精度の高い治療効果予測が可能になると思われた。
大腸がん細胞株を対象としたCD-DSTによるセツキシマブの抗腫瘍効果の検証では,KRASあるいはBRAFに変異を有する全ての大腸がん細胞株がセツキシマブに強い耐性を示し,生体外環境においてもセツキシマブの作用機序26)を反映する結果が得られた。これまでCD-DSTによるセツキシマブの評価は頭頚部がんで報告されているのみであり27),本結果はCD-DSTがKRASやBRAF変異を伴う大腸がんにも応用可能であることを初めて明らかにした。
さらに,FOLFOXあるいはFOLFIRIとセツキシマブの併用により,野生型のcaco-2では相加的な抗腫瘍効果の上乗せが認められた。また興味深いことに,KRAS変異を有するDLD-1およびSW-620は,原理的にセツキシマブの効果が見込めないにも関わらず,抗腫瘍効果の軽度上乗せを認めた。これは実診療でセツキシマブの適応外となるKRAS変異症例の中にも,抗腫瘍効果の上乗せが期待できる症例の混在を示唆しており,Modestら28)もAIO KRK-0306試験でその可能性を報告している。一方,DLD-1やSW-620と同様,KRASに変異を有するHCT-116やWiDrでは,セツキシマブ併用による抗腫瘍効果の上乗せ効果はみられず,むしろFOLFOXやFOLFIRI単独の方が高い抗腫瘍効果を示す傾向がみられた。このような抗腫瘍効果の差異はKRAS変異解析のみでは予測することが困難であり,実際の治療レジメンに近い環境で抗腫瘍効果の評価が可能なCD-DSTを組み合わせることによって,治療効果の予測精度を向上させることが可能になると思われた。
また,BRAF変異を有するWiDrやColo-205においてもセツキシマブの併用による抗腫瘍効果の上乗せ効果は認められなかった。BRAF変異は転移性大腸がんの約8%に認められるが29),2018年にBRAF遺伝子検査が保険適用となるまでは,BRAF変異を確認していない症例が大半と思われる。大腸がん症例の中にはKRASに変異がなく,BRAFのみに変異を有する症例も混在するため,KRAS変異のみを確認した症例にセツキシマブを使用しても期待した効果が得られない可能性があった。Tsujiら30)もJACCRO CC-05試験でBRAF変異がセツキシマブの効果に与える影響を指摘しており,本検討はこれら懸念を裏付ける結果といえた。
CD-DSTはFOLFOXやFOLFIRIをはじめ,分子標的薬のセツキシマブなど,実治療を想定した条件の薬剤感受性を総合的に評価することが可能であり,KRASやBRAF変異解析などのコンパニオン診断やがんゲノム医療と組み合わせることで,個々の患者の腫瘍特性に応じた効果的な治療計画の提案が可能になると思われた。
本研究では第1に術後化学療法を実施した大腸がん症例に対するCD-DSTの有用性を検証した。我々は先行研究10)が評価対象としたII/III期の症例に加え,IV期や転移・再発症例についても解析を行い,II/III期におけるCD-DSTの判定が他の病期と比較して,最も有効性の高い予後・治療効果予測因子となることを見出した。また,IV期や転移・再発例では,術後数年間の病態の進行を反映する指標となり得る可能性を示した。
第2に大腸がん細胞株を対象としたCD-DSTによるセツキシマブの感受性評価の検証では,CD-DSTがKRASやBRAF変異を反映した薬剤感受性を示すことを初めて報告した。加えて,FOLFOXやFOLFIRIとセツキシマブの併用では,KRAS変異解析とCD-DSTの組み合わせが,より精度の高い治療効果予測法となる可能性を示した。今後これら知見を元に,臨床大腸がんを対象とした検討も行っていく予定である。
本論文に関連し,開示すべきCOI 状態にある企業等はありません。