2022 Volume 71 Issue 1 Pages 37-44
2022 Volume 71 Issue 1 Pages 37-44
自己免疫性溶血性貧血(autoimmune hemolytic anemia; AIHA)は,赤血球膜上の抗原に対する自己抗体が後天的に産生され,溶血をきたす免疫性溶血性貧血の総称である。AIHAの診断においては,直接抗グロブリン試験(direct anti-globulin test; DAT,直接クームス試験)がゴールドスタンダードとされ,DATが陽性を示せば診断は比較的容易である。しかし,DATのみでは診断が困難なDAT陰性AIHAが存在し,このような症例の診断においては赤血球結合IgGの定量が有用である。赤血球結合IgGはRIA法等によって測定することが可能であるが,種々の問題により日常検査として導入することが困難である。そこで,我々は,フローサイトメトリーによる赤血球結合IgG測定法を検討した。赤血球結合IgG量を表す指標としてMFID(mean fluorescence intensity difference)を用い,日常検査としての導入を試みた。DAT陰性検体(健常者)におけるMFIDの基準範囲を検討し,AIHAの診断におけるその有用性を検証したので報告する。
Autoimmune hemolytic anemia (AIHA) is a disease in which red blood cells are damaged by autoantibodies that react with antigens on the red blood cell membrane causing hemolysis. The direct antiglobulin test (DAT) has become the gold standard for the diagnosis of AIHA, and if the result is positive, the diagnosis of AIHA is relatively easily established. However, some cases of AIHA show negative DAT results; therefore, diagnosis based on DAT results only is infeasible. Quantification of red blood cell-bound IgG (RBC-IgG) is useful in such cases. The RBC-IgG measurement has mainly been by the RIA method, but it is difficult to introduce it as a routine method owing to problems related to radioactivity. Considering this background, we studied a method of measuring RBC-IgG by flow cytometry and used the mean fluorescence intensity difference (MFID) as an indicator of RBC-IgG. For DAT-negative samples, we successfully set a reference range for MFID and confirmed its usefulness in the diagnosis of AIHA.
自己免疫性溶血性貧血(autoimmune hemolytic anemia; AIHA)は,赤血球膜上の抗原に対する自己抗体が後天的に産生され,抗原抗体反応により溶血をきたす免疫性溶血性貧血である。AIHAの診断は,溶血性貧血の診断基準を満たすことを確認した後,直接抗グロブリン試験(direct anti-globulin test; DAT,直接クームス試験)が陽性であることを確認し,同種免疫性溶血性貧血や薬剤起因性免疫性溶血性貧血などの他の疾患を除外することによって行われる1)。
このように,DATはAIHAの診断におけるゴールドスタンダードとなっており,DATが陽性であればAIHAの診断は比較的容易である。しかし,試験管法によるDAT(tube method-DAT; TM-DAT)は感度が低く,AIHAのうち3~10%の症例が陰性を呈するとされている1)。このような症例はDAT陰性AIHAと呼ばれ,診断が困難である。また,DATは定性試験であるため赤血球結合IgG量のわずかな変化を検出することができず,治療効果の判定には不適である。カラム法によるDAT(column agglutination method-DAT; CM-DAT)はTM-DATよりも高感度であり,洗浄操作を必要としないため低親和性自己抗体の検出も可能であるが,特殊な機器が必要であり,定性試験であることに変わりはない。
赤血球結合IgG量は,radioimmunoassay(RIA)法によって高感度で定量的に測定されてきた(RBC-IgG)。RBC-IgG量のカットオフ値が設定され,DAT陰性AIHAの診断における有用性が確認されている2)。ほかにも,フローサイトメトリーや補体結合試験,酵素免疫測定法などによる赤血球結合IgGの測定が試みられているが3)~6),依然としてスタンダードとなる方法は確立されていない。
そこで我々は,フローサイトメトリーを応用した赤血球結合IgG測定法の開発を試みた。本法は,被検赤血球膜上に結合した抗赤血球自己抗体と,蛍光色素で標識した抗ヒトIgG抗体を反応させ,反応後の赤血球の平均蛍光強度(mean fluorescence intensity; MFI)をフローサイトメーターで測定する方法である。赤血球結合IgG量を表す新たな指標を開発し,DAT陰性健常者を用いて暫定基準範囲の設定を試みた。さらに,AIHAの診断や治療効果の判定への有用性を検証した。
検体は,抗凝固剤としてEDTA-2Kを添加した全血を使用し,冷蔵保存した。DAT陰性健常者検体は,採血後CM-DATで陰性と判定した匿名化検体(n = 80)を使用した。患者検体は,自治医科大学より提供された匿名化検体(n = 29)を使用した。患者検体は自治医科大学にてRIA法によるRBC-IgG量の測定が行われた後,冷蔵条件にて当研究室へ輸送された。患者検体を,臨床症状と測定データから分類した(Table 1)。
| 分類 | 症例数 | 症例No. | 臨床診断 |
|---|---|---|---|
| DAT陽性AIHA検体 | 4 | P1~P4 | TM-DATが陽性のAIHA |
| PNH検体 | 4 | P5~P8 | 溶血性貧血があり,DATで補体成分が陽性のPNH(発作性夜間血色素尿症) |
| DAT陰性AIHA検体 | 9 | P9~P17 | TM-DATは陰性だが,CM-DATの結果やRIA法によるRBC-IgGの定量結果,臨床症状などからAIHAを疑う |
| その他の患者検体 | 11 | P18 | 溶血性貧血,骨髄異形成症候群 |
| P19 | 溶血性貧血,慢性腎臓病,陳旧性脳梗塞,大動脈弁狭窄症 | ||
| P20 | DAT陰性AIHA疑い,慢性骨髄性白血病慢性期,鉄欠乏性貧血 | ||
| P21 | 溶血性貧血,肝硬変,難治性腹水,食道静脈瘤治療後 | ||
| P22 | 溶血性貧血 | ||
| P23 | PNH疑い | ||
| P24 | 後天性TTP(血栓性血小板減少性紫斑病) | ||
| P25 | DAT陰性AIHA疑い,糸球体腎炎 | ||
| P26 | 溶血性貧血,高血圧症,心房細動,脂質異常症 | ||
| P27 | HS(遺伝性球状赤血球症)疑い | ||
| P28 | 推定診断不明 | ||
| 治療中の患者検体 | 1 | P29 | DAT陰性Evans症候群(DAT陰性AIHAと特発性血小板減少性紫斑病が合併した症例)と診断され,治療中 |
検体の冷蔵保存による影響については,健常者検体(n = 5)を使用し検討を行った(Figure 1)。後述するMFID(mean fluorescence intensity difference)は,Figure 1のとおり,採血後約 10 日までは比較的安定していたが,これまで当研究室で実施した他の検討の結果(未発表)を参考に,本研究では採血後7日以内に検査することとした。患者検体については,提供される量が少ないため保存条件の検討は行えていない。また,採血後当研究室に到着するまでの経過日数が不明であり採血後7日以上経過していた可能性がある。そのため,到着した当日または翌日に測定した。
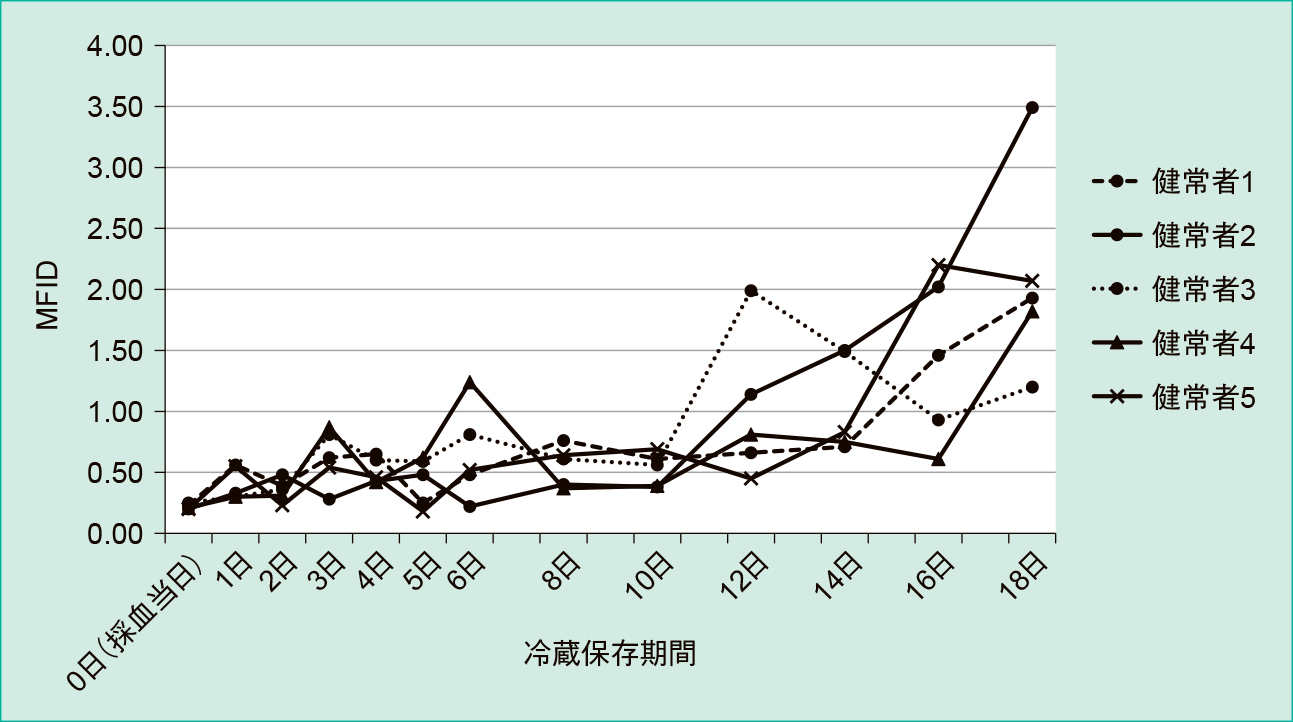
健常者4の場合,5日目と比べ6日目は2倍程度高くなっているが,8日目では元に戻っている結果であった。これは,抗原抗体反応や反応後の洗浄などの操作手技による変化と考えられる。この変化を除き,健常者すべての経日的変化は10日目までは若干の変動はあるものの大きく変動することは認められず安定しており,ほぼ同様な動きを示していることが分かる。なお,この基礎的データは症例測定よりも先行して検討を実施したため,症例検体を測定した時とは異なる蛍光標識抗体での測定結果である。
全血100~200 μLにphosphate buffered saline(PBS,pH 7.4,室温)1,000 μLを加え混和後,卓上マイクロ遠心機(KUBOTA,Model 3520,MA-2024ロータ使用)にて4℃の温度条件下で20,630 × g,10秒間遠心し,上清を除去した。この洗浄操作を2回繰り返した後,上清を完全に除去しPacked cellを調製した。Packed cellをオーソ® BioVue® O.A.E.S.(0.03 mol/L NaClグリシン等を含む低イオン強度リン酸緩衝液)で5倍希釈し,これをPacked cell希釈液とした。
2. 抗体の調製様々な抗体の使用経験から,検出感度の高いFITC(fluorescein isothiocyanate)標識抗ヒトIgG抗体novex® by Life technologiesTM Goat Anti-Human IgG (H+L) Antibody,Fluorescein(FITC)(invitrogen, 1.5 mg/dL)を使用することとした。このFITC標識抗ヒトIgG抗体は,サブクラスに関わらず全てのIgGと反応する。これを,オーソ® BioVue® O.A.E.S.にて10倍希釈し,使用した。
3. 抗原抗体反応Packed cell希釈液10 μLに蛍光標識抗体希釈液8.0 μLを添加し,37℃・遮光状態にて1時間反応させた[MFI(Ig+)]。赤血球は自家蛍光を発し,自家蛍光は検体ごとに異なるため,自家蛍光の影響を排除するためのコントロールとして蛍光標識抗体の代わりにオーソ® BioVue® O.A.E.S. 8.0 μLを加えたものも調整した[MFI(Ig−)]。
4. 測定用サンプルの調製反応後のサンプルに0.5% BSA加PBS(pH 7.4)1,000 μLを添加し混和後,卓上マイクロ遠心機にて4℃の温度条件下で20,630 × g,10秒間遠心し,上清に含まれる未反応の蛍光標識抗体を除去した。ここに0.5% BSA加PBS(pH 7.4)を1,000~1,500 μL添加して赤血球を再浮遊させた。これを測定用血球浮遊液とした。
5. フローサイトメトリー測定用血球浮遊液を,フローサイトメーター(MACSQuant Analyzer10 [Miltenyi Biotec])にて測定した。光源には波長488 nmのBlueレーザーを使用し,サンプルの前方散乱光(forward scatter; FSC),側方散乱光(side scatter; SSC),FITCの蛍光として波長525 nmの蛍光を検出した。FSC vs SSCサイトグラムにて赤血球の集団をゲーティングし,細胞が10万個に達するまでカウントを行い,そのMFIを測定した。
赤血球結合IgGに反応した蛍光標識抗体の蛍光強度を正確に評価するために,蛍光標識抗体と反応させた赤血球のMFI(Ig+)から,コントロールとして調製した赤血球のMFI(Ig−)を差し引いた値であるMFIDを算出した。MFI(Ig+)とMFI(Ig−)はそれぞれ5重測定行い,その平均値から算出したMFIDを赤血球結合IgG量を表す値とした(Figure 2, 3, 4)。
赤血球の自家蛍光のヒストグラムである。

赤血球に結合したFITCにより,MFI(Ig+)はMFI(Ig−)よりも高値側にシフトしている。
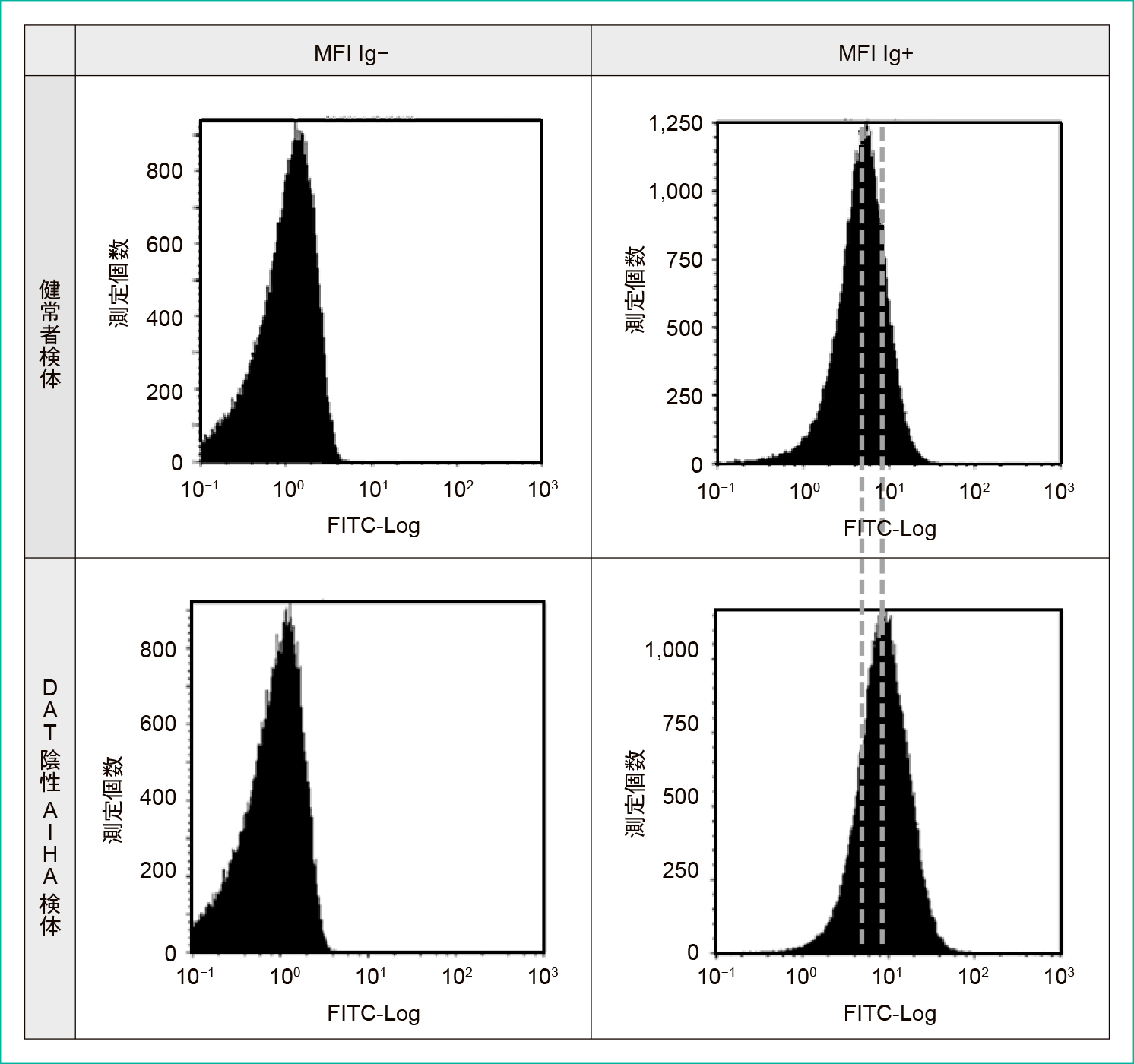
MFI(Ig+)は,DAT陰性AIHA症例では明らかに高値側にシフトしている。
使用する検体は全てフローサイトメトリーを行う日と同日に,カラム凝集法を利用した市販の製品であるオーソ®バイオビューTMクームス カセット(オーソ・クリニカル・ダイアグノスティックス株式会社)にて直接抗グロブリン試験(CM-DAT)を実施した。操作はオーソ®バイオビューTMクームス カセットの添付文書に従って行い,目視により凝集強度を判定した。
なお,自治医科大学での検体の保存条件やDATおよびRBC-IgG量の測定方法に関しては,参考文献を参照されたい7)。また,自治医科大学で測定されたRBC-IgG量のカットオフ値は78.5(IgG分子/RBC)とした2)。
80検体のMFIDの平均値は6.15,最大値は9.69,最小値は1.80であった。度数分布図と正規確率プロットから,健常者検体におけるMFIDは正規分布する傾向にあることが確認された(Figure 5, 6)。今回検討した検体数が80検体と少ないことから,分布の95%信頼区間を暫定基準範囲とすることとした。95%信頼区間は2.59~9.72となるが,MFIDの低値に意義は無いと考え,暫定基準範囲は9.72以下とした。
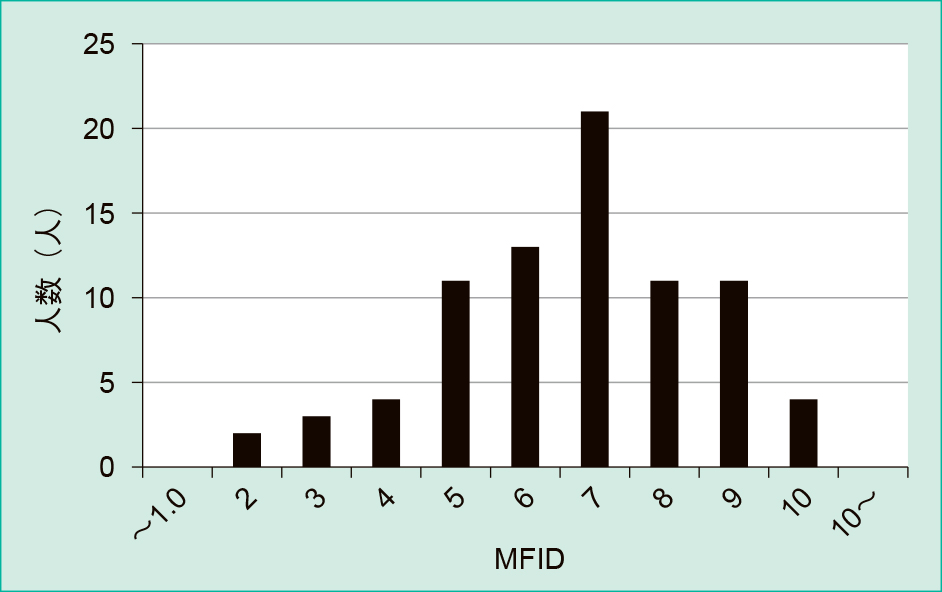
正規分布を示す傾向である。

Figure 5と同様に,健常者検体におけるMFIDは,正規分布する傾向が示唆される。
患者検体の測定結果を(Table 2)に示す。DAT陽性AIHA検体の全てが暫定基準範囲を超えるMFIDを示した。一方で,全てのPNH症例のMFIDは暫定基準範囲内となった。RBC-IgG量は症例P7を除いて低値であるため妥当な結果であると考えられるが,P7はカットオフ値を超えており,結果の乖離が生じた。
| 症例No. | 性別 | 自治医科大学データ | 当研究室データ | ||||
|---|---|---|---|---|---|---|---|
| TM-DAT | CM-DAT (IgG) |
RBC-IgG (IgG分子/RBC) |
CM-DAT (IgG, C3b, C3d) |
MFID | |||
| DAT陽性AIHA | P1 | M | ± | ± | 80 | ± | 13.05 |
| P2 | F | ± | 3+ | 80 | 2+ | 40.01 | |
| P3 | F | ± | 1+ | 474 | 1+ | 21.99 | |
| P4 | M | ± | 2+ | 121 | 2+ | 18.24 | |
| PNH | P5 | F | 2+(補体) | ― | 13 | 1+ | 5.82 |
| P6 | F | ±(補体) | 0 | 31 | 0 | 8.30 | |
| P7 | F | ±(補体) | 0 | 185 | ± | 8.58 | |
| P8 | F | ±(補体) | 0 | 15 | ± | 4.82 | |
| DAT陰性AIHA | P9 | F | 0 | ± | 58 | 1+ | 9.75 |
| P10 | F | 0 | 2+ | 24 | 0 | 33.43 | |
| P11 | F | 0 | 1+ | 40 | 0 | 16.01 | |
| P12 | F | 0 | 0 | 156 | ± | 62.82 | |
| P13 | M | 0 | 0 | 340 | 0 | 19.27 | |
| P14 | F | 0 | 1+ | 262 | 1+ | 11.51 | |
| P15 | F | 0 | 1+ | 36 | ± | 7.43 | |
| P16 | F | 0 | 1+ | 62 | 0 | 8.19 | |
| P17 | M | 0 | 1+ | 49 | ± | 19.71 | |
| その他 | P18 | M | 0 | 0 | 29 | 0 | 11.95 |
| P19 | F | 0 | 0 | 44 | 0 | 9.50 | |
| P20 | F | 0 | 0 | 42 | 0 | 11.73 | |
| P21 | M | 0 | 0 | 20 | 0 | 24.92 | |
| P22 | F | 0 | 0 | 50 | 0 | 13.47 | |
| P23 | F | 0 | 0 | 21 | 1+ | 4.92 | |
| P24 | F | 0 | 0 | 12 | 0 | 7.49 | |
| P25 | F | 0 | 0 | 33 | 0 | 16.76 | |
| P26 | M | 0 | 0 | 30 | 0 | 11.64 | |
| P27 | M | 0 | 0 | 3 | 0 | 4.71 | |
| P28 | F | 0 | ? | ― | 3+ | 22.08 | |
| 治療中 | P29 | M | 0 | 0 | 69 | 0 | 12.88 |
【基準範囲】TM-DAT:0.CM-DAT:0,RBC-IgG:78.5未満(カットオフ値),MFID:9.72以下(暫定基準範囲)
DAT陰性AIHA症例に関しては,多くの症例が暫定基準範囲を超えるMFIDを示した。MFIDが暫定基準範囲内となった症例(P15, P16)のRBC-IgG量はカットオフ値以下であり,一見妥当な結果のようにも思えるが,CM-DATでは陽性となっており結果の乖離が生じた。また,TM-DATは全ての症例で陰性となっているが,CM-DATでは陽性を呈する症例が多かった。
その他の症例のほとんどが暫定基準範囲を超えるMFIDを示した。AIHAよりもPNH,TTP,HSがより強く疑われる症例(P23, P24, P27)のMFIDは,いずれも暫定基準範囲内となった。依頼元における推定診断は不明だが,CM-DATが陽性となった症例P28のMFIDは,暫定基準範囲を超えていた。治療中のDAT陰性Evans症候群患者検体P29は,CM-DATは陰性であったが,MFIDは暫定基準範囲を超えていた。RBC-IgG量はカットオフ値以下ではあるが,やや高めの値であった。
DAT陽性AIHA症例の全てが,暫定基準範囲を超えるMFIDを示した。RBC-IgG量も全ての症例がカットオフ値を超えており,妥当な結果だと言える。このことから,AIHAの診断におけるMFIDの暫定基準範囲の有用性が示唆された。
DATは陽性だが補体成分のみが検出されているPNH症例では,全ての検体が暫定基準範囲内であり,PNHの除外にも有用であると考えられる。症例P7のMFIDは暫定基準範囲内,RBC-IgG量はカットオフ値以上であり結果の乖離が生じたが,その原因は不明である。PNH症例は冷蔵保存によりRBC-IgG量が漸増する場合があると報告されており2),このような現象と関係している可能性も考えられる。
DAT陰性AIHA検体においては,多くの検体で暫定基準範囲を超えるMFIDが得られ,DAT陰性AIHAの診断の有用性が示唆された.MFIDが暫定基準範囲内となった症例はRBC-IgG量もカットオフ値以下であった。しかし,CM-DATが陽性となる場合があり,結果の乖離が生じた。原因としては,CM-DATでは赤血球の洗浄操作を必要としないため低親和性抗体が接着され検出可能であったが,フローサイトメトリー法およびRIA法では,赤血球の洗浄操作による低親和性抗体の剥離やCM-DAT の交差反応の可能性が考えられる。また,TM-DAT 陰性であるが,CM-DATでは陽性を呈する症例が多く,CM-DATの方がTM-DATよりも高感度であることが確認された。
その他の症例に関して,MFIDは概ね暫定基準範囲以上を示したことから半数以上はDAT陰性AIHAである可能性が示唆された。溶血性貧血を呈するがAIHAよりもPNHやTTP,HSがより強く疑われる症例のMFIDはいずれも暫定基準範囲内であり,AIHAは否定的であると考えられる。PNHが疑われる症例P23のCM-DAT(1+)は補体によるものと考えられる。依頼元の推定診断不明な症例P28はCM-DAT(IgG, C3b, C3d)が陽性で,MFIDも暫定基準範囲を超えており,AIHAである可能性が示唆された。以上のように,DATのみでは診断が困難である症例に本法を適応することは,診断の一助となり得ることが示唆された。
症例P29の治療中症例では,CM-DATが陰性,RBC-IgG量もカットオフ値以下であるが,MFIDは暫定基準範囲を超えていた。この結果は,DATで検出できない程度の赤血球結合IgGが存在する状態と考えられる。このような症例数を増やし,MFIDの測定を加え検査項目間の検証を行うことで,治療効果の指標としての可能性を期待したい。
MFIDとRBC-IgG量はともに赤血球膜上に結合したIgG量を表すため,両者は相関関係にあると予測したが,今回の測定結果では明らかな相関関係は認めなかった。原因として,フローサイトメトリー法とRIA法では赤血球の洗浄方法や使用している抗ヒトIgG抗体が異なるということが挙げられる。RIA法よりもフローサイトメトリー法の方が洗浄回数が少ないため,低親和性抗体をより多く検出できると考えられるが,必ずしもこの通りでない症例も存在するため,方法間での洗浄条件の違いによる測定値への影響の検討や抗ヒトIgG抗体の反応性の比較などを行う必要がある。また,フローサイトメトリー法およびRIA法の測定は同じ日に行っていないため,患者検体を用いた検体の冷蔵保存による測定値の経時変化の検討も必要である。
フローサイトメトリー法によって測定するMFIDは,RIA法によるRBC-IgG量に代わる赤血球結合IgGを表す指標として有用であり,日常検査として導入可能である。MFIDの暫定基準範囲は,DAT陽性AIHAおよびDAT陰性AIHAの診断に有用であり,PNHの除外にも有用である。また,原因不明の溶血性貧血を呈する症例の診断補助,AIHA症例の経過の観察や治療効果の判定にあたって,MFIDを用いることは有意義である。しかし,DATの反応性やRIA法にて定量されたRBC-IgG量との乖離が生じる場合があり,原因の解明が急がれる。
本研究は山口大学大学院医学系研究科保健学専攻倫理審査委員会による承認を受けており(管理番号:236-2),自治医科大学においても倫理審査委員会の承認を受けている(管理番号:第臨大19-変006)。また,科学研究費(課題番号:16K08968)の援助を受けて実施している。
本研究内容は第79回日本血液学会学術集会,第80回日本血液学会学術集会にて発表した。
本論文に関連し,開示すべきCOI 状態にある企業等はありません。