2022 Volume 71 Issue J-STAGE-1 Pages 241-255
2022 Volume 71 Issue J-STAGE-1 Pages 241-255
運動器は,解剖学的には身体の骨格をなす骨,骨同士の可動的な連結部である関節,関節を介した複数の骨につながり骨を動かす骨格筋,刺激を伝える神経からなるが,本項では便宜上,軟部組織も含んだ疾患を取り上げる。骨はその形状から長管骨,短骨,扁平骨に分類される。長管骨はさらに両端の膨らんだ先端部から骨端部,骨幹端部,中央部の骨幹部からなる。骨の断面は,辺縁で硬い緻密骨と内部のスポンジ状の海綿骨からなり,関節にあたる骨表面は軟骨で覆われる。骨格筋は腱を介して骨膜に接続する。これらの組織を取り囲むように,膠原線維や脂肪組織,脈管が局在する。骨には,炎症性疾患やくる病,骨粗鬆症,骨折がみられ,骨を由来とする良性腫瘍として骨軟骨腫,悪性腫瘍として骨肉腫,軟骨肉腫,骨巨細胞腫が挙げられ,この他に転移性骨腫瘍もみられる。関節には,自己免疫的な発生機序が考えられる関節リウマチ,プリン体代謝異常の痛風,加齢による変形性関節症などが発症する。軟部組織由来の良性腫瘍として脂肪腫,平滑筋腫,線維腫,神経鞘腫などがあり,悪性腫瘍は脂肪肉腫,横紋筋肉腫,平滑筋肉腫,線維肉腫などが発症する。いずれも由来となる細胞を明らかにすることが,組織型の決定につながるため,診断においては細胞および組織の形態のみならず,免疫組織学的あるいは遺伝子学的な検索が必要となる。
Locomotorium includes bones (anatomical skeleton), arthroses (for mobile connections between bones), skeletal muscles (for connections to several bones via arthroses to move bones), and nerves (for impulse transmission). In this article, diseases of the locomotorium including soft tissues are discussed. Bones are divided into long bones, short bones, and plane bones on the basis of their shape. An epiphyseal region, the end portion of diaphysis, and a diaphyseal region exist from both expanded ends to the center of a long bone. A hard compact bone and a spongy cancellous bone exist at the periphery and the center of the cross section of a bone, respectively. The surface of a bone that is in contact with an arthrosis is covered with cartilage. Skeletal muscles are connected to periostea via tendons. Around the tissues mentioned above, collagenous fibers, fat tissues, and blood vessels exist locally. Bone diseases include inflammatory diseases, rachitic syndrome, osteoporosis, and bone fracture. Benign tumors originating from bones include osteochondroma. Malignant tumors originating from bones include osteosarcoma, chondrosarcoma, and giant cell tumor. In addition, there are metastatic bone tumors. In arthroses, rheumatoid arthritis suspected to be caused by autoimmune mechanism disorder, gout caused by purine metabolism disorder, and arthrosis deformans caused by aging can develop. Benign tumors originating from soft tissues include lipoma, leiomyoma, fibroma, and neurilemmoma. Malignant tumors originating from soft tissues include liposarcoma, rhabdomyosarcoma, leiomyosarcoma, and fibrosarcoma. In the diagnosis of these diseases, not only the clarification of the shapes of cells and tissues but also immunohistological and genetic analyses are necessary because the determination of disease-originating cells leads to the determination of the histologic type.
軟骨性基質を産生する悪性腫瘍である。好発年齢は30~50歳代で,好発部位は大腿骨や骨盤骨,上腕骨などで,骨幹端部の表層あるいは髄内から発生する。
画像上,石灰化を伴い,骨皮質の膨隆と肥厚,骨皮質内面の浸食像がみられる。
肉眼的には透明感のある灰白色を呈し,分葉状となる。
細胞異型(核の大きさ,核クロマチン量,細胞密度)の程度によってGrade 1~3に分類される1),2)。
2) 組織像軟骨基質の中に,多形性を示す大型の腫瘍細胞が増生する。核は大小不同があり,細胞密度が増加する。2核細胞や大型細胞がみられる(Figure 11.1, 11.2, 11.3)。

軟骨基質の中に,多形性を示す大小の腫瘍細胞が増生する。

クロマチンが増量した大型核を有し,細胞異型の強い大小の腫瘍細胞を認める。

軟骨基質の中に,核が腫大した腫瘍細胞が増生する。細胞密度が高い。
特殊染色は,軟骨基質の確認のためにAlcian blue染色が用いられる。細胞診はGiemsa染色で軟骨がメタクロマジー(異染性)を示す。
免疫組織化学は,S-100蛋白が陽性となる。
3) 細胞像背景には,ヘマトキシリン好性の軟骨基質を認める。腫瘍細胞は,核小体が目立ち,クロマチン構造が顆粒状で,大小不同の異型核をもち,細胞質はライト緑淡染性である(Figure 11.4)。腫瘍細胞は,軟骨基質の軟骨窩に収まるように位置し,2核細胞や核分裂像もみられる。

ヘマトキシリン好性の軟骨基質と共に,核が腫大した腫瘍細胞を認める。細胞密度はやや高い。
胎児期の脊柱の発生に関わる脊索に類似した形態を示す腫瘍である。
好発年齢は40~50歳代で,好発部位は頭蓋底の斜台領域と仙骨,尾骨である。
発育は緩徐で,骨破壊性に浸潤発育するが,転移は稀である3)。
X線では,溶骨性,破壊性骨病変を認め,CTでは,骨内溶骨性病変に隣接して軟部腫瘤陰影を認める4)。
2) 組織像粘液性基質を伴い,腫瘍細胞は上皮様のシート状に増生する。腫瘍細胞は,大小不同を呈する円形核をもつ。細胞質は豊富で,グリコーゲンをもつため淡明で,空胞状を呈する(Figure 11.5, 11.6)3)。細胞質に空胞を有する細胞を,担空胞細胞(physaliferous cell)とよぶ。

細胞質が豊富で淡明な腫瘍細胞が,シート状に増生する。

腫瘍細胞は,大小不同を呈する円形核をもち,細胞質は空胞状で,担空胞細胞(physaliferous cell)の形態を示す。
軟骨への分化を示す症例もみられる。
特殊染色は,PAS反応で細胞質のグリコーゲンが陽性となる。
免疫組織化学は,CytokeratinやVimentin,S-100蛋白,EMA,時としてCEAが陽性を示す3),4)。
3) 細胞像背景には,ヘマトキシリン好性の粘液腫様物質がみられ,腫瘍細胞が上皮様集塊や散在性に出現する。腫瘍細胞は,核小体を有し,小型で円形の核をもつ。豊富な細胞質はライト緑好性で,淡明および空胞状である(physaliferous cell)。(Figure 11.7, 11.8)。

細胞質が空胞状の担空胞細胞が散在性に出現する。

淡明で豊富な細胞質を有する腫瘍細胞が上皮様に結合する。
形質細胞の骨髄を中心とした単クローン性の増殖や,単クローン性免疫グロブリン(M蛋白)の血中および尿中増加をきたす腫瘍で,形質細胞骨髄腫(plasma cell myeloma)ともよばれる。
形質細胞腫の腫瘤が単発したものは形質細胞腫(plasmacytoma)(孤発性骨形質細胞腫,髄外性形質細胞腫)として区別される。
好発年齢は40歳以上で,高齢者に多く,好発部位は椎骨や肋骨,頭蓋骨,骨盤,大腿骨などである。
X線では,頭蓋骨に打ち抜き像や溶骨性変化がみられる。
高カルシウム血症や高γグロブリン血症,アミロイドーシスを呈する症例もみられる5)~7)。
2) 組織像形質細胞類似の腫瘍細胞が,結節状あるいはびまん性に増生する。腫瘍細胞は,クロマチンが凝集した円形の核を有し,細胞質は好塩基性である(Figure 11.9)。核は偏在し,核周明庭がみられる。腫瘍細胞の中には細胞異型が弱く,正常形質細胞との鑑別が困難な症例も少なくない。骨髄生検において,正常や反応性骨髄細胞増多は数個の形質細胞が集簇をつくる程度であるが,多発性骨髄腫では腫瘍細胞が30%以上を占めることや,単クローン性の増生を示すことで診断がなされる5)~7)。

形質細胞類似の腫瘍細胞が,びまん性に増生する。
特殊染色は,Giemsa染色やMethyl green-pyronin染色,アミロイドの沈着をきたす症例では,アミロイド染色を行う。
免疫組織化学は,CD138やCD79αが陽性となる(Figure 11.10)。さらに免疫グロブリンのκ鎖やλ鎖の単クローン性を確認する。CD20は陰性の場合が多い8)。

腫瘍細胞の細胞膜がCD138の陽性所見を認める。
腫瘍細胞は,クロマチン構造が粗顆粒状で,円形の核を有し,細胞質はライト緑好性であるが,やや青味がかる。核は偏在性で核周明庭がみられる(Figure 11.11)。Giemsa染色では,細胞質が好塩基性を示し,核周明庭もみられる。M蛋白を呈する症例では,背景が淡青色に染まる(Figure 11.12)。

クロマチン構造が粗顆粒状で,円形の核を有し,細胞質はライト緑好性であるが,やや青味がかる。

細胞質が好塩基性を示し,核周明庭もみられる。背景はやや青味を帯びている。
骨原発の肉腫の中で最も多い。好発年齢は10~20歳代で,好発部位は長管骨骨幹端で大腿骨遠位端,腓骨近位端,上腕骨近位端などである。
X線では,不整な骨破壊像と皮質の破壊,骨形成性変化と骨膜反応がみられる。
肉眼的には灰白色ないし黄白色を呈し,骨は未熟で種々の程度の石灰化を伴う。
悪性度は高く,早期に転移し,5年生存率は20%以下である。
通常型の骨肉腫は,形成されている基質の優勢像により,骨芽細胞型,軟骨芽細胞型,線維芽細胞型に大別されるが,他にも多様な組織亜型が含まれる。また,細胞異型度によりGrade分類(I~IV)され,各々予後は異なる9),10)。
2) 組織像組織像は多彩である。核異型を伴う類円形から紡錘形など,多形性に富む腫瘍細胞が増生する。未熟骨や類骨が形成され,レース状と称される細かい網目状構造を形成する。破骨型多核巨細胞も出現する(Figure 11.13, 11.14, 11.15)9)~11)。

骨がレース状の網目状構造を形成する。

骨形成を伴い,細胞異型が強い大小の腫瘍細胞を認める。
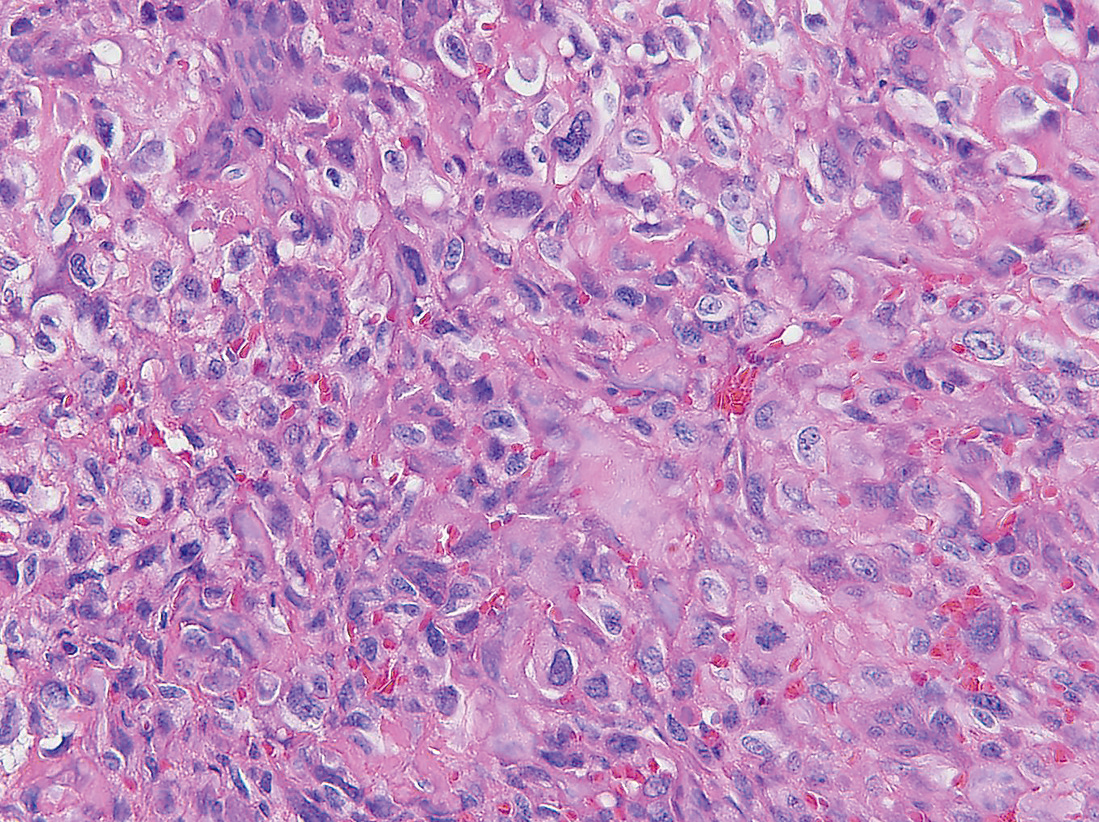
類骨と多形性のある腫瘍細胞,多核巨細胞を認める。
免疫組織化学は,osteocalcinやvimentinが陽性となり,osteonectinやS-100蛋白なども種々の割合で陽性となる9)。
3) 細胞像細胞像は多彩である。腫瘍細胞は,核小体が明瞭で,クロマチン構造が粗顆粒状,不整形で大小不同の核をもつ。細胞質はライト緑好性で,多辺形である(Figure 11.16)。骨成分はヘマトキシリンに染色される。類骨はライト緑やエオジンなどに染色されるが,硝子化した結合組織との鑑別は容易でない。骨や類骨は,細胞診標本上では確認できない場合もあるが,確認できれば診断的価値は高い。

左)核小体が目立ち,不整形核をもった,紡錘形および多辺形の腫瘍細胞を認める。右)類骨がみられる。
骨芽細胞由来の間質細胞からなり,線維化や時として骨形成を伴う腫瘍である。良性腫瘍に分類されるが,掻爬後は高率に再発し,他臓器への転移もまれにみられる。
好発年齢は,20~30歳代の若年成人で,15歳以下の小児には稀である。好発部位は,長管骨の骨端部,大腿骨遠位,脛骨近位,橈骨遠位,肋骨近位端,仙骨である。
X線では,限局性で偏心性の境界明瞭な骨透亮像をみる。
肉眼像は,豊富な血管を反映して赤褐色を呈する。出血性で,褐色ないし赤褐色を帯びる。出血,壊死,嚢胞などを伴う12)。
2) 組織像間質細胞由来の単核細胞と破骨型巨細胞からなる。単核細胞は,類円形から紡錘形の核で,広く好酸性の細胞質を有する。破骨型多核細胞は,核が10~50個と非常に多く,多数出現する。血管に富み,核分裂像はみられるが,異型核分裂像は認めない。出血や壊死などの二次的変化がみられる(Figure 11.17, 11.18, 11.19)12),13)。

単核細胞と破骨型巨細胞を多数認める。背景には出血がみられる。

単核細胞とヘモジデリンを含有した破骨型巨細胞がみられる。

破骨型巨細胞の核は20個以上と非常に多く,単核細胞と移行するような像もみられる。
免疫組織化学は,単核の間質細胞は骨芽細胞マーカーのRUNX2やp63が陽性となり,多核巨細胞は組織球マーカーのCD68,破骨細胞マーカーのCD51,CathepsinKが陽性となる14)。
3) 細胞像単核の腫瘍細胞と多核巨細胞がみられる。単核細胞は,核小体が小型で,類円形の核をもち,細胞質はライト緑好性で紡錘形を呈する。多形性に乏しく,細胞異型はみられない。多核巨細胞は,核が10~50個と非常に多く,多数出現する(Figure 11.20)。背景には,腫瘍の二次性変化による出血やヘモジデリンを含有した組織球がみられる。

左)単核細胞と破骨型巨細胞を認める。
右)破骨型巨細胞の核は多く,単核細胞との移行像もみられる。
軟骨芽細胞腫(chondroblastoma)が類似した細胞像を呈するが,巨細胞腫では,単核細胞と多核巨細胞との移行像がみられる点が鑑別となる。
プリン代謝異常による高尿酸血症を基礎病態とし,尿酸ナトリウム(monosodium urate; MSU)結晶の沈着に起因する急性の関節炎と腎障害を臨床症状とする疾患である。20歳代以上の男性で,第1中足趾節関節に好発する15)。皮膚の発赤や腫脹,痛みを伴う発作が数日から数週間続き,その後自然に消失する。多くは先天的な代謝異常に伴い発症する原発性痛風で,この他に稀ではあるが,白血病や悪性腫瘍で細胞が過剰に崩壊することで発症する二次性痛風がある16)。肉眼的にはチョーク状で脆い白色物質からなる結節が形成される17)。
2) 組織像MSU結晶の多結節状の沈着が生じ,その周囲には異物反応からなる異物肉芽腫性炎を呈する。痛風に特徴的な組織変化を痛風結節(tophus)とよび,結晶状あるいは無定形のMSU結晶の周囲に組織球やリンパ球,線維芽細胞,多数の異物巨細胞を認める(Figure 11.21, 11.22)。

MSU結晶が一部癒合した結節状となって分布する。結節の周囲を炎症細胞が取り囲む。

MSU結晶から成る結節の周囲には,多核の異物巨細胞が多数みられる。
MSU結晶は針状を呈し,偏光顕微鏡による観察で負の複屈折性を示す(Figure 11.23)。MSU結晶は水溶性であり,ホルマリン固定では溶失するため,無水エタノールによる固定を行う。また,標本作製工程においても水洗を可能な限り少なくする15)。MSU結晶は,キシレンによる脱パラフィン後に封入した未染色標本を偏光顕微鏡下で観察するか,Kossa反応やde galantha(デガランタ)染色,メセナミン銀法により黒色の結晶として観察される(Figure 11.24)。

左)エタノール固定。簡易偏光による観察で偏光を示し,周囲が暗い中に針状結晶が白く光る。
右)ホルマリン固定。偏光を示さない。

左)エタノール固定。針状結晶が黒く染色される。
右)ホルマリン固定。結晶が溶失し,染色されない。
1962年,MaCartyらは急性痛風性関節炎様の症状を呈する患者関節液中に,MSU結晶でなくピロリン酸カルシウム(calcium pyrophosphate dehydrate; CPPD)結晶を見出し,偽痛風(pseudogout)と名付けた。また,X線上で軟骨組織に石灰化をきたす病態が軟骨石灰化症(chondrocalcinosis)と呼ばれたが,ほとんどがCPPD沈着によるものと明らかになり,今日ではこれらを包括した名称としてピロリン酸カルシウム(CPPD)結晶沈着症が使われるようになっている。
CPPD結晶沈着症は高齢者に多く,膝の半月板や椎間板,恥骨結合などの線維軟骨組織に好発する。
肉眼的にはチョーク状の白色沈着物を生じ,メスで切るとザラザラした割面を呈する18)。
2) 組織像CPPD結晶は小島状に分布し,石灰化を示すため,HE染色で青紫色に染色されることが多い19)。CPPD結晶沈着に対する反応は部位により異なる。すなわち,関節軟骨など血管の少ない組織では反応は殆どみられず,結晶沈着部位の周囲に軟骨化生を示すことがあり,結晶沈着部周囲に異物巨細胞からなる異物反応がみられるなど様々である(Figure 11.25, 11.26, 11.27)18),20)。

CPPD結晶が島状に分布する。

CPPD結晶周囲は結合組織があり,周囲の反応は乏しい。

長斜方形結晶とリンパ球などの炎症細胞が少数みられる。
CPPD結晶は1~5 μmの長斜方形結晶であるが針状を呈することもあり(Figure 11.28),結晶の形態のみではMSU結晶との鑑別は困難である。偏光顕微鏡下では弱い正の複屈折性を示すが,MSU結晶のような全ての結晶が偏光を示さない点で異なる。

簡易偏光による観察で偏光を示し,周囲が暗い中に長斜方形結晶が白く光る。
日本の成人に発生する軟部腫瘍の約20%を占める。組織学的および遺伝子学的特徴から高分化型,粘液型,多形型,脱分化型に分類され,組織型により腫瘍の発育速度や予後,組織像が異なる。中高年者の四肢の軟部組織に発生し,大腿部に多い。
CTでは低吸収領域,MRIではT1およびT2強調画像にて中~高信号として描出される。
高分化型のうち,皮下に発生する表在性分化型は,再発や転移を起こさないため異型脂肪腫とも呼ばれる。多形型は再発,遠隔転移をきたし,5年生存率は20%で,脱分化型は予後不良である。
肉眼的には境界明瞭で分葉状の腫瘤を形成し,黄色から白色調を呈する21)。
2) 組織像高分化型は,成熟した脂肪細胞と大型の濃染核を有する異型脂肪芽球が混在する(Figure 11.29)。粘液型は,繊細な毛細血管網と粘液状基質の中に,脂肪空胞を有する低分化脂肪芽細胞がみられる。多形型は,多核巨細胞や不整形の大型核をもった腫瘍細胞からなり,出血や壊死傾向が強い(Figure 11.30)。脱分化型は,分化型脂肪肉腫の一部に,未分化多形肉腫様あるいは線維肉腫様の成分を含む21),22)。

細胞質に空胞を有する腫瘍細胞が,充実性に増生する。腫瘍細胞の間に毛細血管がみられる。

左)淡明な細胞質をもつ腫瘍細胞と不整形核を有する大型腫瘍細胞を認める。
右)腫瘍細胞は,赤色顆粒状に染色される脂肪滴を有する。
特殊染色には,脂肪染色が用いられる(Figure 11.30)。
免疫組織学は,高分化型でMDM2やCDK-4,S-100蛋白が陽性となる。脱分化型はCD34,粘液型はS-100蛋白が上記に加え陽性となる(Figure 11.31)21)~23)。

腫瘍細胞の核にMDM2の陽性所見を認める。
高分化型は,分化した脂肪細胞の中に,異型を伴う核を有する細胞が少数混在するが,脂肪腫との鑑別は容易でない。粘液型は,粘液様物質と毛細血管を背景に,多空胞状の細胞質をもった小型の脂肪芽細胞が出現する(Figure 11.32)。多形型は,多形性を示す腫瘍細胞と共に,細胞質に空胞をもち,脂肪細胞への分化を示す腫瘍細胞が出現する。

クロマチン構造が顆粒状で,類円形核をもつ腫瘍細胞を認める。一部の腫瘍細胞は,空胞状の細胞質をもつ。
種々の分化段階の横紋筋芽細胞から構成される悪性度の高い腫瘍で,小児の代表的軟部悪性腫瘍である。発育様式によって胎児型,胞巣型,多形型に分類され,さらに胎児型の亜型として紡錘細胞型がある。横紋筋肉腫の中では胎児型と胞巣型が多い。各々の組織型で発生年齢や発生部位,生物学的態度が異なる。胎児型は0~15歳で頸部や膀胱など,胞巣型は10~25歳で四肢の筋肉,多形型は50~55歳で四肢の筋肉に好発する。肉眼的に,胎児型は境界不明瞭,白色でやわらかいが,多形型では暗赤色で分葉状を呈する。胎児型のうち粘膜表面近くにポリープ状に発育するものは,その発育形態からブドウ状肉腫と呼ばれる24),25)。
2) 組織像胎児型の腫瘍細胞は小型で,円形ないし紡錘形の好酸性細胞質をもち,横紋がみられる。胞巣型は,小型円形細胞に加え,多核巨細胞やラケット状細胞が出現する。横紋の確認は容易でなく,偽腺管構造や干し柿を吊るしたような配列を示す。多形型は,様々な形の横紋筋芽細胞に巨細胞が混在し,多形性を示す(Figure 11.33, 11.34)。好酸性で豊富な細胞質には横紋がみられる。細胞質にグリコーゲンを含む空胞が形成されたクモの巣細胞も認める。

核異型を伴う円形の腫瘍細胞や大型腫瘍細胞が増生する。

核小体が目立ち,好酸性で豊富な細胞質をもつ腫瘍細胞を認める。腫瘍細胞は大小不同を示す。
特殊染色は,PTAH染色による横紋,PAS反応によるグリコーゲンの確認が有用である。
免疫組織化学は,DesminやMyoglobinに加え,未熟な横紋筋芽細胞のマーカーであるMyogeninやMyoD1が陽性となる(Figure 11.35)23)~25)。

腫瘍細胞にMyoD1の陽性所見を認める。
電顕的には筋線維と横紋がみられる。
3) 細胞像胎児型と胞巣型は,小型円形の腫瘍細胞が主体である。核は偏在し,細胞質はライト緑好性である。多形型は多形性を示す大小の腫瘍細胞が出現し,細胞質はライト緑好性で濃染する。横紋が観察されることは少ない(Figure 11.36)。

核小体が目立ち,不整形の核をもち,細胞質がライト緑好性で多辺形の腫瘍細胞を認める。
平滑筋への分化を示す悪性腫瘍で,軟部悪性腫瘍の約10%を占める。好発年齢は40~60歳代で,高齢者に多い。子宮や消化管に好発するが,後腹膜や腸間膜,四肢の軟部にも発生する。肉眼的には白色から灰白色の渦紋様を示し,腫瘍周囲は被包されたようにみえるが浸潤性発育を示す。大きな腫瘍では壊死出血巣が広範にみられる。核分裂像の多少が予後に反映し,後腹膜や腸間膜のものは予後がきわめて悪い。転移は血行性により,転移先は肺が多い。
画像上は,辺縁不整で被膜の目立たない腫瘤として描出される26),27)。
2) 組織像腫瘍組織内は,細胞成分に富み,血管が目立つ。腫瘍細胞は多彩で,巨細胞や核分裂像がみられる。紡錘形の腫瘍細胞は交錯する束をつくって並び,核の柵状配列もみられる(Figure 11.37)。腫瘍細胞の縦走部では細網線維が細胞間に平行に走行する。腫瘍細胞は,長紡錘形で両端が鈍で葉巻状の核をもつ。細胞境界は明瞭で,好酸性の細胞質をもち,核の周囲には空隙を認める(Figure 11.38)。

紡錘形の腫瘍細胞が,束をつくって流れるように配列する。

腫瘍細胞は,両端が鈍で葉巻状の核をもつ。一部の腫瘍細胞は,核の周囲に空隙がみられる。
免疫組織化学は,α-smooth muscle actinやMyosin,Desmin,h-caldesmonが陽性になることが多い(Figure 11.39)23),26),27)。

腫瘍細胞にh-caldesmonの陽性所見を認める。
葉巻型の核を有する腫瘍細胞が,流れるような配列あるいは錯綜して出現する。核クロマチン構造は顆粒~粗顆粒状で,細胞質はライト緑好性の紡錘形,細胞の輪郭は比較的明瞭である。(Figure 11.40)。

クロマチン構造が顆粒状で,長楕円形の核をもち,細胞質がライト緑好性で紡錘形の腫瘍細胞を認める。
線維芽細胞由来の悪性腫瘍である。20~40歳代に好発し,男性にやや多い。四肢とともに腹壁や背部,頭頸部にもみられる。肉眼的には被膜のない灰白色の腫瘤を形成し,周囲組織へ浸潤し,出血や壊死を伴う。
線維肉腫の中には,放射線照射後,瘢痕,火傷から発生するものもみられる。
線維芽細胞への分化の程度により分化型と低分化型に分けられる。分化型は,細胞密度がやや高く,腹壁外デスモイドとの鑑別を要する。低分化型は多形性を示す。5年生存率は分化型で82%,低分化型で36%である。転移は血行性転移が多く,転移先は肺,骨(椎骨,頭蓋骨)が多い28),29)。
2) 組織像細網線維や膠原線維が腫瘍細胞を取り囲むように配列する。腫瘍細胞束は縦横に交錯し,杉綾模様(herringbone),魚骨様構造(sciling pattern)を呈する(Figure 11.41)。腫瘍細胞は紡錘形で,核は大きく濃染性,核分裂像もみられるが,腫瘍細胞は比較的揃っている(Figure 11.42)28)。

紡錘形の腫瘍細胞束が,縦横に交錯し,杉綾紋様を呈している。

腫瘍細胞は,クロマチン構造が細顆粒状で,長楕円形の核をもつ。
免疫組織化学は,vimentinやCD34がびまん性に陽性となる(Figure 11.43)。S-100蛋白やdesmin,cytokeratinやEMAが陰性となることで,他の類似した腫瘍との鑑別がなされる23),28),29)。症例によってsmooth muscle actinが陽性のことがあり,電子顕微鏡でsmooth muscle myofilamentsが確認されることから,筋線維芽細胞への分化が示唆されている。

腫瘍細胞にCD34の陽性所見を認める。
腫瘍細胞が縦横に交錯するため,核が斜めに交差するように配列する。腫瘍細胞は,クロマチン構造が細顆粒状で,長楕円形の核をもつ。細胞質はライト緑淡染性で,細胞の輪郭は不明瞭である(Figure 11.44)。

クロマチン構造が細顆粒状で,長楕円形の核をもち,細胞質がライト緑淡染性の腫瘍細胞を認める。
末梢神経のSchwann細胞から発生する良性の腫瘍で,境界明瞭で被膜を有する孤在性の腫瘤を形成する30)。
2) 組織像腫瘍組織内には,Antoni A型とAntoni B型の異なる組織像を呈する成分が混在してみられるが,両者の占有比率は症例によって様々である。
Antoni A型は,紡錘形の腫瘍細胞が密に増生し,束状で流れるような配列を示す。核が平行に,周期的な間隔に並ぶ柵状配列(palisading)あるいは観兵式様配列(paradestellung)を示す(Figure 11.45)。

紡錘形の腫瘍細胞が密に増生し,束状で流れるような配列を示す。核が長軸と平行に,周期的な間隔に並ぶ。
Antoni B型は,腫瘍細胞の分布が疎で,組織は浮腫状を呈する。核が大型で,異型を示す腫瘍細胞も少数混在する(Figure 11.46)。

腫瘍細胞は疎に分布する。一部に,核が大型の腫瘍細胞もみられる。
腫瘍が大型の場合,しばしば出血や嚢胞状変性などの二次的な変化を示す。
免疫組織化学は,S-100蛋白が陽性となる(Figure 11.47)30)。

腫瘍細胞にS-100蛋白の陽性所見を認める。
腫瘍細胞が流れるような配列となり出現する。腫瘍細胞は,クロマチン構造が微細顆粒状で,核膜は目立たない。核は紡錘形を呈し,核の一端は尖って波打つような形態を示す。細胞質はライト緑淡染性で,細胞の境界は不明瞭である。
腫瘍細胞の集塊内に神経線維がみられる場合もある。Antoni A型では,核が特徴的な柵状配列を示し,Antoni B型では,腫瘍細胞内に大型核をもった腫瘍細胞が混在する(Figure 11.48)。

核の一端が尖り,やや湾曲した紡錘形の核をもつ腫瘍細胞を認める。大型腫瘍細胞も散見される。
本論文に関連し,開示すべきCOI 状態にある企業等はありません。
青木 裕志(順天堂大学医学部附属練馬病院)…I, II, III
担当編集委員青木 裕志(順天堂大学医学部附属練馬病院)