2022 Volume 71 Issue J-STAGE-1 Pages 106-144
2022 Volume 71 Issue J-STAGE-1 Pages 106-144
リンパ組織は生体内の各所に分布していて,リンパ節,リンパ装置,リンパ濾胞として存在し免疫を担当している。リンパ節の組織構造は被膜に覆われ輸入・輸出リンパ管を有し,リンパ実質とリンパ洞から成る。リンパ装置はリンパ節にある組織周囲の被膜は無く,輸入・輸出リンパ管やリンパ洞もみられない構造をしていて,扁桃,気管支関連リンパ組織(BALT),パイエル板などの消化管関連リンパ組織(GALT),脾臓の白髄などが該当する。リンパ濾胞は全身の臓器,組織に状況に応じ形成される。その他にもリンパ組織を構成するリンパ球幹細胞の供給や未熟リンパ球の分化を担うリンパ装置として胸腺や骨髄がある。近年BALTやGALTは他の部位の粘膜も含め粘膜関連リンパ組織(MALT)として認識されている。これらリンパ組織から発生する疾患としては,免疫反応による変化や悪性リンパ腫などが重要である。人の造血は胎児の早い時期から始まり,卵黄嚢,肝,脾で行われる。胎生4か月ごろには骨髄で造血が始まり出生後も続く。出生時の造血はどの骨でも起こっているが,四肢の骨では成人期前半ごろまでに終わり,その後は主に骨盤や脊椎などに移行する。骨髄は脂肪細胞が多く存在する黄色髄と赤色髄に分類される。骨髄への栄養は主動脈が骨皮質から入って終末動脈となり,中心静脈に集まって静脈として出てゆく。造血器官の疾患として重要なのは貧血や白血病などである。
Lymphoid tissues, such as lymph nodes, lymphatic tissue, and lymph follicles, are distributed in various parts of the body and function in immunity. Structurally, a lymph node is enclosed in a capsule and has afferent and efferent lymphatic vessels. A lymph node consists of a lymph node parenchyma and lymph sinuses. Lymphatic tissues are not enclosed in a capsule, unlike the lymph nodes. Lymphatic tissues do not have afferent and efferent lymphatic vessels and lymph sinuses. Lymphatic tissues correspond to the tonsils, bronchus-associated lymphoid tissues (BALTs), gut-associated lymphoid tissues (GALTs) such as those in Peyer’s patches, and the white pulp of the spleen. Lymph follicles are formed according to the states of systemic organs and tissues. Other lymphatic tissues include those in the thymus gland and bone marrow, which are responsible for the supply of lymphoid stem cells constituting the lymphoid tissues and the differentiation of immature lymphocytes. Recently, BALTs and GALTs have been recognized as mucosa-associated lymphoid tissues (MALTs) including those in the mucous membranes of other regions. The main diseases of lymphoid tissues include systemic changes induced by immunoreactions and malignant lymphoma. Hematogenesis begins in the yolk sac, liver, and spleen from an early stage of embryogenesis. At around the fourth month of intrauterine life, hematogenesis begins in the bone marrow, which continues after birth. Homogenesis occurs in all bone types at birth; however, homogenesis in appendicular bones ends by the first half of adult life. After that, the site of homogenesis moves to mainly the pelvis and spine. The bone marrow is divided into the fat-cell rich yellow bone marrow and red bone marrow. Nutrition is supplied to the bone marrow through the principal artery running through the bone cortex, which leads to telangions and collected again in the central vein for excretion. The main diseases of hematopoietic organs include anemia and leukemia.
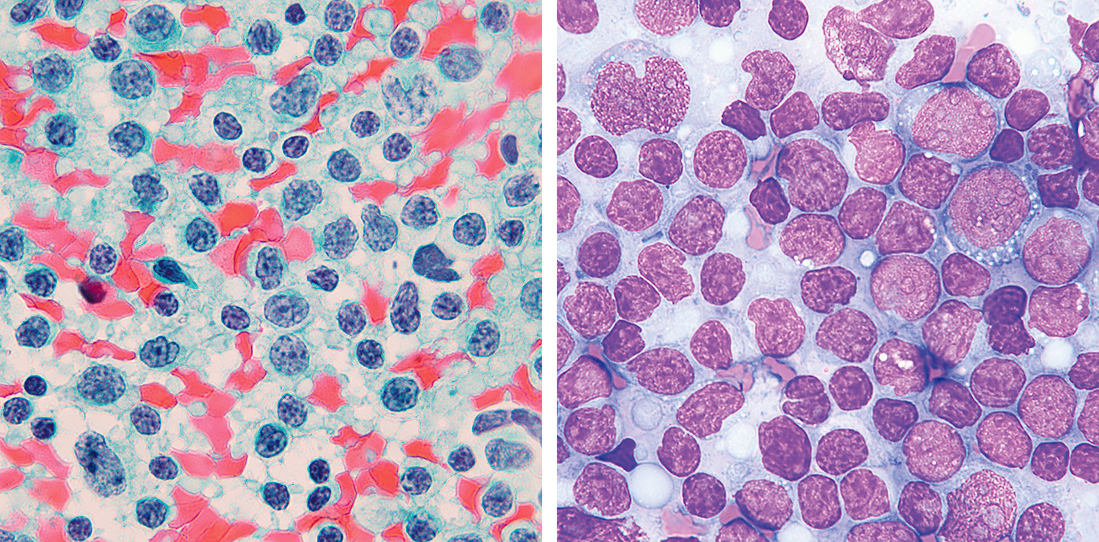
骨髄クロット標本・骨髄生検では,造血細胞の密度(cellularity),造血構成,巨核球数,異常細胞の有無,線維化の有無などが評価される。
1) 造血細胞の密度(cellularity)細胞密度は造血胞巣と脂肪細胞比率であらわされる。細胞密度は年齢(Table 7.1)や採取部位により変動する1)。
| Cellularity(%) | |
|---|---|
| 新生児 | 80~100 |
| 乳 児 | 70~90 |
| 小 児 | 60~80 |
| 成 人 | 40~60 |
| 老 人 | 25~45 |
細胞密度は正常では50%前後で,この状態を正形成骨髄(normocellular marrow)と呼ぶ。造血巣がそれより増加した状態を過形成骨髄(hypercellular marrow),減少した状態を低形成骨髄(hypocellular marrow)と呼ぶ2)(Figure 7.1)。過形成骨髄を示す代表的な疾患は急性白血病,CML,真性赤血球増多症などで,低形成骨髄を示す代表的な疾患は再生不良性貧血である3)。

左から低形成骨髄,正形成骨髄,過形成骨髄。
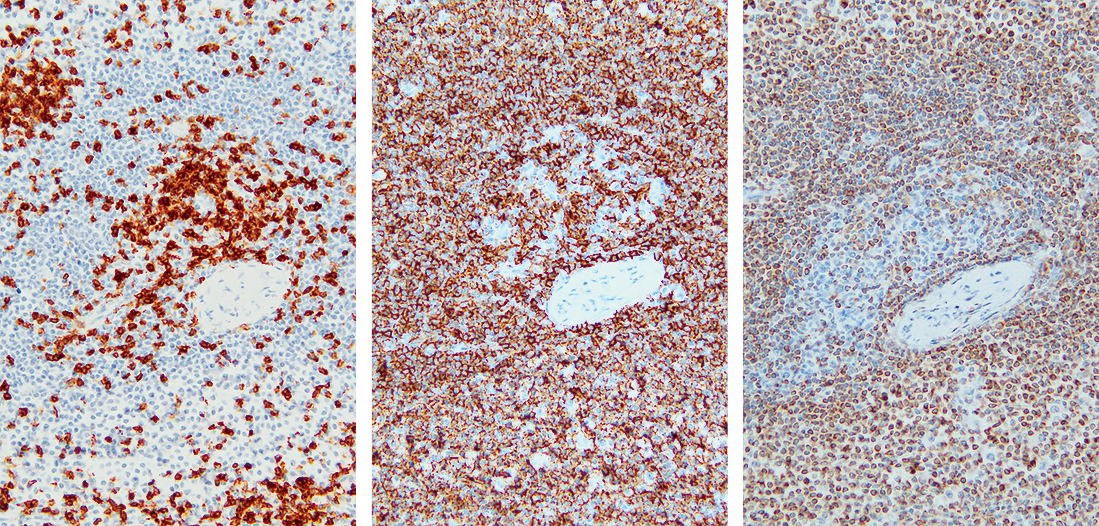
造血巣内には通常顆粒球が最も多くみられる。顆粒球と赤芽球の比率(M:E比)の正常範囲はおよそ2:1~4:1で,女性と低年齢の小児ではやや高い傾向を示す2)。HE染色では顆粒球と赤芽球の判別は難しいが,適切に分別されたギムザ染色により分類は可能である(Figure 7.2)。しかしながら,分別不良の標本が多いのが現実である。その点AS-Dギムザ染色は分別が容易で,顆粒球の同定に優れている4)(Figure 7.3)。さらに確実な分類のためには免疫染色を行う必要がある(Figure 7.4)。
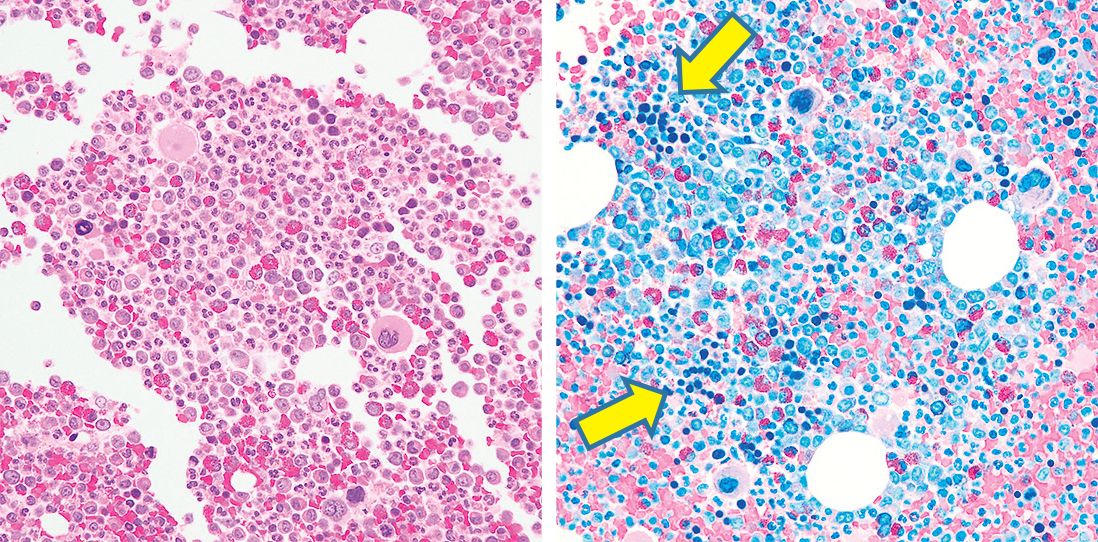
ギムザ染色ではHE染色より顆粒球,赤芽球(黄矢印)の判別がしやすい。

顆粒球系は赤く染色され,赤芽球(黄矢印)は陰性となる。

顆粒球系はMPO(myeloperoxidase),赤芽球系はglycophorin,hemoglobinやCD71,巨核球系はCD42bで陽性を示す。
正常値は1~2/hpf(40倍対物400倍視野)である5)。骨髄中に巨核球が増える疾患は,真性赤血球増加症,特発性血小板減少性紫斑病,原発性骨髄線維症,CML,本態性血小板症などがある。巨核球が減少する疾患は,続発性血小板減少症(急性白血病,再生不良性貧血,巨赤芽球性貧血)や放射線障害によるものがあげられる3)。
免疫染色ではglycoprotein IIb,CD42b,CD61が巨核球系マーカーとして用いられる。小型巨核球,特に微小巨核球(micromegakaryocyte)は免疫染色でのみ判別が可能となる(Figure 7.5)。
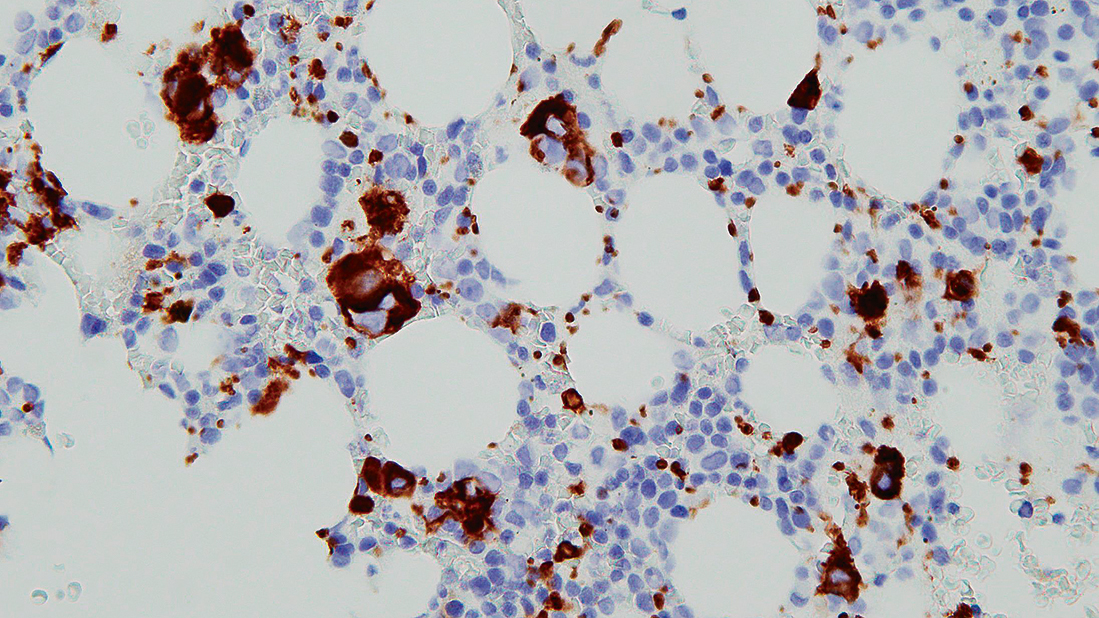
小型巨核球や微小巨核球は形態のみでは鑑別が難しい。
形態学的に判別できる細胞の異常,造血パターンの異常,芽球の有無,悪性腫瘍の転移などを確認する。芽球の同定には免疫染色CD34が重要である(Figure 7.6)。また,それぞれの疾患に応じて必要な免疫染色を選択する。

芽球はCD34陽性を示す(AML症例)。
鍍銀染色,膠原線維染色により線維化の度合いを評価する(「9.骨髄線維症」項を参照)。
2. 腫瘍性病変―急性骨髄性白血病(acute myeloid leukemia; AML) 1) 概要急性骨髄性白血病(acute myeloid leukemia; AML)は骨髄系幹細胞の腫瘍化したもので,成熟球への分化の乏しい骨髄系の芽球が末梢血,骨髄またはその他の臓器に浸潤・増殖する疾患である6)。臨床像,細胞形態,免疫学的表現型,遺伝子異常により細かく分類される。
2) 臨床像急性白血病の発生頻度は10万人あたり約4人で,うち70%をAMLが占め,男性に多い。発症年齢の中央値は60歳である。原因としてはウイルス,放射線,抗癌剤,有機溶剤などがあげられるが,これらの環境因子が関与しているAMLは1~2%に過ぎないと言われている7)。
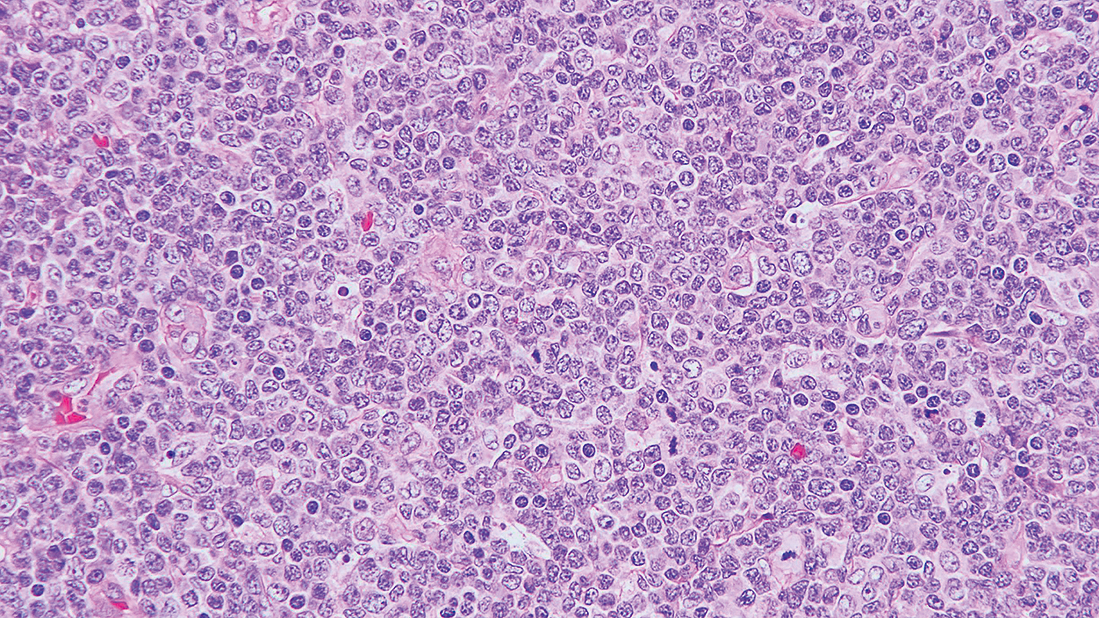
3) 組織像高度の過形成性の骨髄組織(Figure 7.7)で,芽球はびまん性増殖を示し(Figure 7.8, 7.9),正常な巨核球系や赤芽球系細胞は高度に抑制されている。芽球は一部で核小体がみられ,核形不整を示している(Figure 7.9)。

骨髄は高度の過形成を示す。

少数の赤芽球系細胞とともに多くの芽球の増殖がみられる。

芽球細胞は不整形核が多く,陥入を伴う核もみられる。
骨髄の線維化が強い症例では,骨生検でしか判断できない時もある。
4) 免疫染色結果ミエロペルオキシダーゼ(MPO)陽性の骨髄芽球細胞が多くを占め,CD71陽性の赤芽球は小集塊でみとめるのみである。症例によってはp53,CD34が陽性となる(Figure 7.10)。

赤芽球系細胞は抑制され,多くがMPO陽性の骨髄球系で占められている。CD34陽性の芽球が多数みられる。
急性リンパ〔芽球〕性白血病(acute lymphoblastic leukemia; ALL)はリンパ球がBまたはT細胞系統に分化が決定した初期段階にあるリンパ芽球の腫瘍で8),骨髄中のリンパ芽球比率が25%以上である場合にALLと診断すると言われている8)。
ALLは免疫学的形質からT細胞性,B細胞性に分けられるが,遺伝子異常や染色体異常の有無でさらに多くの病型に分けられる。
WHO分類ではリンパ芽球性リンパ腫(lymphoblastic lymphoma; LBL)と急性リンパ芽球性白血病(acute lymphoblastic luekemia; ALL)は同一の疾患としてALL/LBLとして扱われている。
2) 臨床像発熱,貧血,出血傾向はみられ,小児に好発し,ALLの80~85%がB-ALLを占めている。T-ALLは小児ALLの約15%,成人ALLの25%を占める9)。成人ALLの30~40%にフィラデルフィア染色体t(9;22)がみられる。
3) 組織像骨髄像は高度な過形成を示し(Figure 7.11, 7.12),核形不整な小~中型の芽球様細胞が単調に増殖している。核小体は目立たない(Figure 7.13)。

骨髄は高度な過形成を示す。

骨髄生検でも同様に高度な過形成を示す。

核形不整な小~中型の芽球様細胞が単調に増殖する。
T-ALLとB-ALLには形態的に差はみられない。
4) 免疫組織化学B-ALLではCD10,CD79a,PAX5,CD19,TdTが陽性を示す。CD20,CD34は様々な発現をみる。MPOは陰性である。また,多くの場合TdTが陽性を示す8)。
T-ALLでは,TdTが通常陽性を示し,CD1a,CD3,CD4,CD5,CD8が種々の程度で陽性を示す8)。
B-ALL,T-ALLいずれの場合もMPOは常に陰性である8)。
本症例ではPAX5,CD10,TdTが陽性を示し,B-ALLと診断された(Figure 7.14)。

PAX5,CD10陽性を示し,B-ALLと診断された。
慢性骨髄性白血病(chronic myelogenous leukemia; CML)は顆粒球系細胞の増殖を主体とする骨髄増殖性腫瘍の一病型である。異常クローンにフィラデルフィアPhiladelphia(Ph)染色体をみとめることを特徴とし,この染色体異常によってチロシンキナーゼ活性の活性化したBCR-ABL1融合遺伝子がCMLの病因であると証明されている。
2) 臨床像年間発症頻度は10万人に1~2人である。好発年齢は40~50歳代で,男性にやや多い。
無症状であるために健診の血液検査で白血球増多により発見されることもある。初期症状は体重減少,貧血,寝汗,脾腫が多い(髄外造血による)。移行期と急性転化時は貧血,血小板減少,高度の脾腫による症状,全身状態の悪化がみられ,ほとんどが急性期に死亡する10)。
3) 組織像・慢性期(chronic phase; CP)
骨髄では高度の過形成を示し(Figure 7.15),すべての成熟段階の顆粒球の増加をみる。好酸球や好塩基球も増加する(Figure 7.16)が,赤芽球は相対的に減少する。顆粒球系が圧倒的に増加し,巨核球は正常ないしは減少する型と顆粒球と巨核球の2系統の増加をみる型に分かれる。後者での巨核球は小型でやや分葉状のものが散見される(Figure 7.17)。CD34陽性細胞は孤在性に少数みとめられるのみ(Figure 7.18)である10)。

骨髄は過形成を呈する。

すべての成熟段階の顆粒球系細胞の増加がみられる。

顆粒球と巨核球,2系統の増加がみられる。

CD34,p53陽性を示す芽球を弧在性に少数みとめる。
・移行期(accelerated phase; AC)
過形成を示し,幼弱な顆粒球の増加をみる。異型的な巨核球が集簇を作り,著明な線維化を伴う。CD34陽性細胞がびまん性,集簇でみとめられるようになる10)。
・急性期(blast phase; BP)
芽球が増加し,急性白血病の像を呈する。また,線維化が骨髄系・リンパ系急性転化の40%にみられ,巨核球系芽球転化ではほぼ常にみられる10)。慢性期の患者が移行期を経て急性期へ進展することを急性転化と言う。
5. 腫瘍性病変―慢性リンパ性白血病(chronic lymphocytic leukemia; CLL) 1) 概要慢性リンパ性白血病(chronic lymphocytic leukemia; CLL)は成熟した形態の小型B細胞リンパ球からなる腫瘍で,末梢血,骨髄,リンパ節,脾臓などに浸潤する(T細胞の形質を示すものは含まない)。また,小リンパ球性リンパ腫(small lymphocytic lymphoma; SLL)はCLLと同様の形態を示すが,悪性リンパ腫の病態を示し,白血化しないものを言う11)。WHO分類ではCLL/SLLと表記される。
2) 臨床像本邦では全白血病の2%と少ない12)。好発年齢は60歳代,男性に多い11)。
無症状であるために健診で発見されることがある。肺炎を契機に発見されることもある。症状がある場合は全身倦怠感,体重減少,リンパ節腫脹,脾腫による圧迫感があり,進行すると貧血や出血傾向を示す。CLL症例の約80%に染色体・遺伝子異常がみられる11)。
CLLには癌の併発が10~15%にみられる。また,2~8%にびまん性大細胞型リンパ腫(Richter症候群),稀にHodgkinリンパ腫が発生する12)。
続発性免疫不全による日和見感染症(帯状疱疹,ニューモシスチス肺炎,カンジダ症など)や自己免疫性疾患を合併しやすい。
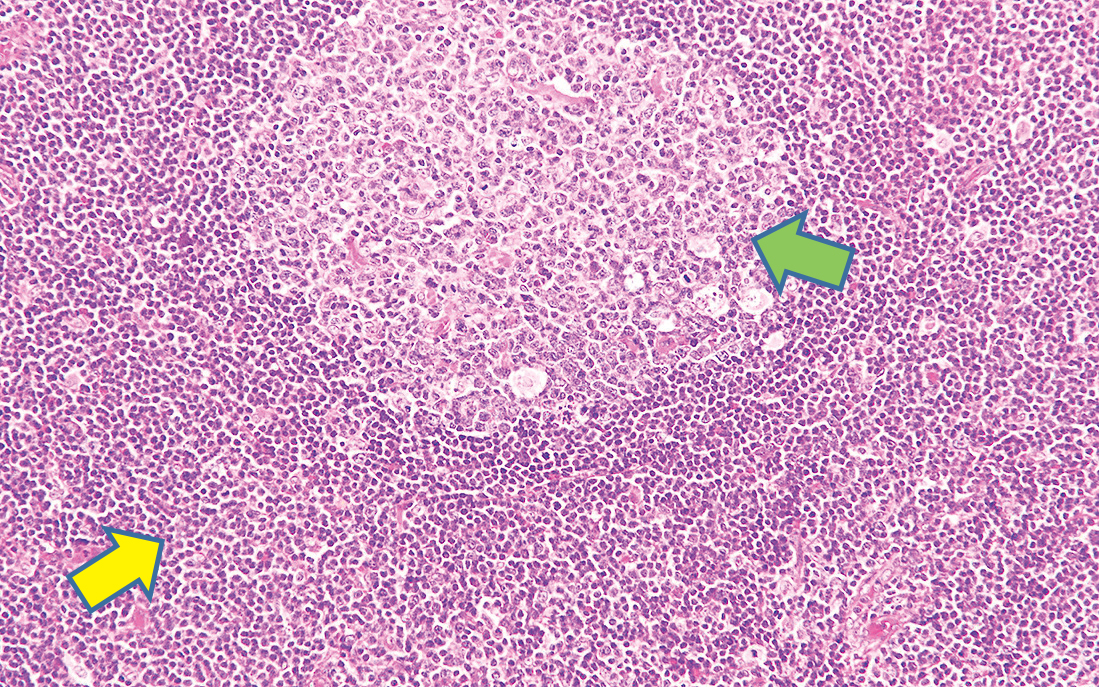
3) 組織像腫瘍細胞はびまん性,結節性,もしくは間質性に増殖し,進行した例では偽濾胞の形成をみることがある(Figure 7.19, 7.20)。凝集したクロマチンを有する成熟小リンパ球に近い小型リンパ球を主体とし,前リンパ球を混じる12)(Figure 7.21)。

びまん性,結節性の腫瘍細胞の集簇をみとめる。
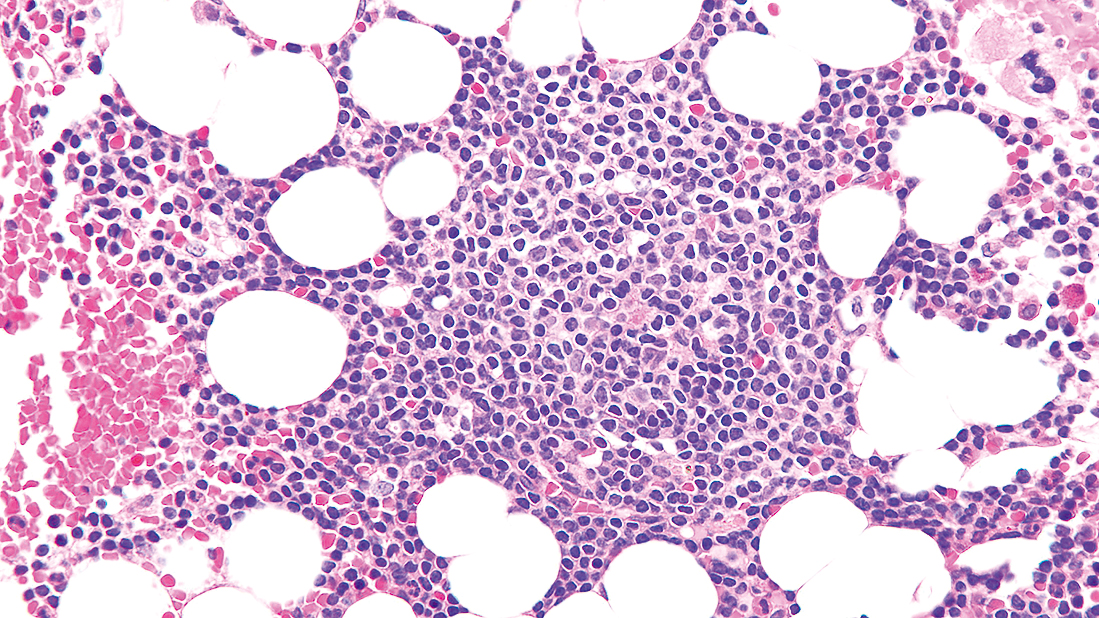
一部には濾胞様集簇の形成がみられる。
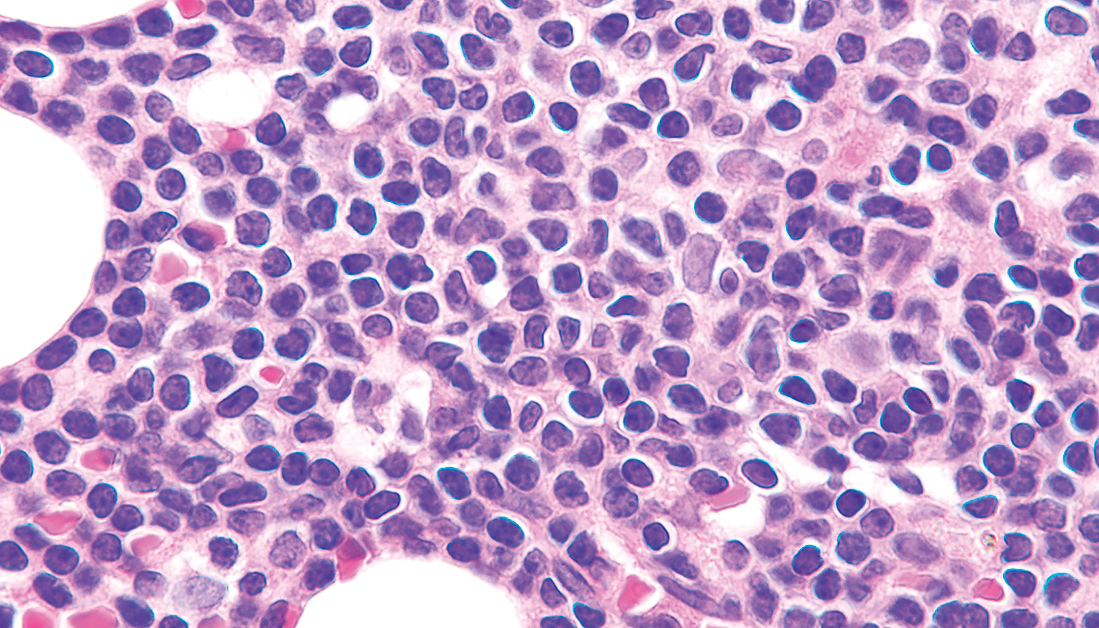
腫瘍細胞は小型リンパ球を主体とし,前リンパ球を混じる。
成熟B細胞性腫瘍でありながらT細胞抗原のCD5を異常発現することが特徴で(Figure 7.22)11),B細胞抗原のCD79a,CD23などが陽性を示すが,CD20の発現は弱いか陰性となることがある。CD10は陰性となる。

B細胞性の腫瘍であるが,CD5が異常発現する。
多発性骨髄腫は,骨髄を中心とした形質細胞(骨髄腫細胞)の単クローン性増殖と,その産物である単クローン性免疫グロブリン(M蛋白)の血中・尿中増加により特徴づけられる疾患で,形質細胞腫瘍(plasma cell neoplasma)の一つに分類されている。
WHO分類第4版における形質細胞腫瘍の分類は意義未確定の単クローン性高γグロブリン血症,形質細胞骨髄腫,形質細胞腫,免疫グロブリン沈着症,骨硬化性骨髄腫に大別される。このうちの形質細胞性骨髄腫は多発性骨髄腫と同義語である。
2) 臨床ほとんどが50歳以上で発症し,30歳未満の成人では稀で,小児にはみられない。
ほとんどの患者で尿中,血中にM蛋白がみとめられる。頻度はIgG型50%,IgA型20%,軽鎖型20%,IgD型,IgE型,IgM型,または2つのクローン型10%未満,非分泌型約3%である13)。
高カルシウム血症,腎障害(Bence-Jones蛋白による),貧血,骨病変,アミロイドーシス,易感染症など様々な初発症状をとる。
3) 組織像骨髄腫細胞は通常形態学的に成熟しており,核は類円形で,クロマチンは車軸状,時計の文字盤状と称される凝集したクロマチン,核周明庭,好塩基性の細胞質などが特徴(Figure 7.23, 7.24)だが,中には繊細なクロマチン,核小体を有する未熟な形質細胞もみられるなど,種々の程度に形態異常を示す13)。

骨髄は過形成を示している。

形態的に分化した骨髄腫細胞を多くみとめる。
また,Dutcher body(核内免疫グロブリン),Russell 小体(細胞質内免疫グロブリン:黄矢印)(Figure 7.25),細胞質内結晶構造,Matt体をみとめれば,本疾患を診断するうえで有力な所見となる14)。

核クロマチンは車軸状をし,時にRussell小体をみとめる(黄矢印)。
正常形質細胞同様,CD79a,CD138が陽性,CD38が強陽性を示す(Figure 7.26)が,正常な形質細胞と異なりCD19はほぼ常に陰性となる。CD56は正常な形質細胞では陰性だが,骨髄腫細胞では陽性の場合が多い13)。

本症例の骨髄腫細胞はλ優位の単クローン性を示す。
骨髄異形成症候群(myelodysplastic syndrome; MDS)は造血幹細胞のクローナルな腫瘍性増殖からなる疾患群で,1系統ないしは2系統以上の骨髄系細胞の形態異常(異形成)と無効造血による血球減少,急性骨髄性白血病(AML)への高い移行率を特徴とする15)。MDSのおよそ半数例で染色体異常がみられ,クローナル造血の証明と予後予測,治療方針決定のための重要な情報となる16)。また,多くの病型に分けられる。
2) 臨床像中高年者に好発するが,稀に若年者にみられる。年齢中央値は70歳,年間発生頻度は10万あたり約3~5人,男性に多くみられる15)。
多くの症例で血球減少に関係する症状で発症する。貧血が最も多く,次いで白血球減少または血小板減少で,肝脾腫は通常みられない15)。
およそ半数例で染色体異常がみられる。
3) 組織像MDSでは無効造血が特徴であり,多くの場合骨髄は過形成(Figure 7.27)ないしは正形成を示すが,一部,低形成を示す。CD34および増殖関連抗体(Ki-67,PCNAなど)陽性細胞の増加(Figure 7.28)はMDSを示唆する15)。

骨髄は細胞量が多く,過形成を示す。

CD34,p53陽性細胞の増加がみられる。
巨核球の形態異常は大部分の症例でみられ,小型成熟巨核球や免疫染色(CD42b)でしか判別できない様な微小巨核球(micromegakaryocyte)(Figure 7.29),分離円形多核巨核球などがあり,微小巨核球と分離円形巨核球がMDSの指標となる15)。

通常サイズの巨核球(緑矢印)とともに微小巨核球(黄矢印)が散見される。
赤芽球の形態異常は核の分葉化,断片化,多核化などであるが,見出すのは難しい。また,赤芽球島の形成不良や大型化した赤芽球の集簇(Figure 7.30)がみられる15)。

MDSでは時に大型化した赤芽球の集簇をみる。
顆粒球・単球では核の分葉異常(過分葉や偽ペンゲル核異常など)や顆粒の減少があげられるが,これも見出すのは難しいとされている15)。
8. 脂質蓄積症(lipidosis)―ゴーシェ病(Gaucher disease) 1) 概要脂質代謝産物の蓄積をきたす疾患群を脂質蓄積症(lipid storage diseaseあるいはlipidosis)と呼ぶ。中でも骨髄のマクロファージに脂質の蓄積を起こす代表的な疾患はゴーシェ病とニーマン・ピック病である17)。
ゴーシェ病は遺伝子異常(常染色体劣性遺伝)によりグルコセレブロシダーゼ(glucocerebrosidase)活性の低下あるいは欠損によって糖脂質が肝・脾・骨髄中のマクロファージのリソソーム内に蓄積する疾患である17)。この異常な代謝産物が蓄積したマクロファージをゴーシェ細胞と呼ぶ。
2) 臨床所見マクロファージにおける酵素活性レベルの違いにより発症時期が異なる。
1型:成人型(慢性非神経型)
2型:乳児型(急性神経型)
3型:若年型(亜急性神経型)
成人型では神経症状は伴わず,慢性に経過するため慢性貧血,血小板減少,肝脾腫,骨症状(骨痛,病的骨折)による精査の際,骨髄生検で発見されることが多いとされている。他の2つの型は重症例が多く,特に乳児型では2~3歳で死亡することが多い17)。
3) 組織所見骨髄細胞とともに淡好酸性のN/C比の小さなマクロファージ(ゴーシェ細胞)の増生がみられる(Figure 7.31, 7.32)。ゴーシェ細胞の細胞質は不規則網状あるいは細線維状(しわくちゃ紙状(“crinkled tissue-paper”appearance18))とも称される)の構造が特徴で(Figure 7.32),PAS陽性の糖脂質が確認される19)(Figure 7.33)。これに対して,同じく脂質蓄積症であるニーマン・ピック細胞は円形の小型核が中心ないしはやや偏在してみとめられ,細胞質は多数の脂肪滴を含有するため泡沫状ないしは空胞状を呈している17)(Figure 7.34挿入図)点に違いがある。

骨髄細胞とともに淡好酸性のゴーシェ細胞の増生がみられる。

ゴーシェ細胞の細胞質は不規則網目状あるいは細線維状を呈する。

不規則網目状あるいは細線維状の構造物はPAS反応陽性を示す。

ゴーシェ細胞とニーマン・ピック細胞(挿入図)では,細胞質の性状が異なる。
電顕では細胞質内に多数の不整形,地図状の封入体が1層の限界膜に囲まれて存在し,直線状を呈する無数の小管構造を入れる19)。
9. 骨髄線維症(myelofibrosis) 1) 概要骨髄の線維化は白血球浸潤,持続性の炎症,筋線維芽細胞の増殖に伴う病的な変化である。その原因は多様だが,巨核球の過剰なオーバーターンあるいは障害,apoptosisによって放出された液性因子が関与する場合が多い20)。
骨髄線維症(myelofibrosis)は骨髄が広範な線維化をきたす疾患の総称で,骨髄増殖性疾患の一つの原発性骨髄線維症と他の疾患に随伴して起こる続発性骨髄線維症がある20)。
原発性骨髄線維症は造血幹細胞に遺伝子変異(約半数にJAK2遺伝子の変異をみとめる)が生じ,腫瘍性増殖をきたし,そこで生じた巨核球を中心とした異常クローンからサイトカインが放出され,反応性に増殖した繊維芽細胞により線維化が起こる。
続発性骨髄線維症の90%は悪性腫瘍であり,その内訳は骨髄異形成症候群(myelodysplastic syndrome; MDS)が多く31%,本態性血小板血症15%,真性赤芽球増加症12%などで,ほかには癌の転移,感染症,自己免疫性疾患などが原因となる21)。
2) 骨髄線維化の評価骨髄線維化は従来から4~6段階の評価方法があり,WHOではMF0~3の4段階で分けられている(Table 7.2)。骨髄線維化の評価で重要なことは穿刺吸引標本ではなく骨髄標本によって評価することである21)。
| Grade | 所見 |
|---|---|
| MF0 | 細網繊維が正常な構造に伴って直線状に散在するが,これらが交差する所見がない。正常骨髄に相当する。 |
| MF1 | 細網繊維は増加し,交差像を伴う疎らな網目様配列が認められる。特に血管周囲に目立つ。 |
| MF2 | 密な細網繊維の網目様配列がびまん性にみとめられる。線維の交差像が目立ち,部分的に束状の膠原繊維,骨硬化所見がみられる。 |
| MF3 | 細網繊維がびまん性に密に増加し,高度の交差がみられる。太い束状の膠原繊維もみられ,明瞭な骨硬化所見もみられる。 |
骨髄線維症をきたす原疾患により骨髄像は異なる。異形を伴う巨核球増加,広範な線維化,および骨梁の増加をみとめる。さらにそれぞれの病期によっても所見が異なるためHE染色,膠原線維染色など合わせて判断する必要がある。
軽度~中等度の線維化(Figure 7.35–7.38),やや強い線維化(Figure 7.39–7.42)を示す。後者では造血細胞の減少がみられる。

細網線維はわずかに増加し,線維の交差もわずかにみとめられる(MF1)。

骨髄生検の造血巣には黒色に染め出される細網線維がみられる。

細網線維がびまん性にみられ,交差がみられる(MF1-2)。

細網線維は密に増加し,交差が目立つ(MF2)。

細胞密度の低下,線維芽細胞の増生,軽度の膠原線維の増生がみられる(MF2)。

Figure 7.39の鍍銀染色である。細網線維の交差がみられる(MF2)。

造血細胞は抑制され,線維化部が広くみられる(MF3)。

Figure 7.41の鍍銀染色では細網線維の増加と膠原線維の増加がみられる(MF3)。
症例:20歳代,女性,頸部リンパ節。
現病歴:1ヶ月ほど前より発熱,頸部および腋窩リンパ節腫脹をみとめた。
1) 概要組織球性壊死性リンパ節炎(菊池病)はわが国で特徴的にみられる疾患の一つで,38℃以上の発熱を伴うことが多く,解熱後にリンパ節の腫脹をきたす22)反応性リンパ節疾患である。
2) 臨床像好発年齢は20~30歳代,若い女性に多く,血沈亢進,白血球減少(4,000/μL以下),特に顆粒球減少が目立つとされている。
治療にかかわらず,1~2か月で治癒するが,数ヶ月から数年後に再発をみることがある22)。
3) 組織学的所見リンパ節の基本構造は概ね保たれている。斑状,地図状に広範な壊死巣が存在し(Figure 7.43),核破砕が多量にみられるが,好中球はほとんどみとめられない(Figure 7.44)。これらの核破砕物を貪食する組織球や濃縮変性した核とそれを取り巻く好酸性細胞質をみとめるいわゆるapoptosis細胞22)も種々の割合でみとめられる(Figure 7.45)。大型化したリンパ球が目立つこともある。

斑状,地図状の広範な壊死巣がみられる。

核破砕像が多数みられるが,好中球浸潤はみられない。

核破砕物を貪食する組織球をみとめる。
Apoptosis細胞を伴う壊死巣には多数のCD68(Figure 7.46左),CD3およびCD8陽性細胞がみとめられ,次いでCD4陽性を示すT細胞が多く存在する。CD163陽性組織球も出現するが,壊死巣にCD20陽性のB細胞はほとんどみられない。

壊死巣には多数のCD163陽性の組織球が観察される。
小型リンパ球が主体であるが,中型リンパ球や大型リンパ球も混在し,壊死を背景に核破砕物を貪食した組織球がみられる。好中球をみとめない(Figure 7.46右)。
2. 非腫瘍性病変―結核性リンパ節炎(lymphadenitis tuberculosa)症例:30歳代,男性,頸部リンパ節。
現病歴:1ヶ月前より右肩痛あり,右鎖骨上に腫瘤を触知。MRI,CTで右鎖骨上,縦隔,肺門,腹部のリンパ節腫脹を指摘された。
1) 概要結核菌Mycobacterium tuberculosisの初感染ならびに再活性化に際してみられる23)。リンパ節病変では頸部,縦隔,腋窩,腸間膜に多くみられる24)。
乾酪壊死,Langhans型巨細胞を伴う類上皮肉芽腫の形成が特徴である。ただし,初期には壊死をみないことがある23)。
2) 組織学的所見正常なリンパ節の構造はみられず,大型の乾酪壊死巣と類上皮肉芽腫がみとめられ,リンパ節内のほとんどを占めている(Figure 7.47)。乾酪壊死巣の周囲には組織球系の類上皮肉芽腫と少数のLanghans型多核巨細胞をみとめる(Figure 7.48, 7.49)。本症例では抗酸菌染色でごくわずかな陽性桿菌をみとめた(Figure 7.49挿入図)が,抗酸菌がみとめられることは少ない。

正常なリンパ節構造はみられず,乾酪壊死巣(左側)がみられる。

乾酪壊死を中心に周囲には類上皮細胞と少数のLanghans型多核巨細胞をみとめる。

少数のLanghans型巨細胞をみとめ,わずかに抗酸菌染色陽性の桿菌をみる(挿入図)。
乾酪壊死を伴い核にくびれを持つ類上皮の集塊をみとめる(Figure 7.50)。Langhans型多核巨細胞が時にみとめられるが,数が少なく,観察されることは少ない。

乾酪壊死とともに核にくびれを持つ類上皮細胞をみとめる。
非定型抗酸菌感染症との鑑別は遺伝子レベルでの菌の同定が必要である。
癌の転移や梗塞でも乾酪壊死様の壊死がみとめられる。また,類上皮肉芽腫はサルコイドーシスなどでもみとめられるため注意が必要である。
3. 非腫瘍性病変―ネコひっかき病(cat scratch disease)症例:20歳代,女性,鼠径部リンパ節。
現病歴:1ヶ月前より両側鼠径部リンパ節腫脹,数日前より38℃発熱出現。
1) 概要ネコやイヌに引っかかれたり噛まれるなどして傷から細菌感染することにより起こる。まず,創部の紅斑,丘疹などの皮膚症状が出現,時に発熱もみられ,1~4週間で所属リンパ節の疼痛性腫脹をみる23)。発疹やリンパ節の腫れは2~5ヶ月で多くは自然治癒すると言われている。
原因菌はBartonella henselaeとB. quintanaがあげられるが,B. henselaeが主である23)。B. henselaeはグラム陰性,多形性単桿菌である。確定診断は,病理組織検査のほかに血液検査,画像検査,血清学的診断,PCR法による遺伝子の検出などによっても行う。
2) 組織学的所見リンパ節およびリンパ節周辺組織からなる。リンパ節の基本構造は保たれ,胚中心を有する濾胞過形成を示す(Figure 7.51)。しばしば好中球性膿瘍を囲む比較的大型の肉芽腫(化膿性肉芽腫(suppurative granuloma))が形成される(Figure 7.51, 7.52)。小型の肉芽腫も少数散見される(Figure 7.53, 7.54)。

リンパ節の基本構造は保たれ,濾胞は過形成を示し,一部に大型の肉芽腫をみとめる。

中心部に好中球性膿瘍をみとめ,それを囲む大型の肉芽腫をみとめる。

Figure 7.52の拡大,好中球性膿瘍と肉芽腫をみる。

類上皮細胞が壊死を取り囲んでみとめられる。
また,リンパ節周辺組織は強い炎症と線維化を示し,リンパ節と癒合する。
3) 鑑別診断肉芽腫を形成する疾患として,鼠径リンパ肉芽腫(lymphogranuloma inguinale),エルシニアリンパ節炎(Yersinia lymphadenitis),野兎病(tularemia),結核性リンパ節炎(tuberculous lymphadenitis)などがあげられる。
4. 非腫瘍性病変―トキソプラズマ性リンパ節炎(Piringer lymphadenitis)症例:50歳代,女性,頸部リンパ節。
現病歴:2週間前より左側頸部の腫脹を自覚,リンパ節は可動性,圧痛なし。
1) 概要トキソプラズマ性リンパ節炎(Piringer lymphadenitis)は主に猫を媒介とする後天性トキソプラズマ感染である23)。ヒトへの感染は嚢子を含む猫の糞便を介して起こる。頸部,特に耳後部のリンパ節を侵すことが多く,通常全身症状はない24)。トキソプラズマ嚢子を確認できることは極めて稀であるため,血清中の抗トキソプラズマ抗体価や遺伝子検査により確認することが重要となる。
2) 組織学的所見リンパ節の基本構造は保たれ,不規則大型の胚中心を伴う濾胞過形成がみられる(Figure 7.55)。同時に,少数の類上皮細胞が集簇する小型の肉芽腫が多数散在する(Figure 7.56, 7.57)。肉芽腫には壊死はみられない。肉芽腫はT領域のみならず,胚中心にもみとめられる。好酸球はほとんどみられない。リンパ洞を埋める単球様細胞巣(Figure 7.58)が散見される。

大型の胚中心,T領域には小型肉芽腫がみられる。

少数の類上皮で構成されている肉芽腫が多数みられる。

小型の肉芽腫がみられるが,壊死はみられない。

細胞質の明るい単球様細胞はCD20陽性を示す。
また,免疫芽球や2核の大型細胞も出現することがあり,Hodgkinリンパ腫との鑑別を要する23)。
3) 免疫染色所見単球様細胞は免疫染色でCD20陽性のB細胞である。肉芽腫はCD68陽性を示す。
5. 良性病変―サルコイドーシス(sarcoidosis) 1) 概要サルコイドーシスは壊死を伴わない肉芽腫性疾患で,原因不明の全身性疾患である(指定難病84)。
リンパ節以外にも肺,皮膚,眼,骨なども侵される。リンパ節では肺門部のリンパ節が両側性に腫大することが多い23)。ツベルクリン反応陰性化,血中アンギオテンシン変換酵素上昇,血清リゾチーム上昇,気管支洗浄液でリンパ球の増加とCD4/CD8比の増加がみられる24)。
2) 臨床像若年成人,女性に多いとされる。発症年齢は20~30歳代に第1のピークがあり,次いで50~60歳代に第2のピークがあり二峰性を示す。
様々な臓器に発生し,発生部位によって症状の有無や強さが異なる。
3) 組織学的所見リンパ節の濾胞構造は消失し,小型円形の肉芽腫が多数形成され,密在する(Figure 7.59)。各々の肉芽腫は多くは互いに接し,しばしば癒合する(Figure 7.60)が,完全に癒合して大型肉芽腫に成長することはない。肉芽腫はほとんど類上皮からなり,壊死はみられない(Figure 7.61)。時にLanghans型多核巨細胞がみられる(Figure 7.62)。稀にLanghans型多核巨細胞の胞体内に星状封入体がみられるが,本病に特異的ではない23)。本症例でも明らかな星状封入体はみられない。

小型の肉芽腫が多数みられる。

小型円形の肉芽腫は密在し,しばしば融合してみとめられる。

肉芽腫は類上皮から成り,壊死は伴っていない。

時にLanghans型巨細胞がみられる。
木村病は1948年木村らにより「リンパ組織増生を伴う異常肉芽腫」として報告された疾患で,皮下に発生する良性,再発性の好酸球性肉芽腫である25)。
2) 臨床像10~20歳代の東洋人,男性に多く,頭頸部など耳鼻科領域に発生することが多い。それ以外にも鎖骨上部,腋窩,鼠径,上下肢にもみられる25)。
原因は諸説あるが,確定していない。末血中のリンパ球でのサイトカインIL-4,5,13産生能が亢進し,その結果IgE値の上昇や好酸球の増多が引き起こされると考えられている25)。
3) 組織学的所見皮下組織の境界明瞭な腫瘤で,中心部に大型のリンパ節が形成されている。リンパ節は胚中心がよく発達した濾胞過形成の所見を呈する(Figure 7.63, 7.64)。リンパ節および周辺軟部組織には好酸球の強い浸潤(Figure 7.65, 7.66)がみられる。

胚中心の発達した濾胞が多数みられる。

濾胞間には小血管の増生がみられる。

濾胞間は小血管の増生が強く,血管内皮細胞の腫大もみられ,好酸球の浸潤がみられる。

リンパ節内,周辺組織に好酸球の著明な浸潤がみられる。
また,同時に小血管の増生が強く,時として血管内皮細胞の腫大をみとめる(Figure 7.65)。
7. 境界病変―キャッスルマン病(Castleman’s disease) 1) 概要Castleman’s disease(CD)は,1950年代から1970年代にかけてCastlemanおよびKellerらによって提唱された原因不明のリンパ増殖性疾患である。
2) 臨床像CDには単発の腫瘤を形成するものと複数のリンパ節にまたがる全身性のCDがある。組織学的にはhyaline vascular type(HV型)とplasma cell type(PC型)の2つの極型があり,さらに両者の中間的な混合型がある。全身性のPC型ないしは混合型では強い臨床症状を示し,ヒトパピローマウイルス8型(HHV8)の関与が指摘されている26)。
HV型CDは,頸部,鼠径部,縦隔などの軟組織に好発し,孤在性の腫瘤を形成し,圧迫症状が主で,切除すれば再発は稀である26)。
一方,PC型や全身性CDは多クローン性高γ-グロブリン血症,易疲労感,貧血などの多彩な症状を示し,予後は不良とされている26)。
3) 組織像多数の著明なリンパ濾胞の増生が特徴的(Figure 7.67)で,マントル層は十分発達するが,構造的に胚中心の成熟は悪い26)。

著明なリンパ濾胞の増生がみられる。
HV型CD:濾胞中心部には内皮細胞の肥大を伴う肥厚した血管やそれに伴う血管外膜様の線維芽細胞および濾胞樹状細胞の増生がみられる(Figure 7.68, 7.69)。

マントル層はよく発達し,リンパ球の同心円状配列がみられる。

胚中心には内皮細胞の肥大を伴う血管の増生,血管外膜様の線維芽細胞がみられる。
PC型CD:正常の胚中心をとるが,マントル層の外側に著明な形質細胞増生がみられる(Figure 7.70)。形質細胞の量は症例によって異なる。形質細胞が腫瘍性であるかどうかは免疫グロブリンκ,λ軽鎖の発現比率の同定が有用で,腫瘍性の場合は多くはλ鎖が産生される26)。

胚中心は正常で,濾胞周囲に形質細胞の増生がみられる。λ鎖も同等数みられる。
混合型CD:HV型とPC型CDの中間的な組織像を示す症例も少なくない。この場合,胚中心の血管硬化像と濾胞周囲の形質細胞増生が共存する26)。
4) 免疫学的所見CDの診断には,免疫染色は必ずしも必要としないが,HHV8の感染の有無,形質細胞が多い場合は多クローン性であるか確認を要する26)。本症例は混合型CDで,濾胞周囲の形質細胞は多クローン性で,κ・λ鎖ともに同等数みられた(Figure 7.70)。HHV8は陰性であった。
また,別のCD症例でも萎縮した胚中心,肥厚した血管,それを伴う血管外膜様の線維芽細胞がみられた(Figure 7.71)。この症例はHHV8陽性症例であった(Figure 7.72)。

胚中心は萎縮し,血管の増生がみられ,血管の周囲に線維芽細胞がみられる。

萎縮した胚中心周囲のマントル層にHHV8感染細胞がみられる。
濾胞性リンパ腫(follicular lymphoma; FL)は胚中心の細胞の腫瘍化したリンパ腫である。くびれのある中型のリンパ球(centrocyte)と大型のリンパ球(centroblast)より構成される腫瘍細胞が,大小の濾胞様構造を呈して密に増生する腫瘍である27)。リンパ節以外にも発生し,消化管(特に十二指腸),皮膚,甲状腺などが好発臓器となる27)。
t(14:18)(q32;q21)染色体転座とBCL2/IGHがみられ,BCL2蛋白過剰発現でB細胞の不死化が生じる。
2) 発生頻度低悪性度のB細胞リンパ腫の中でMALTリンパ腫とともに頻度が高く,近年増加傾向にある。中高齢者に多いが,稀に20歳以下にもみられる。リンパ節が腫大する以外には症状がなく,病状が進行してから発見されることが多いため,診断時に骨髄浸潤が40~70%と高頻度にみられる27)。
3) 組織像濾胞様の結節構造が密に増生してみられる(Figure 7.73)。濾胞様構造には正常濾胞の胚中心にみられるtingible body macrophageはみられない。

胚中心様の不明瞭な結節が密にみとめられる。
WHO分類では濾胞性リンパ腫を,結節構成細胞の大型リンパ球(centroblast)の数の割合(対物レンズ40倍の強拡大視野(high power field; hpf)で10個の腫瘍性濾胞におけるcentroblastに類似した大型異型細胞の数)により,grade 1, 2, 3の3群に分類(grading)している。
Grade 1:0~5/hpf
Grade 2:6~15/hpf
Grade 3:> 15/hpf
Grade 3A:中型リンパ球(centrocyte)も混在
Grade 3B:大型リンパ球(centroblast)が一様に増生するもの
WHO分類改訂第4版ではgrade 1, 2についてはgrade 1–2と記載することが推奨された28)。
FL, grade 1–2では中型リンパ球が主体で,少量の大型リンパ球がみられる(Figure 7.74)。FL, grade 3Aでは多くが大型リンパ球で占められるものの中型リンパ球も混在してみとめられる(Figure 7.75)。FL, grade 3Bでは大型リンパ球が主体を占める(Figure 7.76)。

結節病変は中型リンパ球が中心で,大型リンパ球を混じる。

大型リンパ球が多いが,中型リンパ球も混在してみられる。

大型リンパ球が主体で,成熟小リンパ球もみとめられる。
腫瘍細胞はB細胞系マーカー(CD19,CD20など)が陽性で,T細胞マーカーは陰性となる。胚中心マーカーであるCD10,BCL6が陽性である場合,BCL2陽性となる(Figure 7.77–7.79)。正常の胚中心では常にapoptosisが起こっているためapoptosis抑制遺伝子であるBCL2遺伝子の発現が低下しているが,濾胞性リンパ腫では発現の低下が起こらないためBCL2陽性となる(Figure 7.79)。しかしながら,BCL2陽性となるリンパ腫は他にもみられるため,BCL2陽性だけでは濾胞性リンパ腫の診断根拠とはならないので注意が必要である27)。

濾胞胚中心細胞の核に陽性を示し,腫瘍が胚中心細胞に由来することが分かる。

BCL6とともに濾胞胚中心細胞の細胞膜に陽性となる。

正常の胚中心は陰性を示すが,FLでは多くで陽性を示す。
また,節性濾胞性リンパ腫は,CD21,CD23あるいはCD35による濾胞樹状細胞のネットワーク形成がみられるのが特徴である(Figure 7.80)28)。

節性FLでは濾胞樹状細胞のネットワークが形成される。
FLの腫瘍細胞の核はPapanicolaou染色では切れ込みのある核形不整ないしは類円形を示し,gradeにより中型~大型リンパ球を種種の割合でみとめる。これらの腫瘍細胞はMay-Giemsa染色ではクロマチンがやや凝集する中型リンパ球とクロマチンの繊細な大型リンパ球により区別ができる。
すなわちFL, grade 1–2では中型リンパ球が主体で,大型リンパ球がわずかにみとめられる(Figure 7.81)が,FL, grade 3Aでは大型リンパ球が主体となる(Figure 7.82)。さらにFL, grade 3Bでは核に緊満感のある大型リンパ球が主体で,時に核分裂像もみられる(Figure 7.83)。

FL grade 1–2例 中型リンパ球が主体で,大型リンパ球を混じる。
FL, grade 3A例 核形不整の大型リンパ球が主体を占め,切れ込みのある中型リンパ球を混じる。

FL, grade 3A例 類円形の大型リンパ球が主体を占め,小リンパ球をみる。
Papanicolaou染色では核形不整や核小体の観察に優れている。一方,May-Giemsa染色では核網の所見が取りやすいことから中型リンパ球と大型リンパ球の鑑別には欠かせない。それぞれの染色の長所を生かして観察することでFLのgrade分類は可能である。
9. 腫瘍性病変(悪性リンパ腫)―びまん性大細胞型リンパ腫 1) 概要びまん性大細胞型リンパ腫(diffuse large B-cell lymphoma; DLBCL)は,小リンパ球の核の2倍またはそれ以上の大きさの核を持つB細胞のびまん性増殖からなる腫瘍で,胚中心あるいは胚中心後の細胞の腫瘍である。悪性リンパ腫の中で最も多い型で,リンパ節のみならず,節外性にもみられる(約40%)。節外性では消化管が多いが,皮膚,中枢神経などにもみられる29)。
2) 発生頻度わが国では,悪性リンパ腫の35~25%を占め,B細胞リンパ腫の48.7%を占めるとされる29)。
3) 組織像正常のリンパ節の構造は破壊され,腫瘍細胞によって置換される(Figure 7.84, 7.85)。腫瘍細胞はいくつかの型に分けられる。

正常の濾胞構造は破壊され,腫瘍細胞がびまん性に増殖する。

腫瘍細胞は大型で核小体が目立ち,両染性の細胞質を持つ。
中心芽球型(centroblastic):最も多くみられる型で,中から大型で,繊細なクロマチン,2~4個の核小体,比較的乏しい両染性の細胞質を持つ。
免疫芽球型(immunoblastic):90%あるいはそれ以上の腫瘍細胞が中心に大型核小体を1つもち,明瞭な好塩基性細胞質を示す。
未分化大細胞型(anaplastic large cell):極めて大型の腫瘍細胞からなり,多形性に富む。B細胞マーカーが陽性であることから,未分化大細胞型リンパ腫(T細胞性)とは区別される29)。また,ALK陽性大細胞型B細胞リンパ腫は別のものとして扱われる29)。
4) 免疫染色B細胞マーカーであるCD19,CD20,CD22,CD79a陽性を示し(Figure 7.86),時にこれらのいくつかが欠損することがある。また,CD10,BCL6,MUM1もよく用いられ,染色動態により胚中心B細胞様亜分類(germinal centre B-cell subtype; GCB)と非胚中心B細胞様亜分類(non-GCB)に分かれる(Figure 7.87)。GCBはnon-GCBよりも予後がよいとされている29)。

腫瘍細胞はB細胞マーカーCD20が陽性を示す。

免疫染色CD10,BCL6,MUM1の染色動態によってGCBとnon-GCBに分けられる。
DLBCLはB細胞表面マーカーであるCD20抗原を約95%発現している。現在,治療薬として抗CD20モノクローナル抗体薬であるリツキシマブ(rituximab)(商品名リツキサン)が広く使用されている。リツキシマブはCD20を標的とし,B細胞性リンパ腫に対して特異的に作用してB細胞を殺傷する。そのためB細胞性リンパ腫においては,リツキシマブ併用CHOP療法が標準的な初回治療となっており,免疫染色によるCD20発現の結果が極めて重要となる。
5) 細胞像大型のリンパ球が主体で,背景には小リンパ球を混じる。大型のリンパ球は核小体が目立ち,核網は繊細で,May-Giemsa染色でも核クロマチンの凝集はほとんどみられない。中心芽球に相当する(Figure 7.88)。一方,免疫芽球型では,Papanicolaou染色での差は少ないものの孤在性の大型の核小体が目立つこと,May-Giemsa染色では核網は顆粒状で細胞質の青みが強い(Figure 7.89)。

クロマチンの繊細な大型のリンパ球が主体を占め,MG染色での細胞質は淡染性で,中心芽球に近い所見を呈する。

核小体の目立つ大型のリンパ球が主体を占め,MG染色での細胞質は青みが強く,免疫芽球に近い所見を呈する。
バーキットリンパ腫は8q24に位置するMYC遺伝子と免疫グロブリン(Ig)遺伝子の相互転座に起因する高悪性度のB細胞性腫瘍である30)。
バーキットリンパ腫には流行地型と非流行地型,さらには免疫不全時に発症する型がある。流行地型(アフリカ,ニューギンなど)ではEBウイルスがほぼ100%陽性を示すが,非流行地型(欧米,日本など)では稀である30)。
2) 発生頻度わが国では悪性リンパ腫全体の1~2%程度である。小児では悪性リンパ腫の25~40%を占める。小児と若年成人(30~50歳)に多いが,60歳以上にもみとめられる30)。
3) 組織像リンパ腫細胞はびまん性に増殖し,多数の核分裂像とapoptosis小体をみとめ,核片を貪食する組織球が非常に多く,星空像(starry sky appearance)をみる(Figure 7.90)。リンパ腫細胞は比較的均一な中型からやや大型の細胞で,核クロマチンは粗顆粒状,小型の核小体を有し(Figure 7.91),胞体は好塩基性で脂肪顆粒をもつ(HE染色,May-Giemsa染色では空胞としてみられる)30)。

リンパ腫細胞はびまん性に増殖し,多くの組織球が星空像を呈する。

リンパ腫細胞は小型の核小体を有し,クロマチンは粗顆粒状を呈する。
CD10,CD20,CD79a,BCL6陽性,MUM1,BCL2は陰性,MIB1はほとんどの細胞で陽性となる(Figure 7.92)30)。

B細胞マーカーのCD20のほかにCD10,BCL6が陽性を示し,ほとんどの細胞がMIB1陽性を示す。
中型の核を有し,軽度の核の大小不同がみられる。クロマチンは繊細,数個の小型核小体を有する。胞体は狭いが,好塩基性が強く,空胞がみられる。(Figure 7.93)。

クロマチンは繊細で,数個の核小体をみる。胞体は塩基性が強く,空胞がみられる。
高侵襲性B細胞性リンパ腫のうち,びまん性大細胞型B細胞性リンパ腫(DLBCL)・非特定型にもバーキットリンパ腫(BL)にもあてはまらないリンパ腫で,MYCおよびBCL2とBCL6の両方か一方の再構成を伴う高悪性度B細胞リンパ腫と高悪性度B細胞リンパ腫・非特定型の2つが含まれる31)。
「MYCおよびBCL2とBCL6の両方か一方の再構成を伴う高悪性度B細胞リンパ腫」…MYC遺伝子転座が必須で,BCL2遺伝子とBCL6遺伝子の両方ないしはどちらか一方の転座を伴う。MYC遺伝子どちらの遺伝子転座をもつものをdouble hit lymphoma,両方の転座を持つものをtriple hit lymphomaと言う。
「高悪性度B細胞リンパ腫・非特定型」…DLBCLとバーキットリンパ腫の中間型を示すが,上記の遺伝子転座を示さないものを言う。
ここでは主に前者について述べる。
2) 発生頻度正確な頻度は不明であるが,悪性リンパ腫全体の数%程度である31)。BLと同程度発生すると推定されるため,注意が必要である。
高齢者に多く,若干男性に多い31)。DLBCL, NOSに比較するとR-CHOP療法での寛解率が低く,全期間生存率は低い傾向にある31)。R-CHOP抵抗性で,寛解後すぐに再発するDLBCL, NOSでは,このタイプを疑う。
3) 組織像びまん性に増殖する細胞に軽度の大小不同があり,中型細胞とともに中心に核小体をもつ大型細胞が混在する(Figure 7.94, 7.95)。星空像(starry sky appearance)をみることが多い。

リンパ腫細胞はびまん性に増殖し,多くの組織球が星空像を呈する。

しばしば中心に核小体をもつ大型リンパ球で占められている。
免疫染色ではCD20,CD79a,PAX5が陽性を示す(Figure 7.96)ほか,75~90%でD10,BCL6が陽性(Figure 7.97),20%でMUM1陽性となる31)。BCL2遺伝子転座がみられるBCL2蛋白は陽性となる。MYC遺伝子転座が必須であるためMYC蛋白はびまん性に強陽性を示すことが多い(Figure 7.98)31)が,MYC蛋白陽性=MYC遺伝子転座ありではないため,注意が必要である。免疫染色だけではこの診断の確定はできない。

B細胞マーカーCD79a,PAX5を示す。

BLの細胞像と類似するが,やや大型リンパ球が目立つ。

多くで腫瘍細胞の核に陽性を示す。
BL同様に星空像がみられることが多い。胞体は狭く,空胞もみられ,好塩基性が強い。細胞像だけではBLとの鑑別は難しいことがあるが,強いて言えばクロマチンは繊細さにやや欠け,核の大小不同が目立つ。N/C比はBLほど大きくはない(Figure 7.99)。

BLの細胞像と類似するが,核の大小不同が目立ち,N/C比はBLほど大きくはない。
節外性臓器に付属するリンパ組織は,粘膜関連リンパ組織(mucosa associated lymphoid tissue; MALT)と呼ばれ,このリンパ組織から発生する低悪性度のB細胞性リンパ腫をMALTリンパ腫と言う32)。
MALTリンパ腫細胞は胚中心後のB細胞由来と考えられている。染色体異常としてt(11;18)などの関与が指摘されている32)。
2) 発生頻度わが国の集計では,悪性リンパ腫全体の7~8%を占め,びまん性大細胞型リンパ腫に次いで多い32)。臓器別では胃が最も多く,眼付属器,大腸,甲状腺,肺,唾液腺などでみられる32)。
特に胃のMALTリンパ腫では高率にHelicobacter pylori(H. pylori)陽性を示しており,H. pylori除菌により70~80%で完全寛解が得られる32)。
3) 組織像MALTリンパ腫の重要な組織所見は,次の5つである。1)マントル帯の外側にリンパ腫細胞がみられることが多い(Figure 7.100)。2)リンパ腫細胞はcentrocyte-like cellsあるいは単球様B細胞の形態を示すことが多い(Figure 7.101)。3)リンパ腫細胞が上皮腺管とともにlymphoepithelial legion(LEL)を形成する(Figure 7.102, 7.103)。4)しばしば形質細胞への分化がみられ,時に核内の封入体にDutcher体がみられる。5)胚中心内にリンパ腫細胞が浸潤しfollicular colonizationを形成することがある32)。MALTリンパ腫では上記のような多彩な像をみる。

リンパ腫細胞はマントル帯(緑矢印)の外側に多くみられる(黄矢印)。

リンパ腫細胞は胚中心細胞に類似したcentrocyte-like cellsの形態を示す。

粘膜内にB細胞マーカーCD20陽性のリンパ腫細胞がみられる。

リンパ腫細胞の浸潤により胃腺管の破壊がみられ,LELを形成する(矢印)。
B細胞マーカーCD20が陽性を示すが,診断根拠とはならず,免疫染色サイトケラチン(AE1/3など)によりLELの形成をみとめれば比較的容易に診断できる(Figure 7.103)32)。
時にマントル細胞リンパ腫や濾胞性リンパ腫との鑑別を要するが,マントル細胞リンパ腫ではcyclin D-1,CD5陽性を示し,濾胞性リンパ腫ではCD10が陽性を示すため鑑別に有用である。
13. 腫瘍性病変(悪性リンパ腫)―マントル細胞リンパ腫 1) 概要マントル細胞リンパ腫は,リンパ濾胞マントル帯を構成するB細胞(マントル細胞)由来の腫瘍である。95%以上の症例で,t(11;14)(q13;q32)が検出される33)。
2) 発生頻度わが国では悪性リンパ腫全体の2~3%,欧米では7~8%を占める。比較的高齢者に多く,2:1で男性に多い33)。
3) 組織像リンパ腫細胞は非腫瘍性の胚中心の周りに拡大するマントル帯としてみられる(Figure 7.104)。リンパ腫細胞は小型から中型で,一般に細胞質が乏しく,多少なりとも変形した核を有し,核に切れ込みのある胚中心細胞(centrocyte)に類似する。核小体は目立たない(Figure 7.105)33)。
非腫瘍性の胚中心(緑矢印)の周りに拡大するマントル帯(黄矢印)がみられる。

小型から中型核を有する腫瘍細胞が単調に増殖し,核には軽度の切れ込みがみられる。
増殖パターンはびまん性,結節様,非腫瘍性の胚中心の周りに腫瘍細胞が増殖するマントルゾーンパターンなど様々である33)。
4) 免疫染色定型的な陽性マーカーはCD20,CD5,cyclin D1,陰性マーカーはCD10,CD23,BCL6で,代表的なCD5陽性B細胞性リンパ腫の一つである33)(Figure 7.106)。

B細胞マーカーのCD20のほかにCD5が陽性となる。
リンパ腫細胞は小型から中型,クロマチン凝集は軽度で,時に核のくびれがみられる34)(Figure 7.107)。

リンパ腫細胞は小型~中型で,クロマチン凝集は軽度,わずかに核にくびれがみられる。
症例:20歳代,女性,右頸部リンパ節。
現病歴:2年程前よりリンパ節腫脹あり,経過観察中に一端消失するも,感冒後再度腫大。
1) 概要未分化大細胞型リンパ腫(anaplastic large cell lymphoma; ALCL)は多形性に富む大型リンパ球よりなるT細胞性リンパ腫で,CD30の発現を伴っている35)。当初はKi-1リンパ腫と呼称されていた。
WHO改訂第4版からはALK蛋白の発現により,ALK陽性ALCL,ALK陰性ALCL,primary cutaneous ALCLに分類された。
2) 発生頻度成人では非Hodgkinリンパ腫の3%,小児では15%を占める。リンパ節以外にも発生する。
ALK陽性ALCLが小児や若年成人に好発するのに対し,ALK陰性ALCLは高齢者に多い35)。また,ALK陰性ALCLはALK陽性ALCLよりも予後不良である36)。
3) 組織像リンパ節では濾胞構造が消失し,主に大型の異型細胞がびまん性に増殖する(Figure 7.108)。大型異型細胞の核は淡明で,形は円形,楕円形,不整形と多彩な形状を示し,しばしば大型の核小体を有する(Figure 7.109)。小リンパ球や好酸球が混在するが,主要な細胞は大型異型細胞である。

濾胞構造は消失し,大型で異型のある腫瘍細胞で占められている。

腫瘍細胞は大型で,核異形が強く,多彩な形状を示す。
本症例では大型異型細胞はCD30(+),CD4(+),CD3(−),CD8(−),CD20(−),PAX5(−),EMA(−),ALK(−),AE1/3(−),EBER(−)を示した。
組織学的所見,免疫染色結果より,特にCD30陽性の大型細胞がT細胞マーカーCD4陽性,B細胞マーカーCD20,PAX5陰性であることからALK陰性未分化大細胞型リンパ腫と診断された(Figure 7.110)。

腫瘍細胞はCD30陽性を示し,B細胞マーカーCD20は陰性を示す。
小型の小リンパ球とともに大型,核形不整の著明な異型細胞が混在してみとめられた。クロマチンは繊細で,大型リンパ球に類似するが,DLBCLに比し核網がやや粗く,細胞異型が強い(Figure 7.111)。

大型,核形不整な腫瘍細胞で,クロマチンは大型リンパ球に類似する。
症例:70歳代,男性,鼠径部リンパ節。
現病歴:全身性リンパ節腫脹,脾腫。
1) 概要高内皮細静脈の増生,胚中心外における濾胞樹状細胞の増生,淡明細胞の増生など特徴的な組織像を示すリンパ腫で,節性の成熟T細胞腫瘍である37)。
2) 発生頻度中高年に好発し,60歳代に最も多い。男女比は,やや男性に多い。様々な免疫反応を示す。
本邦では全悪性リンパ腫の2~3%,T細胞性リンパ腫の約10%を占める37)。
3) 臨床像血液検査で多クローン性高γ-グロブリン血症,B症状(発熱,盗汗,体重減少)を呈し,皮疹を伴う。
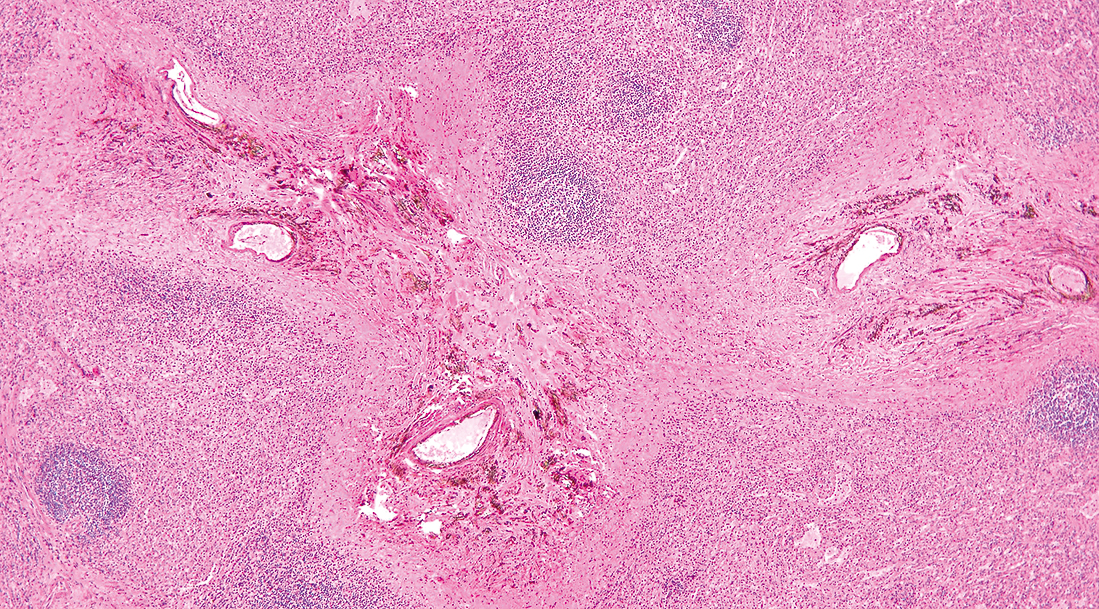
4) 組織像リンパ節には萎縮した胚中心を持つリンパ濾胞の残存がみられ,傍皮質領域が拡大する(Figure 7.112)。この傍皮質領域には多数の小血管(高内皮細静脈)が存在し(Figure 7.113),血管周囲にCD21陽性細胞(濾胞樹枝状細胞様細胞)の網状増生がみられる。この領域には核異型を持つ大型異型細胞が散見される。一部には淡明細胞が集塊状(Figure 7.114)にみられる。この淡明細胞の出現は診断的価値が高い37)といわれる。形質細胞,好酸球などの浸潤もみとめる。核小体が大型のHRS細胞様細胞も少数みとめられる。

リンパ節の胚中心は萎縮し,傍皮質の拡大がみられる。

傍皮質領域には多数の小血管(緑矢印)がみられる。

淡明細胞の存在はこの疾患の診断的価値が高い。
腫瘍細胞(T細胞)のほかに小型,大型のB細胞,免疫芽球,形質細胞,好酸球,類上皮細胞なども反応性に増えるため注意が必要である37)。
5) 免疫染色CD3陽性細胞が極めて優勢でCD4,CD7,CD8陽性細胞も多くみられる。EBV感染細胞は主に免疫芽球を含むB細胞であり,時にHRS細胞に類似することもあるので注意を要する37)。ただし,淡明細胞をはじめとする腫瘍細胞は通常EBER陰性である37)。
6) 細胞所見組織所見同様に免疫芽球や胞体の塩基性の強い小型リンパ球,好酸球など多彩な細胞がみられる。それとともに胞体の明るい淡明細胞がみられる(Figure 7.115右)。

免疫芽球など大型細胞にEBER陽性を示すが,淡明細胞をはじめとする腫瘍細胞は陰性を示す。MG染色で胞体の明るい淡明細胞が散見される。
成人T細胞性白血病・リンパ腫(adult T-cell leukemia/lymphoma; ATLL)は,レトロウイルスのHTLV-1(human T-cell leukemia virus type 1)が主としてCD4陽性のT細胞に感染し,宿主のDNAに組み込まれて発症する末梢T細胞腫瘍である。
2) 発生頻度流行地域は日本の南西部(九州,沖縄など),カリブ海,南米,中央アフリカなどで38),母乳や血液,血液製剤を介して感染すると考えられている。日本でのHTLV-1抗体陽性者(キャリア)は100万人以上,ATLL発症の危険率は2~5%,やや男性に多く,平均57歳である38)。
3) 臨床像症状として皮疹などの皮膚症状,リンパ節腫大,発熱,倦怠感,肝腫,脾腫,高カルシウム血症があげられる。
臨床病型は,急性型,リンパ腫型,慢性型,くすぶり型に分けられる。白血病像を呈する急性型はATLLの50~60%,リンパ腫型は20%で,この2型は一般的に予後不良で,1年以内に死亡する39)。
4) 組織像種々の大きさと形態を示す腫瘍細胞がびまん性に増殖する(Figure 7.116)。腫瘍細胞は核異形が非常に強く,核は深い切れ込みや脳回様,分葉状,花びら状を呈し(Figure 7.121),Reed-Sternberg様の巨細胞もみられる38)(Figure 7.117)。
腫瘍細胞はびまん性に浸潤,増殖してみられる。

腫瘍細胞は核異形が強く,脳回状,分葉状を呈する。枠内は別症例のHRS様巨細胞。
典型的な陽性マーカーはCD3,CD4,CD5,CD25,HLA-DRで,CD8は時に陽性,CD20などのB細胞マーカーが陰性を示す(Figure 7.118)38)。

T細胞マーカーが陽性,CD20などB細胞マーカーは陰性。
細胞障害性のTIA1,Granzyme Bは陰性である。また,ケモカイン受容体のCCR4が陽性である(Figure 7.119)38)。抗CCR4抗体療法は,再発・難治性CCR4陽性ATLL例で使用される。CCR4は白血球の遊走に関与するケモサイトカインの受容体の一つで,ATLLの90%以上,PTCLの約30~40%に発現をみとめる。

ATLLではほぼ全症例でCD25陽性となる。また,CCR4陽性となれば抗CCR4抗体薬(モガリズマブ)による治療が有効。
中~大型リンパ球をみとめる。Pap. 染色では核形の観察が容易で,大型細胞の立体的な多分葉状の核がみとめられる(Figure 7.120)。May-Giemsa染色では,細胞質は弱塩基性から塩基性の強いものまで種々にみられ,核形不整や核大小不同が強く,時に大型細胞に花びら状のものがみられる(Figure 7.121)。末梢血で,ATLLに特徴的な多分葉化した核の細胞は花びら細胞(flower cell)と呼ばれる(Figure 7.122)。

Pap. 染色では立体的な核形の観察が容易である(枠内:拡大像)。

腫瘍細胞は核形不整や大小不同が強く,時に花びら状のものもみられる(枠内:拡大像)。

核形不整の目立つ異型細胞が多くみられる。時に花びら状を呈し,このような細胞はflower cellと呼ばれる。
ホジキンリンパ腫(Hodgkin lymphoma; HL)は,悪性リンパ腫の一つで,腫瘍細胞はB細胞起源である。多彩な炎症細胞を背景に少数の腫瘍細胞が増殖する像を特徴としている40)。本疾患は1832年,ロンドンのGuy病院Thomas Hodgkin医師によって「リンパ節と脾臓を侵す疾患」として初めて世に報告された。
腫瘍細胞は単核のものがHodgkin(H)細胞,2核~多核のものがReed-Sternberg(RS)細胞と呼ばれ,総称してHRS細胞と呼ばれる40)。HRS細胞の出現が本症の診断根拠となる。
2) 発生頻度本疾患は人種差のあることが知られており,白人に最も多く,次いで黒人,ラテンアメリカ系,アジア人の順となっている。本邦では全リンパ腫の4~7%程度で,男性に多く,若年層と高齢層にピークがみられる40)。70%は表在性のリンパ節腫大を訴えて受診し,特に頸部の無痛性リンパ節腫脹を初発とする。
3) 組織像HLは,免疫表現型から胚中心性B細胞に特異的な遺伝子を発現する結節性リンパ球優位型リンパ腫(NLPHL)と,古典的リンパ腫(CHL)に分けられる。CHLはさらに結節硬化型(nodular sclerosis; NS),混合細胞型(mixed cellularity; MC),リンパ球豊富型(lymphocyte-rich; LR),リンパ球減少型(lymphocyte depletin; LD)に分類される。
NS型:CHLの中で最も頻度が高い。線維化が強く(Figure 7.123),lacunar(陰窩/凹窩)細胞と呼ばれるHSR細胞の出現を特徴とする。Lacunar細胞は分葉が目立つ核で,核小体はあまり目立たず,広い細胞質を有し,細胞膜の萎縮により陰窩/凹窩にあるような形態を呈する(Figure 7.124, 7.125)。本症例はNS型である。

幅の広い膠原線維により結節性病変が形成されている。

HRS細胞は細胞膜の萎縮により陰窩にあるような形態を呈することを特徴とする。

HRS細胞は陰窩にあるような形態からLacunar細胞と呼ばれる。
MC型:背景はリンパ球,形質細胞,好酸球,類上皮細胞など多彩で,WHOでは他の亜型に入らないものと定義されている。HRS細胞は典型的な大型核小体を有する。
LR型:背景は小リンパ球が主体で,腫瘍細胞は少なく,好酸球は通常みられない。他の型に比べ,高齢で男性に多い(70%)。
LD型:HRS細胞が多くみられ,背景のリンパ球は少ない。男性に多く,発症年齢中央値は30~37歳である。CHL4亜型の中で最も頻度が低い40)。
4) 免疫染色代表的な抗体はCD30で,次いでCD15が用いられる。HRS細胞は,PAX5にコードされたBSAPの発現が保持されており,免疫形質的にB細胞であるとされている。しかしながら,免疫染色ではB細胞マーカーであるCD20の発現は弱く,CD79aの発現はさらに弱い。PAX5の核発現は保持されている40)。
また,EBウイルスは古典的ホジキンリンパ腫症例の半数で感染が見出されている40)。
最近では,HRS細胞にロゼット形成するT細胞の多くにPD-1を発現するが点が注目されており,HRS細胞がPD-L1を発現することによってT細胞の抗腫瘍免疫応答を抑制すると考えられている41)。
本症例ではCD30陽性(Figure 7.126),CD20はほぼ陰性,PAX5弱陽性(Figure 7.127),EBER陽性(Figure 7.128)を示した。

HRS細胞は免疫染色CD30で細胞膜に陽性を示す。

HRS細胞はCD20陰性,PAX5弱陽性を示す。

HRS細胞に陽性を示す。NS型ではEBウイルス関与は低く,10~40%である。
明瞭な核小体を有する特徴的な大型,多核のHRS細胞がみとめられ,これらのHRS細胞を取り囲むように小型リンパ球がみられる(Figure 7.129, 7.130)。CHL NS型では,核小体はみられるものの,特徴的な非常に大型な好酸性の核小体はあまりみられない。

小型リンパ球を主体に核小体の目立つ多核HRS細胞をみとめる。

明瞭な核小体のHRS細胞を取り囲むように小型リンパ球がみられる。
症例:60歳代,女性,左顎下部リンパ節。
既往歴:大腸癌術後,左顎下部にリンパ節腫脹自覚。
1) 概要リンパ節は悪性腫瘍の転移しやすい組織で,癌腫が対象になることが多い。一方,元々頻度が低い肉腫の転移は稀である42)。
悪性細胞は輸入リンパ管を通り最初に辺縁洞にたどり着く。乳癌におけるセンチネルリンパ節生検に代表されるように,微小転移を見逃さないためには辺縁洞を注意深く観察することが重要となる。
摘出されるリンパ節は体表に近い頸部,腋窩,鎖骨上窩,鼠径部などが多い。頸部リンパ節では上気道,消化管,甲状腺などが原発巣として頻度が高く,腋窩リンパ節では乳腺,肺など,鼠径部リンパ節では下部消化管,子宮など,それぞれ転移しやすい原発巣がある42)。しかしながら,一概には言えず,あらゆる可能性を考慮する必要がある。
また,頻度は低いが非上皮性腫瘍もみとめることがある42)。
2) 鑑別方法免疫染色は上皮性・非上皮性の鑑別,原発巣推定に非常に有用となる。上皮性・非上皮性の鑑別では汎上皮マーカーAE1/AE3がよく用いられている。またCK7とCK20の染色態度の組み合わせは原発巣推定の一助となる。つまり本症例のようにCK7(−),CK20(+)となる腫瘍は結腸,直腸癌が代表的であり,既往と合わせれば大腸癌の転移であると診断可能である。さらに,臓器特異性の高い抗体(TTF-1,CDX-2,サイログロブリンなど)や,腫瘍特異性の高い抗体(クロモグラニンA,シナプトフィジンなど)を用いればさらに絞り込むことが可能となる。しかしながら常に例外もあることには注意したい。
3) 組織学的所見リンパ節内に異型上皮細胞が癒合した腺腔を形成しつつ増殖する(Figure 7.131–7.133)。免疫染色でCK7(−),CK20(+),CDX-2(+)である(Figure 7.134)ことから大腸癌の転移として矛盾しないと考える。

正常濾胞とともに異型細胞の集簇がみとめられる。

異型細胞が腺腔を形成しつつ増殖する。

異型細胞は癒合した腺腔を形成しつつ増殖する。

臓器特異性の高いCDX-2陽性であることから大腸癌の転移が示唆される。
症例:70歳代,男性。
1) 概要血管腫は増殖した血管からなる境界不明瞭な良性病変で,腫瘍であるか,組織奇形か,既存の血管の形状かはっきりしない。
血管腫は増殖した血管の形状,種類から次のように分けられる43)。
A)毛細血管腫(capillary hemangioma)
1層の内皮細胞で囲まれた小型の血管が増殖し,多数の小管腔が形成される。皮膚,皮下,粘膜下にみられることが多い。
B)海綿状血管腫(cavernous hemangioma)
壁が薄く扁平な1層の内皮細胞で囲まれた拡張した血管が多数「海綿」状に存在する。皮下,口唇,舌,肝に多い。
C)静脈血管腫(venous hemangioma)
海綿状血管腫に類似するもので,平滑筋被覆を有する中等大以上の血管からなるもの。
D)蔓状血管腫(racemose hemangioma)
筋層の発達の良い動脈性,静脈性,動静脈性の血管が迂曲して密在する先天性形成異常で,動脈性は頭に多く,拍動を触れる。
血管腫は脾原発の良性腫瘍として最も多い病変で,多くは無症候性で,解剖材料や摘脾等で見つかることが多い44)。
2) 組織像大小の管腔を有する病変がみとめられる。管腔は一層の内皮細胞で覆われ,海綿状を呈し,内腔には血液が充満してみられる(Figure 7.135–7.137)。海綿状血管腫と診断された。
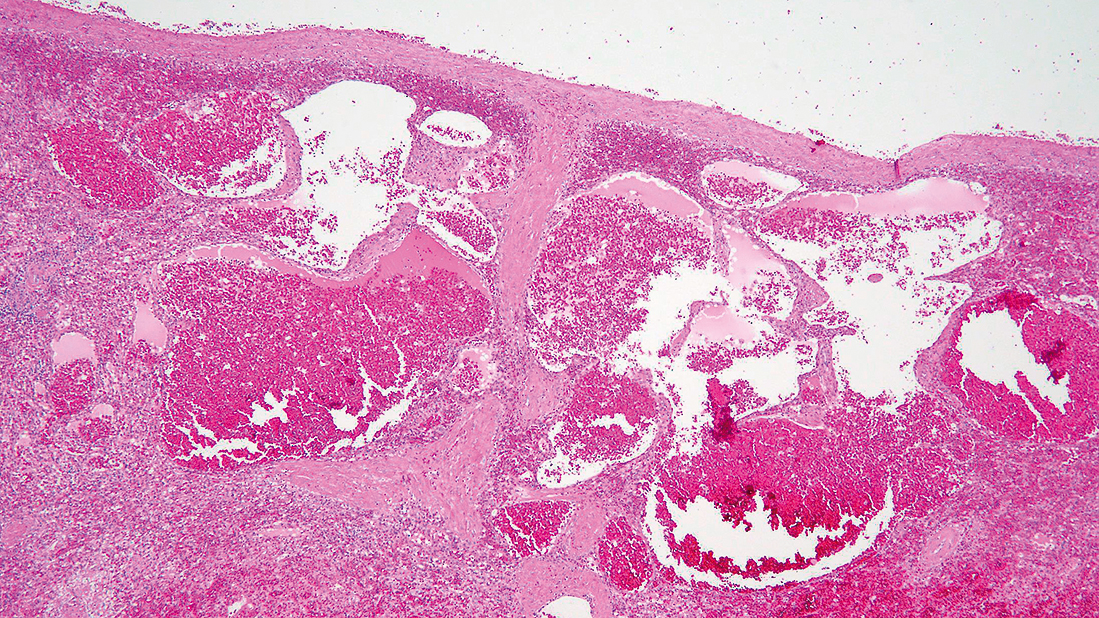
大小の管腔がみとめられる。

管腔には血液が充満してみられる。

管腔は一層の内皮細胞で覆われている。
免疫染色で内皮細胞は血管内皮に陽性となるCD31陽性,リンパ管内皮で陽性となるD2-40は陰性を示した(Figure 7.138)。

管腔の内皮細胞は血管内皮マーカーCD31陽性を示す。
症例:50歳代,男性。
1) 概要脾B細胞性濾胞辺縁帯リンパ腫(splenic B-cell marginal zone lymphoma)は脾臓の辺縁帯B細胞に由来する低悪性度B細胞リンパ腫である45)。
2) 発生頻度非常に稀で,非ホジキンリンパ腫の1%未満,全リンパ腫の0.1%とされている。脾臓原発のリンパ腫では15%を占める45)。
3) 臨床像中高年に生じ,性差はみられない。
自覚症状としては左季肋部不快感や貧血に基づく諸症状を示すことがあるが,症状は稀で,中等度から高度の脾腫をみとめる45)。経過は緩やかで,脾臓摘出術が第一選択と言われている。
4) 組織像白脾髄に病変の中心がみられる(Figure 7.139)。白脾髄は萎縮したリンパ濾胞中心(Figure 7.140緑矢印)の外側に拡大増殖した濾胞辺縁帯のリンパ球の層がみられる(Figure 7.140)。このリンパ球は比較的広い細胞質を有し,核は類円形から不整形を示し,一部は形質細胞への分化を示す。時に大型のリンパ球が混在することもある45)(Figure 7.141)。

白脾髄に病変がみられる。

萎縮したリンパ濾胞(緑矢印)と濾胞辺縁帯(黄矢印)の拡大増殖がみられる。

濾胞辺縁帯のリンパは比較的胞体が広く,時に大型のリンパ球が混在する。
多臓器の濾胞辺縁帯リンパ腫と同様に,疾患特異的とするマーカーはない45)。陽性のマーカーはCD20,CD79a,PAX5,BCL2で,陰性のマーカーはCD3,CD10,CD23,Cyclin D-1などである(Figure 7.142)。
腫瘍細胞はCD3陰性,CD20,BCL2などが陽性を示す。
脾臓の病変は腫瘍性病変,非腫瘍性病変がある。臨床の現場では腫瘍性病変はさほど多くはないが,解剖時には様々な病変に遭遇する。
脾の循環障害によって起こる病変としては
① 脾うっ血
② 破裂および出血
③ 脾梗塞
④ 門脈圧亢進症による変化
がある46)。
2) 組織像脾うっ血:全身の血行動態を反映して起こる。組織的には脾洞の拡張と血液の充満(Figure 7.143, 7.144矢印),脾索の線維性拡大がみられる46)。

脾うっ血:脾洞の拡張がみられる。

脾うっ血:脾洞には血液が充満(矢印)しており,脾索の線維性拡大がみられる。
脾梗塞:脾臓は白色梗塞を起こす代表的な臓器と言われており,動脈の塞栓による血液の循環不良が起こり,その先の組織が血管の支配領域に一致して白色梗塞(凝固壊死)となる46)(Figure 7.145図内破線右側,Figure 7.146)。また,巨脾にはしばしば梗塞を合併する。巨脾の原因としては白血病,骨髄線維症,肝硬変,特発性門脈圧亢進症などがある。

脾梗塞:破線右側に白色梗塞巣がみられる。

脾梗塞:白色梗塞巣拡大図。
① 原発性脾病変
② 門脈圧亢進症による脾腫,脾機能亢進症
③ 溶血性貧血
④ 特発性血小板減少性紫斑病
⑤ 胃癌,膵癌などの合併切除
解剖時を除き病理検査室で脾臓を扱うのは⑤が最も多い46)とされている。
4. その他(組織球症)―血球貪食症候群(hemophagocytic syndrome) 1) 概要血球貪食症候群(hemophagocytic syndrome; HPS)はマクロファージが種々の原因により活性化され,骨髄,リンパ節,脾臓,肝臓などで増殖すると同時に自己の血球を貪食する病態47)を言う。
HPSには一次性(遺伝性)と二次性(後天性)に分けられ,いずれの場合もNK細胞と細胞障害性T細胞の高度の機能不全による高サイトカイン血症を伴う48)。過剰生産されたサイトカインによって組織球が異常に活性化され,血球貪食を引き起こすと考えられている。
一次性HPSは常染色体劣性遺伝による家族性HPS,免疫不全症候群などがあり,二次性HPSには感染症関連,自己免疫関連(成人still病,SLEなど),悪性腫瘍関連,薬剤関連,移植後などがあげられ48),一次性が約5%,二次性が約95%である。
感染症関連HPSでは特にEBウイルスとサイトメガロウイルスなどが関係していると言われ,特にEBウイルスの頻度が高い。EBウイルスはT細胞に感染し,これを活性化させ,異常なサイトカイン産生をきたす47)と言われている。
悪性腫瘍関連HPSはリンパ腫関連HPSが多く,ここでもEBウイルスの関与が大きいとされている。
2) 臨床像持続する高熱,肝脾腫,リンパ節腫脹,皮疹,凝固異常を特徴とする。感染症や自己免疫疾患に関連するHPSは原疾患の治療により軽快するが,EBウイルスに伴うHPSでは,急速な多臓器不全により死に至る場合が多い48)。
3) 組織像脾洞内に正常血球(赤血球,好中球など)を貪食する組織球がみられる(Figure 7.147–7.150黄矢印)。これらの組織球はCD68,lysozyme陽性を示す48)。

脾洞内に組織球がみられる。
症例1:30歳代,男性

赤血球を貪食した組織球をみる。
症例1:30歳代,男性

複数個の赤血球を貪食した組織球もみられる。
症例2:70歳代,男性

時に好中球を貪食する組織球もみられる。
症例2:70歳代,男性
脂質代謝産物の蓄積をきたす疾患群を脂質蓄積症lipid storage diseaseあるいはlipidosisと呼ぶ。中でもマクロファージに脂質の蓄積を起こす代表的な疾患はゴーシェ病とニーマン・ピック病である17)。
ニーマン・ピック病はスフィンゴミエリナーゼ異常により,その基質であるスフィンゴミエリン(A・B型)やコレステロール(C型)が肝臓,脾臓,肺,中枢神経などへ沈着する疾患で,この異常な代謝産物が蓄積したマクロファージをニーマン・ピック細胞と呼ぶ。
2) 臨床所見≪ニーマン・ピック病の分類≫
A型:急性神経型,古典的乳児発症型
B型:慢性非神経型,内臓型
C型:亜急性神経型,若年型
A・B型では,酸性スフィンゴミエリナーゼ遺伝子SMPD1変異による酵素活性レベルの違いにより発症時期が異なる。A型では中枢神経に沈着が起こることにより高度の肉体的・知的発達不全をきたし,幼児期に死亡することが多い。B型では沈着が神経組織以外の部に起こるため,小児期から成人で発症し,肺疾患を合併するが,経過は多様である17)。
C型はNPC1またはNPC2遺伝子の変異によるもので,通常1~2歳で発症し,その後神経変性が緩徐に進行する17)。
3) 組織像赤脾髄に円形の明るい細胞質を有するニーマン・ピック細胞をびまん性にみとめる(Figure 7.151, 7.152)。これらのニーマン・ピック細胞は円形の小型核が中心ないしはやや偏在してみとめられる(Figure 7.153, 7.154)。細胞質は多数の脂肪滴を含有するため泡沫状ないしは空胞状を呈している(Figure 7.154)。空胞は脂肪染色で陽性を示し,PAS反応では陰性ないしは弱陽性を示す。一方,同じく脂質蓄積症であるゴーシェ細胞では,しわくちゃ紙状17)(“crinkled tissue-paper” appearance18))の細胞質を示しており(Figure 7.154挿入図),PAS反応で陽性を示し,違いがよく分かる。

赤脾髄に円形の明るい細胞質を有するニーマン・ピック細胞をびまん性にみとめる。

Figure 7.147の中拡大図。

ニーマン・ピック細胞は円形の小型核が中心ないしはやや偏在してみとめられる。

細胞質には多数の脂肪滴を有し,泡沫状を呈する(挿入図はゴーシェ細胞)。
Gamna-Gandy結節は,肝硬変や特発性門脈圧亢進症などの門脈圧亢進をきたす疾患でみとめられる。脾臓の慢性うっ血により,脾被膜,脾柱の動脈周囲に限局性出血が生じ,これにヘモジデリン沈着や石灰沈着が起こるために生じると考えられている。MRIでは点状の低信号として確認でき,超音波でも散在性の点状高エコーとしてみとめられる。
2) 組織像肝硬変,特発性門脈圧亢進症など高度な門脈圧亢進症で非特異的にみとめられる所見で,赤脾髄の高度な拡大と線維化がみられ,ヘモジデリンの沈着,石灰化がみられる49)(Figure 7.155–7.157)。ヘモジデリン沈着部は鉄染色(ベルリン青染色)で陽性(青く染め出される)を示す。(Figure 7.158)。
赤脾髄の高度な拡大と線維化がみられる。

赤脾髄の線維化がみられる。

出血の遺残としてのヘモジデリンの沈着や石灰化をみる。

ヘモジデリン沈着部はベルリン青染色で青く染め出されているのが確認できる。
本論文に関連し,開示すべきCOI 状態にある企業等はありません。
佐藤 初代(豊川市民病院)…I, II, III
担当編集委員所 嘉朗(愛知県がんセンター)